2 註解
在一定溫度下,水中[H]和[OH-]的乘積(Kw)是一個常數,這個常數叫做水的離子積(曾用名:離子積常數)。水的離子積又叫水的自電離常數。水的電離[H2O(l)?xml:namespace prefix = v ns = "urn:schemas-microsoft-com:vml" /
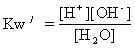
水是純液體,[H2O]可看作是一個常數,所以Kw=[H][OH-]。Kw值跟溫度有關,在25℃,Kw=[H][OH-]=1×10-7=×1×10-7=1×10-14。爲了計算簡化,常常把這個值作爲室溫下水的離子積。在物質的稀水溶液中,[H2O]和純水的[H2O]幾乎相同,因此Kw也幾乎相等。這就是說,在任何酸性(或鹼性)溶液中,同時存在H和OH-,只不過[H]和[OH-]的相對大小不同而已。在常溫下,[H]和[OH-]的乘積等於1×10-14。因此,水溶液的酸鹼性只要用一種離子(H或OH-)的濃度表示。