1 拼音
wèi ái guī fàn huà zhěn liáo zhǐ nán (shì xíng )
《胃癌規範化診療指南(試行)》由國家衛生和計劃生育委員會於2013年4月23日衛辦醫管發〔2013〕33號印發。
胃癌規範化診療指南(試行)
3 2 術語和定義
下列術語和定義適用於本指南。
早期胃癌(earlygastric cancer,EGC):是指病變侷限於粘膜或粘膜下層,不論有無淋巴結轉移的胃癌,在肉眼下大體類型分爲隆起型(I型)、淺表型(II型)、凹陷型(III型)和混合型。
6 5 診斷依據
6.1 5.1 病因
胃癌的病因迄今尚未闡明,但多種因素會影響胃癌的發生。目前所知主要與下列因素相關:①幽門螺桿菌感染;②亞硝基化合物;③高亞硝酸鹽的攝入;④二羰基化合物;⑤真菌;⑥遺傳性。
6.2 5.2 高危人羣
5.3.2 年齡:胃癌的發病率隨着年齡的增加而顯著升高。
5.3.3 飲食:加鹽醃製蔬菜或煙燻肉和魚。
5.3.4 吸菸:吸菸男性死於胃癌的人數是不吸菸男性的2倍。
5.3.5 治療:接受過胃部手術。
5.3.7 家族腫瘤疾病史:包括家族胃癌史,遺傳性非息肉性腸癌,家族性腺瘤性息肉等遺傳性疾病等。
5.3.9 肥胖:超過正常體重20~25公斤的男性患胃癌風險更高。
5.3.10 經濟狀況:經濟較差的地區,胃癌的發病率較高。
6.3 5.3 症狀
6.3.1 5.3.1 發病時間
發病到就診時間,在3個月之內佔10%,在3個月至2年之間佔70%,在2年以上佔20%。
6.3.2 5.3.2 主要症狀
沒有特異性表現。癌症早期幾乎不會有症狀,以消瘦爲最多,其次爲胃區疼痛、食慾不振、嘔吐等。初診時患者多已屬晚期。早期胃癌的首發症狀,可爲上腹不適(包括上腹痛,多偶發),或飽食後劍突下脹滿、燒灼或輕度痙攣性痛,可自行緩解;或食慾減退,稍食即飽。癌發生於賁門者有進食時哽噎感,位於幽門部者食後有飽脹痛,偶因癌破潰出血而有嘔血或柏油便,或因胃酸低,胃排空快而腹瀉,或患者原有長期消化不良病史,致發生胃癌時雖亦出現某些症狀,但易被忽略。少數患者因上腹部腫物或因消瘦,乏力,胃穿孔或轉移竈而就診。
6.4 5.4 體徵
5.4.1 早期胃癌可無任何體徵。
5.4.2 中晚期胃癌以上腹壓痛最常見。1/3患者可捫及結節狀腫塊,堅實而移動、多位於腹部偏右相當於胃竇處,有壓痛。胃體腫瘤有時可觸及,但位於賁門者則不能捫到。
5.4.3 轉移性體徵
轉移到肝臟可使之腫大並可捫到結實結節,腹膜有轉移時可發生腹水,出現移動性濁音。有遠處淋巴結轉移時可摸到Virchow淋巴結,質硬而不能移動。肛門指檢在直腸膀胱間凹陷可摸到腫塊。在臍孔處也可捫到堅硬結節,併發Krukenberg瘤時陰道指檢可捫到兩側卵巢腫大。
5.4.4 伴癌綜合徵
包括反覆發作性血栓靜脈炎(Trousseau徵)、黑棘皮病(皮膚皺摺處有色素沉着,尤其在兩腋)、皮肌炎、膜性腎病、微血管病性溶血性貧血等。
6.5 5.5 輔助檢查
6.5.1 5.5.1 實驗室檢查
5.5.1.1 血液檢查 常見貧血,約50%爲缺鐵性貧血,是長期失血所致;或由營養缺乏導致惡性貧血,則見巨幼細胞貧血;血沉增快。
5.5.1.2 選大便潛血試驗 大便潛血試驗常呈持續陽性,檢測方便,可輔助診斷。
5.5.1.3 腫瘤標誌物檢測 目前臨牀所用胃癌標誌物主要有CEA、CA19-9等,但特異性均不強,聯合檢測可增加其靈敏性及特異性。
5.5.1.3.1 CEA 癌胚抗原是一種富含多糖的蛋白複合物,是胚胎和胎兒期產生的癌胚抗原,可評價胃癌的預後。與進展低分化腺癌相關,亦與腫瘤大小、漿膜面浸潤、淋巴結轉移相關,可與其它指標聯合應用以評價胃癌的化療療效。如CEA水平下降範圍>50%或降至正常範圍並持續4周以上,可作爲治療有效指標,如治療後持續增高,提示預後不良。
5.5.1.3.2 CA19-9(可選擇) 是一類含黏液成分的大分子糖蛋白,與腫瘤大小、淋巴結轉移及浸潤深度相關,是胃癌患者獨立判定預後的指標。血清中高水平的CA19-9提示胃癌患者生存期縮短,可與其他指標聯合應用提示胃癌的腹膜復發、腹腔種植,是比CEA更爲敏感的指標。
6.5.2 5.5.2 影像學檢查
5.5.2.1 胸部X射線檢查 必須同時拍胸部正位和側位片,排除有無肺轉移,對於胸片發現病竈而難以定性的可選用胸部增強CT檢查。
5.5.2.2 上消化道造影檢查 作爲胃癌診斷首選常規檢查。行氣鋇雙重對比造影有助於觀察腫瘤在胃腔內侵潤範圍、腫塊部位及胃腔狹窄程度、有無幽門梗阻等,並可通過觀察胃粘膜的形態、胃壁的柔軟程度等,與胃炎性病變、胃壁在性病變及胃淋巴瘤等相鑑別。
5.5.2.3 CT檢查 CT檢查已廣泛應用於臨牀,有助於觀察胃部腫瘤對胃壁的浸潤深度、與周圍臟器的關係、有無淋巴結轉移和遠處(如肝臟、卵巢、腹膜、網膜等)轉移。對於胃部腫瘤較大者,建議行腹部、盆腔CT檢查,以瞭解盆腔有無轉移,特別是對於女性患者,觀察有無卵巢轉移。對於無CT造影劑過敏的患者,均應行增強CT掃描,有助於檢出微小轉移竈。
5.5.2.4 MRI檢查(可選) 受設備、掃描技術及檢查費用等因素影響,MRI檢查目前尚不能作爲胃癌患者的常規檢查,但對於超聲或CT檢查懷疑肝轉移的患者,MRI有助於明確診斷。
5.5.2.5 超聲檢查 超聲檢查簡單易行、價格便宜,可作爲胃癌患者的常規檢查。主要用於發現腹盆腔重要器官及淋巴結有無轉移,也可用於鎖骨上、頸部淋巴結檢查。對於有條件的醫院還可開展超聲導引下行肝臟、淋巴結穿刺活檢,有助於腫瘤診斷及分期。
各種檢查診斷報告均應體現TNM分期理念。
6.5.3 5.5.3 腔鏡檢查
5.5.3.1 內鏡檢查 是胃癌診斷中最重要的手段之一,對於胃癌的定性定位診斷和手術方案的選擇具有重要作用。對擬行手術治療的患者爲必需的常規檢查項目。此外,內鏡檢查前必須充分準備,建議應用去泡劑和去粘液劑,仔細觀察各部位,採集圖片,對可疑部位應用染色和放大技術進一步觀察,進行指示性活檢,這是提高早期胃癌檢出率的關鍵。提高胃癌的發現率,是現階段降低胃癌死亡率的重要手段之一。
5.5.3.2 超聲內鏡檢查 可直接觀察病變本身,還可通過超聲探頭探測腫瘤浸潤深度及胃周腫大淋巴結,是一種較爲可靠的胃癌術前分期方法,有助於胃癌的診斷、臨牀分期及制定手術方案。
6.5.4 5.5.4 細胞學檢查
5.5.4.1 內鏡細胞學檢查 在纖維鏡直視下,用沖洗、擦刷及印片3種方法取細胞,其陽性率較高;或插入胃管用緩衝液反覆沖洗胃壁,再收集緩衝液,沉渣後作塗片進行細胞學檢查,兩種細胞學檢查陽性率均可達90%以上。
5.5.4.2腹水細胞學或術中腹腔沖洗或灌洗細胞學檢查可明確是否存在腹腔遊離癌細胞(FCC),對指導臨牀分期具有重要意義。
7 6 分類和分期
7.1 6.1 胃癌的分類

7.2 6.2 分期
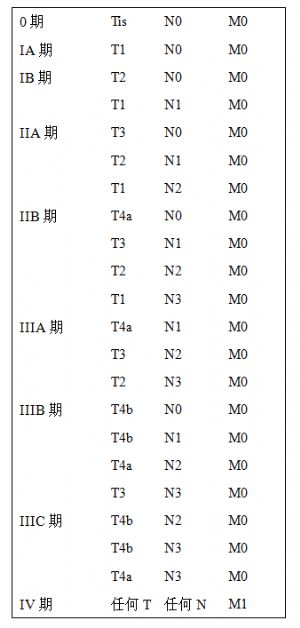
目前爲止胃癌的分期仍未完全一致,較常使用的是美國分期系統,日本胃癌分期系統和國際抗癌聯盟(UICC)三種。目前最新的胃癌分期採用美國癌症聯合協會(AJCC)公佈的2009年胃癌國際分期。
AJCC胃癌TNM分期(2009年第七版)
T分期
T0:無原發腫瘤證據
Tis:原位癌,上皮內腫瘤,未侵及固有層揭陽市人民醫院外科呂文強
T1:腫瘤侵犯固有膜、粘膜肌層或粘膜下層
T1a腫瘤侵犯固有膜或粘膜肌層
T1b腫瘤侵犯粘膜下層
T2:腫瘤侵犯固有肌層
注:1.腫瘤穿透肌層,進入胃結腸或肝胃韌帶,或進入大網膜、小網膜,但未穿透覆蓋這些結構的髒層腹膜,這種情況腫瘤就爲T3,如果穿透了這些結構的髒層腹膜腫瘤就爲T4。
2.胃的鄰近結構包括脾、橫結腸、肝、隔肌、胰腺、腹壁、腎上腺、腎、小腸和後腹膜。
3.腫瘤由胃壁延伸到十二指腸或食管,T由包括胃在內的最嚴重處的浸潤深度決定。
N分期
注:不論切除及檢查的淋巴結總數,若所有淋巴結都沒有轉移,定爲pN0。
M分期
AJCC胃癌TNM分期表(2009年第七版)
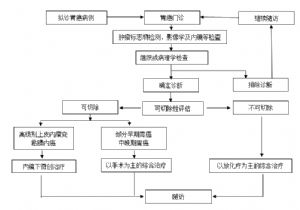
8 7 診斷和鑑別診斷
8.1 7.1 診斷
8.1.1 7.1.1 臨牀診斷
主要依據:①早期可無症狀和體徵,或出現上腹部疼痛、飽脹不適、食慾減退;或原有胃潰瘍症狀加劇,腹痛爲持續性或失去節律性,按潰瘍病治療症狀不緩解,可出現嘔血、黑便;②晚期體重下降,進行性貧血、低熱,上腹部可觸及包塊並有壓痛,可有左鎖骨上淋巴結腫大、腹水及惡病質;③賁門部癌侵犯食管,可引起嚥下困難;幽門部癌可出現幽門梗阻症狀和體徵;④實驗室檢查早期可疑胃癌,遊離胃酸低度或缺乏,紅血球壓積、血紅蛋白、紅細胞下降,大便潛血(+);腫瘤標誌物異常增高;⑤影像學檢查提示胃癌(胃氣鋇雙重對比造影、CT)。
8.1.2 7.1.2 病理診斷
主要依據胃鏡活檢組織學病理診斷。有條件的醫療衛生機構,應行免疫組化檢查鑑別腫瘤的組織學分型或確定腫瘤的神經內分泌狀況。近年來,臨牀更重視胃癌的術前分期,根據術前分期制定合理治療方案。
8.2 7.2 鑑別診斷
8.2.1 7.2.1 與胃部良性疾病的鑑別
7.2.1.1 胃潰瘍 胃癌無特徵性的症狀和體徵,特別是青年人胃癌常被誤診爲胃潰瘍或慢性胃炎。胃潰瘍的某些典型X線表現可作爲診斷依據,如龕影一般突出於腔外,直徑在2cm以內,其口部光滑整齊,周圍粘膜呈輻射狀,胃壁柔軟可擴張等;而進展期潰瘍型癌的龕影較大,且位於腔內,常伴有指壓痕及裂隙破壞,局部胃壁僵硬,胃腔擴張性差等。但某些胼胝性潰瘍易與潰瘍型癌相混淆,需要進一步作胃鏡活檢予以鑑別。
7.2.1.2 胃息肉(胃腺瘤或腺瘤性息肉) 來源於胃粘膜上皮的良性腫瘤可發生於任何年齡,但以60~70歲多見。較小的腺瘤可無任何症狀,較大者可引起上腹部飽脹不適,隱痛、噁心。腺瘤表面粘膜糜爛、潰瘍出血而引起黑便,臨牀表現疑似胃癌。X線鋇餐檢查顯示爲直徑1cm左右,邊界完整的圓形充盈缺損,帶蒂腺瘤推壓時可移動。胃腺瘤常與隆起型早期胃癌相混淆,宜胃鏡活檢予以確診。
7.2.1.3 胃平滑肌瘤 可發生於任何年齡,多見於50歲以下。其瘤體多單發,大小2~4cm,好發於胃竇及胃體部,呈圓形或橢圓形。患者常有上腹飽脹不適、隱痛或脹痛。當腫瘤增大、供血不足,形成潰瘍時亦可出現間歇性嘔血或黑便,約有2%可惡變成平滑肌肉瘤。胃鏡檢查可與胃癌相區別,但難以確定屬平滑肌瘤或平滑肌肉瘤。
7.2.1.4 胃巨大皺襞症 與浸潤型胃癌相似,好發於胃上部大小彎處。良性巨大皺襞X線檢查可見胃粘膜呈環狀或彎曲改變,而浸潤型胃癌粘膜多爲直線形增粗。另外,巨大皺襞症常伴有低蛋白血症,而浸潤型胃癌可見惡液質。
7.2.1.5 肥厚性胃竇炎 多由幽門螺旋桿菌感染引起,可引起胃竇狹窄、蠕動消失,胃壁有伸展性;浸潤型胃癌粘膜平坦或呈顆粒變形、胃壁僵硬、低張造影,兩者區別較大。
7.2.1.6 疣狀胃炎 多發於青年,常合併十二指腸潰瘍,與胃癌較易鑑別。
7.2.1.7 胃黏膜脫垂 胃粘膜脫垂症是由於異常鬆弛的胃粘膜逆行進入食管或脫入十二指腸球部導致胃黏膜脫垂。通過x線鋇餐檢查可確診。腹痛呈週期性、節律性,經胃鏡檢查較易區別。
8.2.2 7.2.2 與其他胃部惡性腫瘤相鑑別
7.2.2.1 原發性惡性淋巴瘤 佔胃部惡性腫瘤的0.5%~8%。多見於青壯年,好發於胃竇、幽門前區及胃小彎。病變源於粘膜下層的淋巴組織可向周圍擴展而累及胃壁全層,病竈部漿膜或粘膜常完整。當病竈浸潤粘膜40%~80%時,發生大小不等、深淺不一的潰瘍。臨牀表現有上腹部飽脹、疼痛、噁心、嘔吐、黑便、胃納減退、消瘦、乏力、貧血等非特異性症狀。乙醇常可誘發胃淋巴瘤患者腹痛的發生,少許患者伴有全身皮膚瘙癢症。X線鋇餐檢查病竈的表現率可達93%~100%,但能確診爲胃淋巴肉瘤者僅10%左右。特徵性改變爲瀰漫性胃粘膜皺襞不規則增厚,有不規則地圖形多發性潰瘍,潰瘍邊緣粘膜隆起增厚形成大皺襞;單發或多發的圓形充盈缺損,呈“鵝卵石樣”改變。
7.2.2.2 胃肉瘤 佔胃惡性腫瘤的0.25%~3%,多見於老年。好發於胃底、胃體,瘤體一般較大,常在10cm以上,呈球形或半球形,由於癌體巨大其中央部常因血供不足而形成潰瘍。臨牀表現主要爲上腹部疼痛、不適、噁心、嘔吐、胃納減退、消瘦、發熱、上消化道出血。多數患者因瘤體巨大,在腹部可捫及腫物,局部有壓痛。X線鋇餐檢查可見粘膜下型胃平滑肌肉瘤,於胃腔內可見邊緣整齊的球形充盈缺損,其中央常有典型的"臍樣"龕影;漿膜下型者則僅見胃壁受壓及推移徵象;胃底平滑肌肉瘤在胃泡內空氣的對比下可見半弧形狀組織塊影。胃鏡檢查時粘膜下型平滑肌肉瘤的表面粘膜呈半透明狀,其周圍粘膜可呈“橋形”皺襞。腫瘤向胃壁浸潤時,其邊界不清,可見潰瘍及粗大之粘膜皺襞,胃壁僵硬,一般與胃癌不難鑑別。
此外,胃癌需與胃粘膜脫垂、胃類癌、胃底靜脈瘤、假性淋巴瘤、異物肉芽腫等病變相鑑別。當上腹部摸到腫塊時需與橫結腸或胰腺腫塊相區別。有肝轉移者與原發性肝癌者相區別。鑑別診斷主要通過X線、鋇餐造影、胃鏡和活組織病理檢查。
9 8 治療
9.1 8.1 治療原則
臨牀上應採取綜合治療的原則。根據病人的機體狀況,腫瘤的病理類型、侵犯範圍(病期)和發展趨向,有計劃地、合理地應用現有的治療手段,以期最大幅度地根治、控制腫瘤和提高治癒率,改善病人的生活質量。對擬行放、化療的病人,應做Karnofsky或ECOG評分(見附錄3)。
胃癌的治療主要分爲手術治療、放射治療和化學治療及其相關治療。
9.2 8.2 手術治療
9.2.1 8.2.1 手術治療原則
手術切除是胃癌的主要治療手段,也是目前能治癒胃癌的唯一方法。外科手術的病竈完整切除及胃斷端5cm切緣,遠側部癌應切除十二指腸第一段3~4 cm,近側部癌應切除食管下端3~4 cm,已被大多數學者認可。現常以D表示淋巴結清除範圍,如D1手術指清除至第1站淋巴結,如果達不到第1站淋巴結清除的要求則爲D0手術,D2手術指第2站淋巴結完全清除。
對於遠端胃癌,次全胃切除較全胃切除併發症少;對於近端胃癌,腫瘤較早的可考慮行近端胃大部切除術;多數進展期近端胃癌宜施行全胃切除。
減狀手術和姑息性切除的主要目的:①減狀,如解決腫瘤引起的梗阻、出血、穿孔等;②減瘤,如將肉眼可見腫瘤儘可能切除,減少腫瘤負荷,便於術後進一步治療(如放療、化療等)。晚期胃癌患者治療的目的是改善生活質量。
9.2.2 8.2.2 手術治療模式(適應證)
8.2.2.1 可切除的腫瘤 ①T1a~T3:應切除足夠的胃,並保證顯微鏡下切緣陰性(一般距腫瘤已邊緣≥5cm);②T4腫瘤需將累及組織整塊切除;③胃切除術需包括區域淋巴結清掃術(D),推薦D2手術,切除至少15個或以上淋巴結;④常規或預防性脾切除並無必要,當脾臟或脾門受累時可考慮行脾切除術; ⑤部分病人可考慮放置空腸營養管(尤其是推薦術後進行放化療者)。
8.2.2.2 無法切除的腫瘤(姑息治療)①若無症狀則不進行姑息性胃切除術;②不需要淋巴結清掃;③短路手術有助於緩解梗阻症狀;④胃造口術和/或放置空腸營養管。
8.2.2.3 無法手術治癒的標準①影像學證實或高度懷疑或活檢證實N3以上淋巴結轉移;②腫瘤侵犯或包繞大血管;③遠處轉移或腹膜種植;④腹水細胞學檢查陽性。
9.2.3 8.2.3 手術禁忌證
8.2.3.1 全身狀況惡化無法耐受手術。
8.2.3.2 局部浸潤過於廣泛無法切除。
8.2.3.3 有遠處轉移的確切證據,包括多發淋巴結轉移、腹膜廣泛播散和肝髒多竈性轉移等。
8.2.3.4 心、肺、肝、腎等重要臟器功能有明顯缺陷,嚴重的低蛋白血症和貧血、營養不良無耐受手術者。
9.3 8.3 放射治療(不具備放療條件者轉上級醫院)
放射治療主要用於胃癌術後的輔助治療,不可手術局部晚期胃癌的同步放化療,以及晚期轉移性胃癌的姑息減症治療。
9.3.1 8.3.1 原則
8.3.1.1 胃癌無論術前或術後放療均建議採用順鉑+/-氟尿嘧啶及其類似物爲基礎的同步放化療。
8.3.1.2 胃癌D0-D1根治性切除術後病理分期爲T3,T4或N+但無遠處轉移的病例應給予術後同步放化療;標準D2根治術後病理分期爲T3,T4或區域淋巴結轉移較多的建議行術後同步放化療。
8.3.1.3 非根治性切除局部有腫瘤殘存病例(R1或R2),只要沒有遠處轉移均應考慮給予術後局部區域同步放化療。
8.3.1.4 無遠處轉移的局部晚期不可手術切除胃癌。如果病人一般情況允許,到具備相應資質的醫院給予同步放化療,期望取得可手術切除的機會或長期控制的機會。
8.3.1.5 術後局部復發病例如果無法再次手術,之前未曾行放療,身體狀況允許,可考慮同步放化療。放化療後4-6周評價療效,期望爭取再次手術切除,如無法手術建議局部提高劑量放療並配合輔助化療。
8.3.1.6 不可手術的晚期胃癌出現嘔血、便血、吞嚥不順、腹痛、骨或其他部位轉移竈引起疼痛,嚴重影響患者生活質量時,如果病人身體狀況允許,通過同步放化療或單純放療可起到很好的姑息減症作用。
8.3.1.7 放療使用常規或轉入具備條件的醫院採用適形調強放療技術。
8.3.1.8 需要術後輔助放療的病例在放療前要求肝腎功能和血象基本恢復正常。
9.3.2 8.3.2 療效評價
放射治療的療效評價參照WHO實體瘤療效評價標準或RECIST療效評價標準(見附錄4)。
9.3.3 8.3.3 重要器官保護
採用常規放療技術或調強適形放療技術時,應注意對胃周圍臟器特別是腸道、腎臟、和脊髓的保護,以避免產生嚴重的放射性損傷。
9.3.4 8.3.4 放射治療技術
三維適形放療技術(3DCRT)和調強放療技術(IMRT)是目前較先進的放療技術。如醫院具備此條件,可用於胃癌治療,並用CT或PET/CT進行放療計劃設計。
9.4 8.4 化學治療
胃癌化療分爲新輔助化療(不具備條件者轉上級醫院實施)、術後輔助化療和姑息性化療。對於根治術後病理分期爲II期和III期的患者,建議術後採用順鉑和5-氟尿嘧啶爲主的方案行輔助化療。對於術後復發、或局部晚期不可切除、或轉移性胃癌患者,採用以全身姑息性化療爲主的綜合治療。
9.4.1 8.4.1 原則
8.4.1.1 掌握臨牀適應證。
8.4.1.2 強調治療方案的規範化和個體化。
8.4.1.3 所選方案及使用藥物可參照規範,並根據當地醫院具體醫療條件實施。
9.4.2 8.4.2 療效評價
化學治療的療效評價參照WHO實體瘤療效評價標準或RECIST療效評價標準(見附錄4)。
9.4.3 8.4.3 常用藥物和方案
胃癌常用的化療藥物:5-氟尿嘧啶、卡培它濱、替吉奧、順鉑、依託泊苷、阿黴素、表阿黴素、紫杉醇、多西他賽、奧沙利鉑、伊立替康等。
常用化療方案:
ECF方案(表阿黴素/順鉑/5-氟尿嘧啶)及其改良方案(卡培他濱代替5-氟尿嘧啶)
XP方案(卡培它濱/順鉑)
SP方案(替吉奧/順鉑)
10 9 隨訪
胃癌術後輔助治療結束後,2年內每隔3-4月應全面複查一次,2-5年內每半年複查一次。5年以後每年複查一次。包括體檢,檢測腫瘤相關標誌物(CEA,CA19-9等),X線胸片、超聲、腹盆腔增強CT(半年至1年)、胃鏡(每年一次)等。
11 附錄1 胃癌的病理學描述
描述記錄
(全胃、胃大部或殘胃)切除標本:大彎長 釐米,小彎長 釐米,附幽門環/十二指腸/食管下段,長 釐米 ; 於(賁門/胃底/胃體/胃竇; 小彎/大彎側)見 型(早期和進展期)腫物(包括外觀描寫) :距上切緣 釐米,距下切緣 釐米,大小---×---×---釐米,切面性狀 ; 浸潤深度至 ; 累及/未累及幽門環/食管下段。腫物旁或腫物周圍食管粘膜/肌壁內檢查所見(糜爛/粗糙/顆粒狀/凹陷/斑塊//必要的陰性所見)。大彎找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米;小彎找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米。大網膜,大小---×---×---釐米,有無腫瘤和淋巴結。
12 附錄2 胃癌病理診斷報告內容
1、腫瘤
需描述以下5項內容:①組織分型;②組織分級;③浸潤深度;④食管或十二指腸浸潤(如果切取)、脈管浸潤;⑤神經周圍浸潤。
2、切緣
需描述近端切緣和遠端切緣。
3、其他病理所見
包括以下8項內容①慢性胃炎;②腸化;③不典型增生;④萎縮;⑤腺瘤;⑥息肉;⑦幽門螺旋桿菌;⑧其他。
5、遠處轉移
有困難的病理提交上級醫院會診(提供原始病理報告以覈對送檢切片的正確,減少誤差;提供充分的病變切片或蠟塊以及術中所見等)。
13 附錄3 病人狀況評分
13.1 1 Karnofsky評分(KPS,百分法)
評分見表1。
表1 Karnofsky評分
100 90 80 70 60 50 40 30 20 10 0 | 正常,無症狀和體徵,無疾病證據 生活可自理,但不能維持正常生活或工作 生活能大部分自理,但偶爾需要別人幫助,不能從事正常工作 生活不能自理,需要特別照顧和治療 生活嚴重不能自理,有住院指徵,尚不到病重 重危,臨近死亡 死亡 |
13.2 2 Zubrod-ECOG-WHO 評分(ZPS,5分法)
評分見表2。
表2 Zubrod-ECOG-WHO
14 附錄4 放射及化學治療療效判定標準
14.1 1 WHO實體瘤療效評價標準(1981)
1.1 完全緩解(CR)腫瘤完全消失超過1個月。
1.2 部分緩解(PR) 腫瘤最大直徑及最大垂直直徑的乘積縮小達50%,其他病變無增大,持續超過1個月。
1.3 病變穩定(SD) 病變兩徑乘積縮小不超過50%,增大不超過25%,持續超過1個月。
1.4 病變進展(PD) 病變兩徑乘積增大超過25%。
14.2 2 RECIST療效評價標準(2000)
2.1 靶病竈的評價
2.1.1 完全緩解(CR) 所有靶病竈消失。
2.1.2 部分緩解(PR)靶病竈最長徑之和與基線狀態比較,至少減少30%。
2.1.3 病變進展(PD) 靶病竈最長徑之和與治療開始之後所記錄到的最小的靶病竈最長徑之和比較,增加20%,或者出現一個或多個新病竈。
2.1.4 病變穩定(SD) 介於部分緩解和疾病進展之間。
2.2 非靶病竈的評價
2.2.1 完全緩解(CR) 所有非靶病竈消失和腫瘤標誌物恢復正常。
2.2.2 未完全緩解/穩定(IR/SD) 存在一個或多個非靶病竈和/或腫瘤標誌物持續高於正常值。
2.2.3病變進展(PD) 出現一個或多個新病竈和/或已有的非靶病竈明確進展。
2.3 最佳總療效的評價
15 參考文獻
1、Ajani JA, Bekaii-Saab T, Yang G, et al. NCCN clinical practice guidelines in oncology:gastric cancer. 2009.
2、Karam SM. Cellular origin of gastric cancer. AnnN Y Aced Sci, 2008, 1138:162-168
3、Hamashima C , Shibuya D , Yamazaki H , et al.The Japaneseguidelines for gastric cancer screening. Jpn 1 Clin Oncol, 2008, 38(4):259-267.
4、Leung WK, Wu MS, Kakugawa Y, et al. Asia PacificWorkingGroup on Gastric Cancer. Screening for gastric cancer in Asia: currentevidence and practice. Lancet Oncol, 2008, 9(3):279-287.
5、朱正綱,嚴超,陳克敏,等。內鏡超聲檢查與多層螺旋CT對胃癌術前分期的對比研究.中華胃腸外科雜誌,2002, 5(2):99-103
6、Jatzko GR, Lisborg PH, Denk H, et al. A 10-year experiencewith Japanese-type radical lymph node dissection for gastric cancer outside ofJapan. Cancer, 1995,76(8):1302-1312.
7、ParkinDM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin, 2005,55: 74-108
8、Sierra A , Regueira FM,Hernlx}ndez-LiwGinJL, et al. Role of the extended lymphadenectomy in gastric cancer surgery: experience in a single institution.Ann Surg Oncol, 2003 , 10( 3 ): 219-226.
9、董志偉,谷銑之. 臨牀腫瘤學. 北京:人民衛生出版社,2002:9-27.
10、Enzinger PC, Benedetti JK, Meyerhardt JA, et al. Impact of hospital volume on recurrence and survivalafter surgery for gastnc cancer.2007,245(3):426-434.
11、MacDonald, JS, Smalley SR, Benedetti J, et al. Chemoradio-therapyafter surgery compared with surgery alone for adeno-carcinoma of the stomach orgastroesophageal junction. N Engl JMed , 2001, 345:725-730.
12、Smalley SR, Gunderson L, Tepper JE,et al. Gastric surgical adjuvant radiotherapy consensusreport-rationale and treatment implementation. Int J [}adiat Oncol Biol Phys,2002,52:283-293.
13、孫燕主編. 抗腫瘤藥物手冊. 人民衛生出版社. 2007:32-35.
14、Greene FL, Page DL, Fleming ID, et al. AJCC Cancer Staging Manual, 6th ed. New York:Springer-Verlag, 2002. Roder RD, Bottcher K, Busch R, et al. Classification o#regional lymph node metastases from gastric carcinoma. Cancer,1998;82:621-631.
15、Brennan MF.lymph node dissection for gastriccancer. N Engl J Med , 1999 , 340:956-958
16、Schwars RE, Lagala-Nevarez K. Recurrencepatterns after radical gastrectomy for gastric cancer. Prognostic factors andimplications for postoperative adjuvant therapy. Ann Surg Oncol, 2002,9:294-400.