2 註解
在一定溫度下可逆反應達到平衡時,生成物濃度指數冪的乘積跟反應物濃度指數冪乘積的比,叫做該反應的化學平衡常數。對一般的可逆反應mA nB?xml:namespace prefix = v ns = "urn:schemas-microsoft-com:vml" /
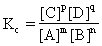
表達式中各物質的濃度必須是平衡狀態下的值,不能用任一時刻的濃度值。所以平衡常數Kc不隨反應物或生成物濃度而變,但隨溫度的改變而改變。有氣體參加的反應,可用氣體分壓的指數冪表示,寫成Kp。有固體物質參加的反應,固體濃度可以不寫,因爲分子間碰撞只能發生在固體表面,固體濃度可視爲常數。稀溶液中的水分子濃度也可以不寫。因爲水的摩爾濃度是1000/18=55.5mol/L(稀溶液的密度近似等於1g/cm3),也是一個常數。化學平衡常數表達式跟反應方程式的書寫形式有關。平衡常數K值的大小,表明反應進行的程度。K值越大,表示平衡時生成物濃度對反應物濃度的比越大,即反應進行得越完全,反應物的轉化率越高。使用催化劑能改變化學反應速率,但不會使平衡移動,因此不會改變平衡常數。