1 拼音
W S / T 8 0 7 — 2 0 2 2 lín chuáng wēi shēng wù péi yǎng 、 jiàn dìng hé yào mǐn jiǎn cè xì tǒng de xìng néng yàn zhèng
2 英文參考
Performance verification of clinical microbial culture, identification and antimicrobial susceptibility testing systems
3 基本信息
ICS 11.020
CCS C 50
中華人民共和國衛生行業標準WS/T 807—2022《臨牀微生物培養、鑑定和藥敏檢測系統的性能驗證》(Performance verification of clinical microbial culture, identification and antimicrobial susceptibility testing systems)由中華人民共和國國家衛生健康委員會2022年11月2日《關於發佈〈臨牀化學檢驗基本技術標準〉等4項推薦性衛生行業標準的通告》(國衛通〔2022〕12號)發佈,自2023年5月1日起施行。
4 發佈通知
關於發佈《臨牀化學檢驗基本技術標準》等4項推薦性衛生行業標準的通告
國衛通〔2022〕12號
現發佈《臨牀化學檢驗基本技術標準》等4項推薦性衛生行業標準,編號和名稱如下:
WS/T 804—2022 臨牀化學檢驗基本技術標準
WS/T 807—2022 臨牀微生物培養、鑑定和藥敏檢測系統的性能驗證
上述標準自2023年5月1日起施行。
特此通告。
國家衛生健康委
2022年11月2日
5 前言
本標準由國家衛生健康標準委員會臨牀檢驗標準專業委員會負責技術審查和技術諮詢,由國家衛生健康委醫療管理服務指導中心負責協調性和格式審查,由國家衛生健康委醫政司負責業務管理、法規司負責統籌管理。
本標準起草單位:北京大學人民醫院、北京醫院/國家衛生健康委臨牀檢驗中心、上海市東方醫院、中國人民解放軍總醫院、河北省臨牀檢驗中心、空軍軍醫大學第一附屬醫院、首都醫科大學附屬北京友誼醫院、中日友好醫院、中國醫學科學院北京協和醫院。
本標準主要起草人:王輝、胡繼紅、吳文娟、沈定霞、趙建宏、劉家雲、胡云建、蘇建榮、魯炳懷、孫宏莉。
6 標準正文
6.1 1 範圍
本標準規定了臨牀微生物形態學檢查、培養、鑑定、藥敏、分子即時檢測等系統性能驗證的要求。
6.2 2 規範性引用文件
下列文件中的內容通過文中的規範性引用而構成本標準必不可少的條款。其中,注日期的引用文件,僅該日期對應的版本適用於本標準;不注日期的引用文件,其最新版本(包括所有的修改單)適用於本標準。
GB 19489 實驗室生物安全通用要求
WS/T 442 臨牀實驗室生物安全指南
6.3 3 術語和定義
下列術語和定義適用於本標準。
6.3.1 3.1
參考方法 reference method
一種無系統誤差,隨機誤差可控,且準確清晰地描述了測定一個或多個性能參數的檢測方法,可用於評估其他檢測方法的性能。
6.3.2 3.2
用於評估新系統的方法,包括參考方法或已獲得藥監局批准的商品化方法。
6.3.3 3.3
接種物濃度 inoculum
接種於微生物檢測系統的菌懸液中微生物的濃度,以每毫升菌落形成單位(colony-forming units per milliliter,CFU/mL)表示。
6.3.4 3.4
標準菌株 reference strain
由菌種保藏機構保藏,遺傳學特性得到確認和保證並可追溯的菌株。
6.3.5 3.5
通過提供客觀證據,確認微生物檢測系統在用於患者標本及標本分離株檢測之前能達到與製造商介紹一致的性能。
6.3.6 3.6
利用實驗室室間比對,按照預先制定的準則評價參加者的能力(ISO/IEC 17043, 3.7)。
注:能力驗證活動包括獲認可的能力驗證提供者的能力驗證計劃,以及衛生系統權威機構提供的比對(實驗室間質
量評價)。
6.3.7 3.7
準確度 accuracy
測量值和真實值之間的一致性接近程度。本標準用以描述準確鑑定同一待測菌的能力或準確確定同一待測微生物/抗微生物藥物組合敏感性結果的能力。
6.3.8 3.8
精密度 precision
在規定條件下,對同一或相似被測對象重複測量得到的測量示值或測得量值的一致程度。
6.3.8.1 3.8.1
可重複性 repeatability
在一組測量條件下,包括相同檢測程序、相同操作者、相同測量系統、相同操作條件和相同地點,短時間內對同一或相似被測對象重複測量的精密度。
6.3.8.2 3.8.2
再現性 reproducibility
在包括了不同的地點、不同的操作者、不同的測量系統的測量條件下對同一或相似被測對象重複測量的精密度。
6.3.9 3.9
符合率 agreement rate
採用不同方法對同一待測物定性檢測結果的一致程度,也稱一致率。
6.3.10 3.10
定量限 limit of quantitative;LOQ
在規定的實驗條件下,樣品中待測組分能以規定的準確度(作爲總誤差或作爲偏差和精密度的特定要求)被定量測定的最低量值。
6.3.11 3.11
檢出限 limit of detection;LOD
指某一分析方法在給定的可靠程度內可以從樣品中檢測待測物質的最小濃度或最小量。
6.3.12 3.12
最低抑菌濃度 minimal inhibitory concentration;MIC
在瓊脂或肉湯稀釋法藥物敏感性檢測試驗中,能抑制肉眼可見的微生物生長的最低藥物濃度。
6.3.13 3.13
分類一致性 category agreement;CA
被評估的藥敏方法與參考方法或比對方法相比,判斷結果爲敏感、中介、劑量依賴性敏感和耐藥的一致性。
6.3.14 3.14
基本一致性 essential agreement;EA
待測系統MIC值與參考方法或比對方法MIC值相差不超過1個對倍稀釋度(細菌)或2個對倍稀釋度(酵母菌)。待評估方法爲紙片擴散法時,不計算EA。
6.3.15 3.15
極重大偏差 very major discrepancy;VMD
待評估的藥敏系統檢測爲敏感,而現有商品化檢測系統檢測爲耐藥,即假敏感。
6.3.16 3.16
極重大誤差 very major error;VME
待評估的藥敏系統檢測爲敏感,而參考方法檢測爲耐藥,即假敏感。
6.3.17 3.17
重大偏差 major discrepancy;MD
待評估的藥敏系統檢測結果爲耐藥,而現有商品化檢測系統檢測爲敏感,即假耐藥。
6.3.18 3.18
重大誤差 major error;ME
待評估的藥敏系統檢測結果爲耐藥,而參考方法檢測爲敏感,即假耐藥。
6.3.19 3.19
小偏差 minor discrepancy;MD
待評估的藥敏系統將現有商品化檢測系統的中介判爲敏感或耐藥、或者將耐藥或敏感判爲中介。
6.3.20 3.20
小誤差 minor error;ME
待評估的藥敏系統將參考方法的中介判爲敏感或耐藥、或者將耐藥或敏感判爲中介。
6.3.21 3.21
專家系統 expert system
3.22
即時檢測 point-of-care testing;POCT
亦稱近患檢驗(Near-patient testing),在患者附近或其所在地進行的、其結果可能導致患者的處置發生改變的檢驗。
6.3.22 3.23
臨界值 cut-off value
作爲判斷特定疾病、狀態或被測量存在或不存在的界限的數值或量值。
6.3.23 3.24
正確度 trueness
多次重複檢測所得量值的平均值與一個參考量值間的一致程度。通常用“偏倚”表達,是對系統誤差的衡量。
6.4 4 風險評估
6.4.1 4.1 風險評估是評估危害發生的概率和危害嚴重程度。風險評估應考慮到錯誤結果、結果延遲、結果缺失或治療延誤的風險。
6.4.2 4.2 錯誤檢測結果帶來的風險
新檢測系統未執行全面驗證方案或現有系統部分改變時未執行部分驗證方案,可能造成鑑定錯誤、藥敏檢測錯誤等,從而給患者帶來一定風險,詳見表1。錯誤結果帶來的風險因致病菌種類或菌種/藥物組合而異,如漏檢苯唑西林耐藥的金黃色葡萄球菌(假敏感)所帶來的風險較將大腸埃希菌氨苄西林報告爲假耐藥更爲嚴重。當錯誤結果帶來的風險較高時,實驗室應增加附加檢測試驗。


6.4.3 4.3 驗證樣品量、樣品類型帶來的風險
a) 分離培養系統標本多樣性不足,不能準確判斷相應標本各類目標菌種的分離概率。
b) 培養、鑑定系統入選菌種或標本多樣性不足,不能鑑定同一屬細菌親緣關係近的菌種;對於少見菌、不常見菌可能造成漏檢或錯誤鑑定。
c) 驗證藥敏檢測系統時,不覆蓋耐藥或中介的菌株或折點附近的菌株,可能產生較高的 VME、ME。
d) 選用的菌株均是低 MIC 或高 MIC 值的菌株,易造成系統驗證結果偏差。
6.5 5 性能驗證相關通用要求
6.5.1 5.1 性能驗證應在以下情況下執行,具體不同的檢驗項目見本標準各章條內容。
b) 任何嚴重影響檢驗程序分析性能的情況發生後,應在檢驗程序重新啓用前對受影響的性能進行驗證。
6.5.2 5.2 驗證後的質量保證
常規使用期間,爲能滿足檢驗結果的預期用途,可基於檢驗程序的穩定性,利用日常工作產生的檢驗和質控數據,定期對檢驗程序的分析性能進行評估。包括但不限於如下:
a) 持續的質量控制(quality control,QC)。
b) 能力驗證(PT)/室間質評不適用時,採用替代方法,應至少每半年評估一次準確度。
c) 人員的培訓和能力測試:定期評估人員的檢測能力,如培訓新出現的耐藥表型、分類學變化和折點的更新等。
d) 儀器和軟件維護:檢測到儀器和軟件的問題應採取相應措施,並跟蹤評價糾正措施。
f) 異常結果的再審覈:如藥敏專家系統鑑定的異常結果應進行其他確認試驗。確認後的異常結果(如新的耐藥表型)應及時上報負責人。
6.6 6 細菌、真菌形態學檢查的性能驗證
6.6.1 6.1 染色方法的性能驗證
6.6.1.1 6.1.1 驗證時機
6.6.1.2 6.1.2 驗證菌株
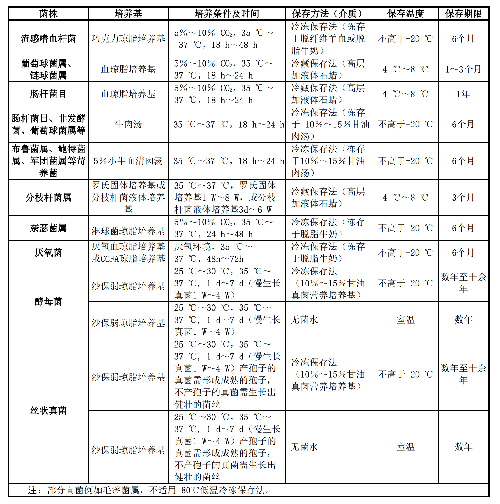
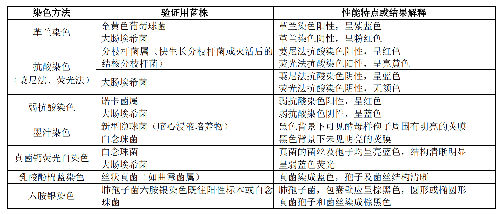
實驗室常用的細菌、真菌形態學顯微鏡檢查項目有:革蘭染色、抗酸染色(萋尼法、熒光法)、弱抗酸染色、墨汁染色、真菌鈣熒光白染色、乳酸酚棉藍染色和六胺銀染色等。標準菌株、QC菌株或經過明確鑑定(如質譜或DNA序列分析確定)的臨牀菌株均可用於染色方法的性能驗證。常用染色方法性能驗證所使用的菌種及性能特點見表2。
每項染色應至少選擇5株菌,包括不同染色性能和形態特徵的菌株。
6.6.1.3 6.1.3 驗證前準備工作
菌株要求:驗證用細菌、真菌或分枝桿菌等應在相應培養基上覆蘇、傳代後,使用新鮮(對數生長期)的純菌落。
人員要求:所有從事塗片染色鏡檢的工作人員均需接受各種染色方法標準操作的培訓,且需進行辨色力檢查。
6.6.1.4 6.1.4 驗證方案
6.6.1.4.1 6.1.4.1 驗證過程
由本崗位人員進行菌株傳代、菌落塗片、染色和鏡檢,填寫性能驗證記錄表,明確記錄各種染色方法的實際性能特點。
6.6.1.4.2 6.1.4.2 可接受標準
6.6.2 6.2 顯微鏡檢查的性能驗證
6.6.2.1 6.2.1 驗證時機
檢驗程序常規應用之前。任何嚴重影響檢驗程序分析性能的情況發生後,應在檢驗程序重新啓用前對受影響的性能進行驗證。現用檢驗程序的任一要素(儀器、染液等)變更,應重新進行驗證。
6.6.2.2 6.2.2 驗證標本
6.6.2.2.1 6.2.2.1 驗證標本的類型
所有標本及容器應當作具有傳染性的物質,應按照實驗室生物安全要求操作(參見 GB 19489 和WS/T 442)。優先使用已知結果的留樣標本,不可獲取時可採用模擬標本。各種檢查項目的標本類型:
a) 革蘭染色適用於除血液、導管、糞便、喉部標本外的各種標本。
c) 弱抗酸染色主要適用於呼吸道、中樞神經系統、膿液等標本。
6.6.2.2.2 6.2.2.2 驗證標本的數量
每項檢查至少選擇5份標本進行驗證,各染色項目對標本選擇的要求如下:
a) 革蘭染色:應覆蓋革蘭陽性菌、革蘭陰性菌、未查見細菌等結果的標本。
b) 抗酸染色、弱抗酸染色、墨汁染色:應覆蓋各種染色陽性、陰性結果的標本。
c) 真菌鈣熒光白染色:應覆蓋真菌孢子、真菌絲、假菌絲、未查見真菌等結果的標本。
6.6.2.3 6.2.3 驗證前準備工作
設備要求:細菌、真菌形態學檢查涉及的設備如普通離心機、細胞離心機、自動染片機、顯微鏡等均需進行日常維護保養及例行校準,確保設備的性能穩定。
人員要求見本標準第6.1.3條。
6.6.2.4 6.2.4 驗證方案
6.6.2.4.1 6.2.4.1 驗證過程
由本崗位人員進行塗片、染色、鏡檢及結果報告,由專人進行結果統計,評價檢測結果與留樣(模擬)樣品之間的符合率。
6.6.2.4.2 6.2.4.2 樣品的製備要求
所有樣品的製備均需在生物安全櫃內進行。適合直接塗片的臨牀標本應挑選膿性或帶血部分,塗成均勻薄片。尿液、胸腹水等體液標本離心後取沉澱物塗片。肺泡灌洗液、無色透明的腦脊液等用細胞離心機離心製片。
6.6.2.4.3 6.2.4.3 結果報告
6.2.4.3.1 鏡檢觀察視野的要求
痰塗片質量評估需低倍鏡下觀察最少20~40個視野。萋尼法抗酸染色若陰性需觀察油鏡下300個視野,報告1+時至少觀察300個視野,報告2+至少觀察100個視野,3+、4+時至少觀察50個視野。熒光法抗酸染色若陰性需觀察50個視野,報告2+至少觀察50個視野,3+及以上的陽性結果至少觀察20個視野。
6.2.4.3.2 數量的報告
數量的報告如下:
a) 革蘭染色細菌半定量報告:0~1 個/油鏡,1+;2~5 個/油鏡,2+;6~30 個/油鏡,3+;>30個/油鏡,4+。痰塗片標本應計算有細胞視野的細胞平均數量,分別記錄低倍鏡下鱗狀上皮細胞、多形核白細胞的數量,評估痰標本質量是否合格(若多形核白細胞數量>25 個/LPF,鱗狀上皮細胞數量<10 個/LPF,即痰標本質量合格)。
b) 萋尼法抗酸染色觀察 300 個視野(油鏡)若未發現抗酸桿菌,報告抗酸桿菌陰性;1~8 條抗酸桿菌/300 視野,報告抗酸桿菌數量(若 1~2 條抗酸桿菌/300 視野,不確定,需重複試驗);1~9 條/100 視野,報告抗酸桿菌 1+;1~9 條/10 視野,報告抗酸桿菌 2+;1~9 條/每視野,報告抗酸桿菌 3+;>9 條/每視野,報告抗酸桿菌 4+。
c) 熒光法抗酸染色觀察 50 個視野(高倍)若未發現抗酸桿菌,報告熒光染色抗酸桿菌陰性;1~9 條/50 視野,報告熒光染色抗酸桿菌數量;10~49 條/50 視野,報告熒光染色抗酸桿菌 1+;1~9 條/1 視野,報告熒光染色抗酸桿菌 2+;10~99 條/1 視野,報告熒光染色抗酸桿菌 3+;100 條及以上/1 視野,報告熒光染色抗酸桿菌 4+。
6.2.4.3.3 形態學描述
形態學的描述如下:
a) 革蘭染色:報告每種菌體的染色特徵(陽性、陰性)、形態(桿菌、球菌)、排列(成對、四聯、短鏈或長鏈等)。
c) 六胺銀染色:描述肺孢子菌包囊特徵(橢圓形或半月形包囊,特徵性圓括號樣結構的囊壁)。
d) 其他真菌相關染色:描述真菌孢子、菌絲形態以及某些絲狀真菌的產孢結構等。
6.6.2.4.4 6.2.4.4 可接受標準
半定量染色的結果偏差≤±1判斷爲結果一致。革蘭染色、抗酸染色項目符合率應爲100%;其他少見染色項目符合率≥80%即合格。
6.6.3 6.3 自動化染片機的性能驗證
6.6.3.1 6.3.1 驗證時機
自動化染片機在投入使用前應通過性能驗證。儀器搬遷、儀器故障維修後、儀器更新升級、更換新品牌的染液,應重新進行驗證。
6.6.3.2 6.3.2 驗證標本或菌株
自動化染片機的性能驗證宜選擇臨牀標本或菌株(標準菌株、QC菌株或經過明確鑑定的臨牀菌株)進行性能驗證。應滿足:
a) 革蘭染色適用於除血液、導管、糞便、喉部標本外的各種標本,至少 5 份;菌株應覆蓋革蘭陽性菌、革蘭陰性菌,至少 5 株。
b) 萋尼法抗酸染色適用於除血液和導管外的各種標本,至少 5 份;菌株應覆蓋抗酸陽性菌、抗酸陰性菌,至少 5 株。
6.6.3.3 6.3.3 驗證前準備工作
檢查儀器狀態,包括噴嘴、沖洗管路、容量、廢液排空等是否符合要求。
6.6.3.4 6.3.4 驗證方案
6.6.3.4.1 6.3.4.1 驗證過程
留樣標本同時製備兩份;菌株選擇生長對數期的純菌落配製0.5麥氏單位菌懸液塗片兩份,並分別進行手工染色和自動化染片。
6.6.3.4.2 6.3.4.2 鏡檢與結果記錄
分別記錄各種菌株、各種標本分別在手工染色和自動化染片兩種方法中的實際染色性狀。
6.6.3.4.3 6.3.4.3 可接受標準
6.7 7 細菌、真菌分離培養的性能驗證
6.7.1 7.1 培養基的性能驗證
6.7.1.1 7.1.1 細菌、真菌分離培養常用培養基的性能驗證
6.7.1.1.1 7.1.1.1 驗證時機
培養基的性能驗證應在首次啓用新種類培養基前和更換廠家或品牌後。
6.7.1.1.2 7.1.1.2 驗證用標準菌株和培養基
7.1.1.2.1 常用培養基性能驗證所使用的標準菌株、性能特點及作用
將不同種屬的細菌或真菌接種在相應培養基上,觀察細菌或真菌的生長情況及性能特點,進行培養基的性能驗證。若不能獲得相應標準菌株時,可採用經過準確鑑定並且性能特點符合表3要求的質控菌株或臨牀分離菌株進行性能驗證。常見標準菌株/質控菌株的培養與保存見附錄A.1。
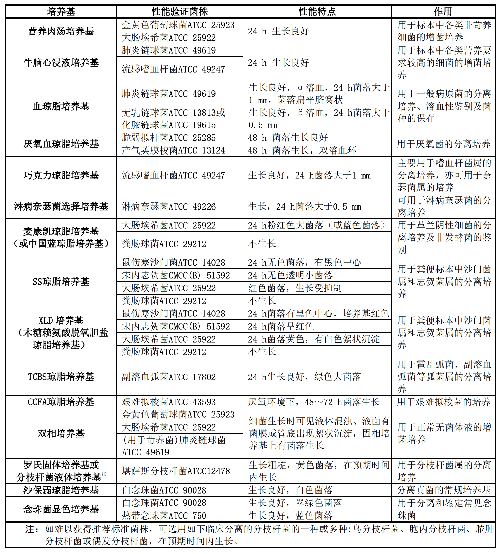
對於新啓用的培養基,每種類型使用2個培養基進行性能驗證。如爲選擇性培養基,應覆蓋不同生長特性的菌株。
6.7.1.1.3 7.1.1.3 驗證方案
7.1.1.3.1 驗證過程
根據培養基種類選擇合適的驗證菌株,復甦、傳代以獲得新鮮的純菌落。挑取純菌落,按實驗室操作程序規定的方法進行接種和培養,在相應的培養條件、培養時間內進行結果觀察和記錄。
7.1.1.3.2 可接受標準
標準/質控菌株在相應培養基上生長,若符合性能特點,驗證通過,可用於臨牀標本檢測。如果直接接種法時,驗證未通過,則改用標準化菌懸液進行再驗證,以滿足性能特點的要求。未進行性能驗證或性能驗證未通過的培養基不能用於臨牀檢測。
6.7.2 7.2 自動化接種儀的性能驗證
6.7.2.1 7.2.1 驗證時機
自動化接種儀在正式投入使用前應進行性能驗證。儀器主要部件故障、升級等情況時也應進行性能驗證。
6.7.2.2 7.2.2 驗證標本
實驗室應至少對其所用自動化接種儀接種的標本類型進行性能驗證。對於痰、糞便等質地較爲粘稠的標本,在採用自動化接種儀接種之前,應做好標本的前處理。對於腦脊液等量少的標本、體積較小的活檢組織以及導管等標本不宜使用自動化接種儀進行接種。
標本數量:模擬標本10個,臨牀標本(包括尿、痰、胸腹水等)10個。
6.7.2.3 7.2.3 驗證方案
6.7.2.3.1 7.2.3.1 驗證過程
首次對自動化接種儀進行性能驗證應以手工接種法爲參照,比較其對標本分離的有效性。即對同一標本,分別採用兩種方法(儀器法和手工法)進行接種,對最終分離出的菌種數、每種菌的單個菌落數量、定量或半定量結果分別進行統計學比較。
對於尿液,可使用生理鹽水,將大腸埃希菌ATCC 25922配製成不同濃度(103CFU/mL、104CFU/mL、105CFU/mL和106CFU/mL)的菌懸液,製作成模擬標本,分別使用密塗法進行接種,並與儀器法的定量結果進行比對。
6.7.2.3.2 7.2.3.2 結果判讀
在接種相同濃度菌懸液的情況下,進行菌落計數,比較儀器法和手工法的差異。
半定量結果判讀標準如下:只在一區有菌落生長爲+;只在一區和二區有菌落生長爲++;同時在一區、二區和三區有菌落生長,且三區的菌落數<5個爲+++;同時在一區、二區和三區有菌落生長,且三區的菌落數>5個爲++++。
確定半定量結果之後,比較儀器法和手工法的差異。
6.7.2.3.3 7.2.3.3 可接受的標準
對於尿液和肺泡灌洗液等定量標本,若儀器法的菌落計數結果與手工法在同一數量級,則視爲性能驗證通過;對於其他半定量培養標本,若儀器法的半定量結果與手工法相差一個+,則視爲性能驗證通過。
6.7.3 7.3 全自動血培養系統的性能驗證
6.7.3.1 7.3.1 驗證時機
全自動血培養系統的性能驗證應在新系統投入使用前、系統主要部件故障、系統整體更新或升級後進行,評估與全自動血培養系統配套使用的血培養瓶以及相應的自動化監測設備是否能在規定時間內檢出臨牀常見微生物(包括需氧菌、厭氧菌、苛養菌、酵母菌等)。
6.7.3.2 7.3.2 驗證菌株
標準菌株、QC菌株及經過明確鑑定的臨牀菌株均可用於對全自動血培養系統的性能驗證。
驗證每類血培養瓶的菌株數均應至少5株。需氧瓶和兒童瓶均應覆蓋專性需氧菌、兼性厭氧菌、苛養菌和酵母菌4個種類;厭氧瓶應覆蓋專性厭氧菌和兼性厭氧菌2個種類;真菌瓶應覆蓋酵母菌和兼性厭氧菌,分枝桿菌瓶應覆蓋分枝桿菌屬細菌(表4)。具體菌株可以不限於表4中所列菌種。

6.7.3.3 7.3.3 驗證方案
6.7.3.3.1 7.3.3.1 細菌和酵母菌的稀釋和接種
將菌株分別接種至對應的培養基,傳代、分純後並進行系列稀釋:首先製成濁度爲0.5麥氏單位的菌懸液(細菌濃度爲108CFU/mL,酵母菌濃度爲106CFU/mL),經適當比例稀釋後,獲得菌懸液濃度爲102CFU/mL,接種適量菌液於血培養瓶中,最終血培養瓶中的菌量爲5~30 CFU/瓶。分枝桿菌的培養、稀釋應在符合生物安全的條件下進行(參見GB 19489和WS/T 442)。
6.7.3.3.2 7.3.3.2 血培養瓶中菌株實際接種量的確定
取上述經過稀釋、濃度爲102CFU/mL的適量菌液分別接種到合適的平板上,均勻塗布在培養基表面,接種後的平板置於合適的條件下培養,如將嗜血桿菌接種並塗布到巧克力瓊脂培養基上,在CO2孵箱中培養 24 h~48 h後進行菌落計數。計數得到的菌落數即是實際接種至血培養瓶中的菌量。
6.7.3.3.3 7.3.3.3 檢測與結果記錄
將定量接種菌液的血培養瓶,置於全自動血培養系統內培養。當陽性瓶報警後,轉種合適培養基。培養後的純菌落形態應與接種至血培養瓶前的形態一致,且經鑑定確認菌種的一致性。記錄不同菌株實際接種至血培養瓶中的菌量(CFU/瓶)和儀器檢測到菌株生長時所需的時間(h)。
6.7.3.3.4 7.3.3.4 可接受標準
當全自動血培養系統能夠在廠家規定的時間內,80%(5株菌中至少4株菌)以上可準確檢出即通過驗證。如果驗證的5株菌中有≥2株不能在規定時間內檢測出來,則視爲驗證不通過,需要尋找原因,重新進行性能驗證。未通過性能驗證的設備,不得用於臨牀檢測。
6.7.3.3.5 7.3.3.5 需要注意的事項
如下:
a) 採用苛養菌做性能驗證時,血培養瓶內宜添加適量新鮮、無菌的正常人血或動物血。
b) 針對厭氧菌進行性能驗證時,儘可能減少厭氧菌暴露於空氣的時間。
c) 對含有抗微生物藥物吸附劑的血培養瓶進行藥物吸附的性能驗證時,應遵從廠家的建議。
d) 如果廠商介紹提供了其血培養系統的檢出限,實驗室宜進行檢出限的驗證。
6.8 8 細菌、真菌手工和自動化鑑定系統的性能驗證
6.8.1 8.1 手工、半自動和自動化鑑定系統
6.8.1.1 8.1.1 驗證時機
實驗室使用中的檢測系統,對樣品類型、試劑、數據庫、分析軟件和硬件等進行升級後,在原有檢測病原譜基礎上增加新的病原體擴大檢測範圍後,應進行部分驗證(表5)。
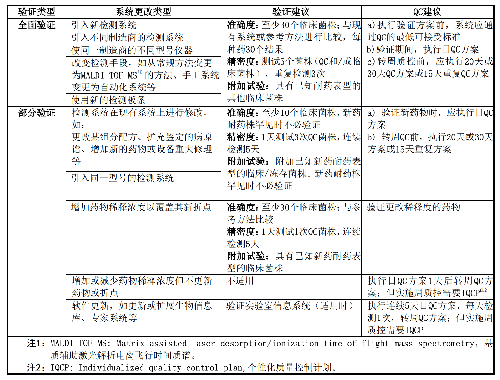
6.8.1.2 8.1.2 驗證菌株
結合廠家介紹和本地區/實驗室微生物流行病學數據,選擇標準菌株、QC菌株、經質譜或分子等確認DNA序列的臨牀常見菌(覆蓋80%以上種類),每種鑑定板至少測試30株分離株,以涵蓋最常分離的微生物。適用時,可增加對少見菌、厭氧菌、苛養菌等的驗證。一些大型醫院,其患者複雜、分離的微生物種類多,這些醫院宜納入更多的菌株。對於特定地區和機構, 考慮到特殊標本不易獲取以及患者等因素,可適當調整驗證菌株。
注1:製造商在設備數據庫中列出了可鑑定的微生物清單,這些微生物可作爲驗證的目標菌。
注2:目標微生物範圍較窄的檢測板(如厭氧菌鑑定卡),可選3~5株菌。
6.8.1.3 8.1.3 驗證方案
6.8.1.3.1 8.1.3.1 精密度(再現性)驗證
8.1.3.1.1 對於微生物鑑定系統的精密度測試,應比較患者分離株的鑑定結果,而不是單獨的某一生化反應
全面驗證:至少應在三個工作日,重複對五個菌株(QC和/或臨牀菌株)進行測試。例如,可以選擇和測試3個QC菌株和2個臨牀菌株。由一名或多名操作員進行日間測試。
8.1.3.1.2 可接受標準
全面驗證:在3個工作日測試5個菌株(QC和/或臨牀菌株),至少14個鑑定結果一致,驗證通過。
6.8.1.3.2 8.1.3.2 準確度驗證
鑑定結果與實驗室現用方法或參考方法如DNA序列分析比較準確度。如新系統的數據庫包括現有系統中未包括的微生物種類,可考慮使用其他方法對這些微生物進行附加測試。
全面驗證:至少30個臨牀菌株;與現有系統或參考方法進行比較。
部分驗證:至少10個臨牀菌株。
8.1.3.2.2 可接受標準
評價鑑定結果符合率時只比對鑑定結果,無需對得分(如鑑定百分率)進行評估。準確度是以正確的或可接受鑑定的菌株數/測試的分離物總數來計算。如果新系統等於或優於現有系統,則認爲該測試通過驗證。驗證的標準/QC菌株準確度應爲100%,臨牀菌株的準確度應在90%以上。
驗證未通過時需要採取糾正措施。在採取糾正措施(包括與製造商進行討論)後,應再次進行驗證。
微生物鑑定系統的性能驗證指標、要求、方法和可接受標準見附錄B.1。
6.8.2 8.2 MALDI-TOF MS 質譜鑑定
6.8.2.1 8.2.1 驗證時機
實驗室引入新系統時,使用前應進行全面驗證。實驗室使用 MALDI-TOF MS 後,若對試劑、數據庫、分析軟件和硬件等進行更換或升級以及擴大檢測範圍,應進行部分驗證。在設備狀態、環境、檢測方法、人員等維持穩定的情況下,可採用文件和數據審覈等定期評審分析系統狀態,無需每年實施性能驗證。
性能驗證包括準確度和精密度。通過 MALDI-TOF MS 和現用方法或參考方法(如測序方法)獲得的病原體鑑定結果進行比較以實現準確度驗證。精密度驗證應包括所有可能存在的主要變量,如不同的培養基、培養條件和提取技術,通常用標準菌株或QC菌株進行精密度驗證;應評估批內、批間,操作者之間以及連續幾天的重複性或再現性。
6.8.2.2 8.2.2 驗證菌株
選擇的菌種應在 MALDI-TOF MS 製造商公佈的可鑑定菌譜範圍內,包括革蘭陽性及陰性球菌、革蘭陽性及陰性桿菌、苛養菌、厭氧菌、分枝桿菌屬和真菌等。宜覆蓋本地區、本實驗室以往檢出的特殊病原菌,不同地區或專科醫院可適當調整。
6.8.2.3 8.2.3 驗證方案
6.8.2.3.1 8.2.3.1 準確度驗證
8.2.3.1.1 驗證過程
全面驗證:常見病原菌如革蘭陽性及陰性球菌、革蘭陽性及陰性桿菌、酵母菌,每類別至少驗證30株,厭氧菌、苛養菌、分枝桿菌屬(如開展)、絲狀真菌(如開展)每種至少10株。比較 MALDI-TOF MS鑑定結果與實驗室現用方法或參考方法(如測序方法)之間的符合率。
8.2.3.1.2 可接受標準
驗證的標準/QC菌株符合率應爲100%,臨牀菌株的符合率應在90%以上。對質譜技術難以準確鑑定的特定菌種如某些快生長分枝桿菌、鏈球菌屬某些種、志賀菌屬等,應在檢驗程序適用範圍中明確告知。
若未能滿足上述驗證要求,應採取相應措施。修正後的檢測系統應再次進行驗證。對錯誤結果的原因分析見附錄B.2。
6.8.2.3.2 8.2.3.2 精密度(再現性)驗證
8.2.3.2.1 驗證過程
全面驗證:選擇10個菌株(QC和/或臨牀菌株),每天重複檢測3次,連續3天。
部分驗證:1日內重複檢測QC菌株(至少革蘭陽性菌和革蘭陰性菌各一株),3次。
8.2.3.2.2 可接受標準
嚴格按照製造商使用說明的要求進行結果判讀,符合率以最終儀器報告的鑑定結果來評估。菌株鑑定結果符合率應爲100%。
6.8.3 8.3 血清學鑑定
6.8.3.1 8.3.1 驗證時機
驗證時機見本標準第5.1條通用要求。
6.8.3.2 8.3.2 驗證菌株
血清學鑑定試驗包括沙門菌屬、志賀菌屬等的血清學分型。沙門菌屬至少包括傷寒沙門菌、甲型副傷寒沙門菌、乙型副傷寒沙門菌、丙型副傷寒沙門菌;志賀菌屬包括福氏志賀菌、宋內志賀菌、痢疾志賀菌和鮑氏志賀菌四種;致病大腸桿菌/弧菌等根據當地衛生行政管理和實驗室情況進行選擇。
優先選擇標準菌株和QC菌株,也可使用實驗室確認過的留樣臨牀菌株。本地區常見血清型菌株每種至少1株。
6.8.3.3 8.3.3 驗證方案
嚴格參照實驗室操作規程和生物安全要求進行操作(參見GB 19489和WS/T 442)。每次實驗以生理鹽水作爲菌株自凝集對照。
6.8.3.4 8.3.4 可接受標準
要求準確度100%。
6.9 9 商品化藥敏檢測系統的性能驗證
6.9.1 9.1 驗證時機
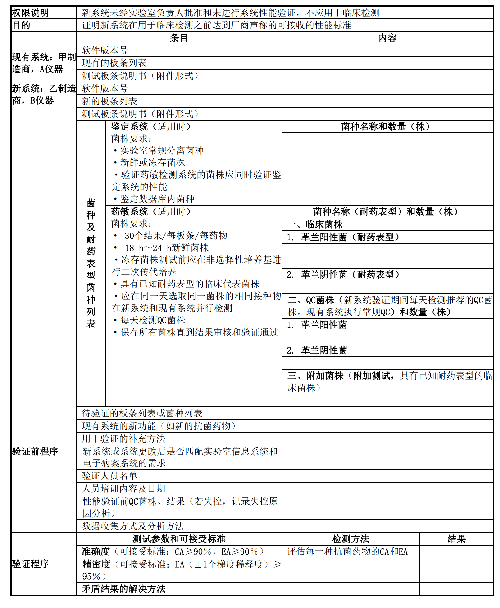
實驗室引入經藥監部門批准的、未經修改的商品化檢測系統時,使用前應進行全面驗證。比較新系統與現有系統的全面驗證方案示例見附錄C表C.1。
實驗室使用中的檢測系統,對試劑、數據庫、分析軟件和硬件等進行升級後,增加藥物稀釋濃度以覆蓋藥物新折點時,應進行部分驗證,詳見表5。
6.9.2 9.2 驗證菌株
6.9.2.1 9.2.1 菌株的種類
性能驗證用菌株應適用於待驗證系統且兼顧藥敏板的類型、每種藥物的抗菌譜、檢測的範圍。產品介紹中未列出的菌種不列入驗證範圍。所選敏感和耐藥菌株的數量宜均衡;優先使用非凍存的、新鮮的臨牀菌株;菌株數不夠時,也可使用凍存菌株、室間質評或其他來源的菌株。檢測前,凍存菌株傳代2次,且傳代後 24 h內使用。
臨牀菌株包括但不限於以下菌株:
a) 革蘭陽性菌:不同藥敏譜型的 MRSA、MSSA、凝固酶陰性的葡萄球菌、糞腸球菌和屎腸球菌各 2株。
b) 革蘭陰性菌:①含 ESBL 在內的不同藥敏表型譜的大腸埃希菌 5~10 株;②含 ESBL 在內的不同藥敏表型譜的肺炎克雷伯菌 3~5 株;③不同藥敏表型譜的陰溝腸桿菌、產酸克雷伯菌、弗勞地枸櫞酸桿菌、黏質沙雷菌、摩根摩根菌和普羅威登菌屬各 1 株;④不同藥敏表型譜的銅綠假單胞菌 4 株;⑤奇異變形桿菌 1 株。
注:MRSA,methicillin-resistant Staphylococcus aureus,苯唑西林耐藥的金黃色葡萄球菌;MSSA,methicillinsusceptible Staphylococcus aureus,苯唑西林敏感的金黃色葡萄球菌;ESBL,extended-spectrum βlactamase,超廣譜β內酰胺酶。
QC 菌株包括但不限於以下菌株:金黃色葡萄球菌 ATCC 29213、糞腸球菌 ATCC 29212、糞腸球菌 ATCC 51299、金黃色葡萄球菌 ATCC 43300、金黃色葡萄球菌 ATCC BAA-977、大腸埃希菌 ATCC 25922、大腸埃希菌 ATCC 35218、銅綠假單胞菌 ATCC 27853 和肺炎克雷伯菌 ATCC 700603。
6.9.2.2 9.2.2 菌株的數量
每種藥敏板至少測試30株菌。應儘可能選擇臨牀菌株,包括特殊或少見耐藥表型菌株,所選QC菌株的數量不應超過菌株數量的50%。
6.9.3 9.3 驗證方案
6.9.3.1 9.3.1 比對方法的選擇
包括參考方法(如微量肉湯稀釋法)和其他已驗證過的商品化方法。若實驗室目前無藥敏檢測系統,可在新系統上使用已知藥敏結果的凍存菌株進行驗證;或與通過權威機構認可的實驗室聯繫,將檢測結果與該實驗室驗證過的藥敏系統進行比對。
6.9.3.2 9.3.2 準確度、精密度(再現性)驗證過程和可接受標準
準確度(CA和EA)和精密度(再現性)驗證過程和可接受標準詳見表5和附錄B表B.1。
6.9.3.3 9.3.3 藥敏試驗的數據分析和矛盾結果的解決
分析藥敏檢測系統的結果至少包括CA。如果檢測的倍比稀釋度有限(如2~3個),不需評估EA;如果倍比稀釋度大於4個,且報告的MIC值可用於指導治療時,評估EA。分類錯誤或MIC值差異超過一個倍比稀釋度時,保存菌株並補充可能的附加試驗。
實驗室應重新檢測具有主要分類偏差或分類錯誤的菌株。最好使用相同的接種物同時在兩個系統上檢測,並重復三次。如重複試驗結果仍不一致,使用第三種方法,優選參考方法。
6.10 10 分子 POCT 系統和部分感染免疫學試驗的性能驗證
6.10.1 10.1 分子 POCT 系統的性能驗證
6.10.1.1 10.1.1 驗證時機見本標準第 5.1 條通用要求
6.10.1.2 10.1.2 驗證標本要求
性能驗證樣品的選擇:①可溯源性。可選擇標準菌株、獲得認證的商品化質控品/標準品,或者經過臨牀檢測陽性的標本。在準備驗證標本時,若無法獲得足量陽性樣品,可採用人工製備樣品。若弱陽性標本不好獲取,可適當稀釋陽性標本。②適用性。要求有代表性的病原體或基因型,對於多重病原體或基因型的核酸檢測,應儘量覆蓋常見類別。此外,宜選擇與臨牀檢測標本具有相同基質的弱陽性樣品。③均質性。要求所選樣品濃度與預期相符,樣品濃度均一。
6.10.1.3 10.1.3 驗證前準備工作
6.10.1.4 10.1.4 驗證方案
6.10.1.4.1 10.1.4.1 定性檢測的驗證內容包括:符合率驗證、LOD 驗證和交叉反應。
10.1.4.1.1 符合率驗證10.1.4.1.1.1 驗證方案
收集臨牀標本,應包括陰性(2例)和陽性(3例,其中至少1例爲弱陽性)。收集後的標本在一週內檢測,結果與已知檢測結果進行比對。對於多重病原體或基因型核酸檢測,應儘量對常見類別分別進行符合率驗證。
10.1.4.1.1.2 可接受標準
檢測的陰性和陽性結果與已知檢測結果全部一致,即符合率符合要求。
10.1.4.1.2 LOD 驗證10.1.4.1.2.1 驗證方案
將一份已知定值的標準品或已用其他方法準確標定濃度的臨牀標本,稀釋到介紹申明的LOD,重複測量20次,也可採用重複檢測5次。
10.1.4.1.2.2 可接受標準
重複檢測5次時,要求100%檢出。重複檢測20次,要求≥17次檢出。
10.1.4.1.3 交叉反應10.1.4.1.3.1 驗證方案
產生交叉反應的靶物質可能包括導致類似臨牀表現的病原以及遺傳相關物質。爲了評估潛在交叉反應,可以在特定的已知患者標本中加入與之密切相關的病原樣品,其濃度水平能代表或超出患者標本中可能出現的水平。
10.1.4.1.3.2 可接受標準
6.10.1.4.2 10.1.4.2 定量檢測的驗證內容包括:正確度、精密度、線性區間和 LOQ 驗證。
10.1.4.2.1 正確度驗證10.1.4.2.1.1 驗證方案
一種方法是採用參考材料,可來源於室間質量評價正確度驗證計劃、廠家提供的正確度驗證計劃的質控品、其他第三方供應商提供等。至少選擇兩個濃度水平的參考材料,對每個參考材料分別重複測量3次,比較均值與標定濃度值,計算偏倚。
另一種方法是採用患者診斷明確的標本,收集臨牀標本20例,標本的濃度儘量涵蓋線性範圍。收集後的標本在一週內集中檢測,每個標本重複檢測2次。取均值與原檢測結果進行比對。計算兩者線性相關係數(R),並進一步計算兩者各自的迴歸曲線。分別計算當檢測值log10=3、4、5、6、7 時的允許總誤差(total error,TE)。計算TE = 偏倚(Bias)+3CV(此處 CV 採用精密度性能評估中精密度值)。
10.1.4.2.1.2 可接受標準
與目標TE比較(目標TE爲廠商允許的總誤差10%),TE<10%表示可接受。
10.1.4.2.2 精密度驗證10.1.4.2.2.1 驗證方案
連續5天,每天檢測1個分析批次,濃度水平選擇4~5倍LOD,對樣品每天重複檢測5次,數據通過log10轉換後使用,收集5×5=25個有效數據,並通過統計分析評價方法計算精密度值(精密度值=標準偏差/計算結果的算術平均數×100%)。
10.1.4.2.2.2 可接受標準
10.1.4.2.3 線性區間驗證10.1.4.2.3.1 驗證方案
常用方法爲選取一份結果接近線性範圍上限的患者標本,用正常人陰性標本按1:10、1:100、1:1000、1:10000、1:100000系列稀釋(比製造商聲明的分析測量低限低一個數量級),可選擇5~7個濃度水平,以稀釋計算值作爲理論值,各稀釋樣品的實測值與理論值進行迴歸分析,對每個樣品進行檢測,經統計後擬合迴歸線y=bx+a。
10.1.4.2.3.2 可接受標準
將擬合迴歸線的相關係數r≥0.975(r2≥0.95),b值在1±0.05範圍作爲判斷標準。
10.1.4.2.4 LOQ 驗證10.1.4.2.4.1 驗證方案
將一份已知定值的標準品或可以量值溯源的定值質控品,稀釋到介紹申明的LOQ,重複測量20次。
10.1.4.2.4.2 可接受標準
每個樣品的檢測結果與該樣品的參考值(或均值)的偏差和誤差目標進行比較,要求≥17個檢測結果滿足上述要求。
6.10.2 10.2 部分感染免疫項目的性能驗證
6.10.2.1 10.2.1 驗證項目和驗證時機
6.10.2.1.1 10.2.1.1 驗證項目
定性項目主要包括:隱球菌莢膜多糖抗原檢測、肺炎鏈球菌抗原檢測、A羣鏈球菌抗原檢測、嗜肺軍團菌抗原檢測、麴黴半乳甘露聚糖檢測(GM試驗)、艱難擬梭菌毒素A/B檢測等。
定量項目主要包括:真菌(1-3)-β-D葡聚糖檢測(G試驗)等。
6.10.2.1.2 10.2.1.2 驗證時機見本標準第 5.1 條通用要求
6.10.2.2 10.2.2 驗證前準備工作見本標準第 10.1.3 條
6.10.2.3 10.2.3 驗證方案
6.10.2.3.1 10.2.3.1 定性檢測的驗證內容包括:符合率驗證,精密度(重複性)驗證,臨界值和檢出限驗證和抗
干擾能力。
10.2.3.1.1 符合率的驗證10.2.3.1.1.1 驗證方案
選取標準品或臨牀標本,其中陰性2份、陽性3份,共5份樣品,按照患者標本檢測程序進行檢測。
10.2.3.1.1.2 可接受標準
要求符合率爲100%。
10.2.3.1.2 精密度(重複性)驗證10.2.3.1.2.1 驗證方案
選取標準品或臨牀標本,陰性1份、弱陽性1份及陽性1份,共3份樣品,按照患者標本檢測程序,每個樣品重複檢測3次,連續檢測5天。在每一批次測量中,應同時測量質控品。
10.2.3.1.2.2 可接受標準
可接受標準爲所用廠商檢驗方法聲明的標準。若無可用的廠商標準時,實驗室可根據臨牀診療的質量要求確定可接受標準。
10.2.3.1.3 臨界值和檢出限驗證10.2.3.1.3.1 驗證方案
選取處於臨界值的標準品或臨牀標本,檢測20次。選處於臨界值+20%和臨界值-20%(可根據試驗適當調整,或採用廠商規定的灰區上限和下限)的標準品或臨牀標本,檢測10次。
10.2.3.1.3.2 可接受標準
臨界值標準品或臨牀標本檢測20次,陰性/陽性次數均在7~13次之間,則符合要求。臨界值+20%的標準品或臨牀標本檢測10次,陽性次數應≥9次。臨界值-20%的標準品或臨牀標本檢測10次,陰性次數應≥9次。
10.2.3.1.4 抗干擾能力
6.10.2.3.2 10.2.3.2 定量檢測的驗證內容包括:正確度、線性區間和可報告範圍驗證,精密度驗證和抗干擾能力。
10.2.3.2.1 正確度、線性區間和可報告範圍驗證10.2.3.2.1.1 驗證方案
選擇5份標準品或臨牀標本(可進行稀釋),濃度在測量區間內均勻分佈,應覆蓋定量限(低限和高限),並關注醫學決定水平。在相同時段內完成5個濃度的檢測,每個濃度重複檢測3次,計算每個濃度檢測結果的均值、偏倚、SD、CV值。對高值樣品,計算乘以稀釋倍數後的還原濃度和相對偏差。所有樣品應在一次運行中或幾次間隔很短的運行中隨機測定,最好在1天之內完成。驗證正確度、線性區間和可報告範圍。
10.2.3.2.1.2 可接受標準
正確度應該以室間質評結果爲標準,線性區間和可報告區間參考廠商介紹。
10.2.3.2.2 精密度驗證10.2.3.2.2.1 驗證方案
重複性和中間精密度:每天檢測1個分析批,每批檢測2個水平的樣品,每個樣品重複檢測3次,連續檢測5天。在每一批次測量中,應同時測量質控品。
10.2.3.2.2.2 可接受標準
不超過總允許誤差的1/3。
10.2.3.2.3 抗干擾能力
8 附錄B(資料性)微生物鑑定系統和藥敏檢測系統性能驗證
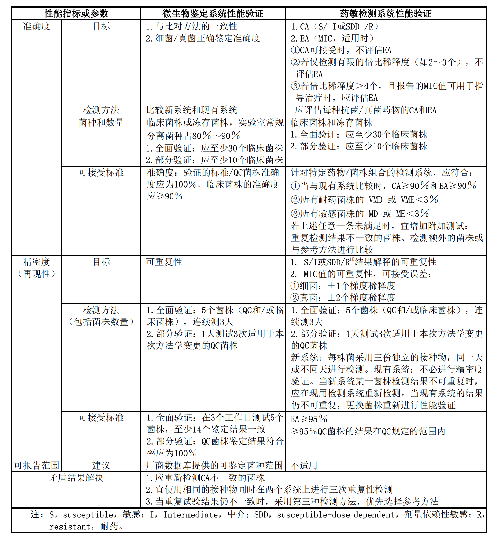
8.1 B.1 微生物鑑定系統和藥敏檢測系統的性能驗證指標、要求、方法和可接受標準見表B.1。
表B.1 微生物鑑定系統和藥敏檢測系統的性能驗證指標、要求、方法和可接受標準
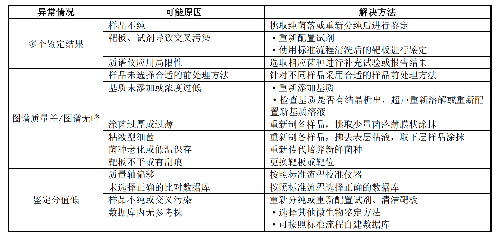
8.2 B.2 質譜檢測系統常見鑑定錯誤原因見表B.2。
10 參考文獻
[1] 中華人民共和國國家衛生和計劃生育委員會醫政醫管局.全國臨牀檢驗操作規程(第四版).北京:人民衛生出版社,2015.
[2] Clinical Laboratory Standards Institute (CLSI). Verification of Commercial Microbial Identification and Antimicrobial Susceptibility Testing Systems, M52, 2015.
[3] 中華人民共和國國家衛生和計劃生育委員會.下呼吸道感染細菌培養操作指南:WS/T 499-2017. 2017.
[4] 中華人民共和國國家衛生和計劃生育委員會.侵襲性真菌病臨牀實驗室診斷操作指南:WS/T 497-2017.2017.
[5] 中華人民共和國國家衛生和計劃生育委員會.細菌性腹瀉臨牀實驗室診斷操作指南:WS/T 498-2017.2017.
[6] 王輝,馬筱玲,寧永忠,等.細菌與真菌塗片鏡檢和培養結果報告規範專家共識.中華檢驗醫學雜誌,2017,40(1):17-30.
[7] 周庭銀,倪語星,胡繼紅,等.臨牀微生物檢驗標準化操作(第三版).上海:上海科學技術出版社,2015.
[8] 中國合格評定國家認可委員會.臨牀微生物檢驗程序驗證指南:CNAS GL028-2018.2018.
[9] 國家市場監督管理總局、國家標準化管理委員會.醫學實驗室 質量和能力的要求 第6部分:臨牀微生物學檢驗領域的要求:GB/T 22576.6-2021.2021.
[10] 王輝,馬筱玲,錢淵,等.臨牀微生物學手冊(第12版).北京:中華醫學電子音像出版社,2021.
[11] Clinical Laboratory Standards Institute (CLSI). Methods for the Identification of Cultured Microorganisms Using Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry, 1st Edition, M58, 2017.
[12] 胡繼紅,馬筱玲,王輝,等.MALDI-TOF MS在臨牀微生物鑑定中的標準化操作專家共識.中華檢驗醫學雜誌,2019,42(4):241-249.
[13] 羅燕萍,徐英春,王輝,等.自建MALDI-TOF MS微生物鑑定數據庫專家共識.中華檢驗醫學雜誌,2019,42(6):414-419.