1 拼音
dì èr lèi yìng guǎn nèi kuī jìng chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《第二類硬管內窺鏡產品註冊技術審查指導原則》由國家食品藥品監督管理局於2007年11月15日發佈。
本指導原則旨在指導和規範第二類硬管內窺鏡產品的技術審評工作,幫助審查人員增進對該類產品機理、結構、主要性能、預期用途等方面的理解,方便審查人員在產品註冊技術審評時把握基本的要求和尺度。此外,由於我國醫療器械法規框架仍在構建中,審查人員仍需密切關注相關適用標準與註冊法規的變化,以確認申報產品是否符合法規要求。
3 二、技術審查要點
3.1 (一)產品名稱
1.喉鏡,其他名稱:“喉內窺鏡”;
5.直腸鏡;
3.2 (二)產品的結構和組成
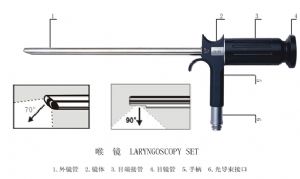
(1) 喉鏡
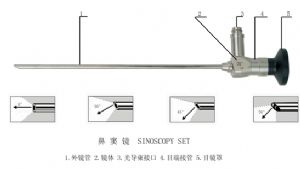
(2) 鼻竇鏡
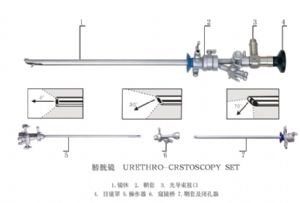
(3) 膀胱鏡
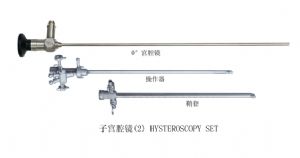
(4)子宮鏡

(5) 直腸鏡


(6) 羊水鏡

喉鏡、鼻竇鏡、羊水鏡由外鏡管、光導束、內鏡管、光學系統、鏡體、光導束接口、目端接管、目鏡罩等組成。
子宮鏡一種由22°角外鏡管、光導束、內鏡管、光學系統、鏡體、光導束接口、目端接管、目鏡罩、輸液管、操作管、限位器、宮頸塞等組成;另一種由內窺鏡體、操作器、鞘套組成。
直腸鏡一種是帶有光學系統的內窺鏡,由閉孔器、窺視管、手柄、鏡盤、注氣嘴、光導束接口等組成;另一種是沒有光學系統的內窺鏡,只有內外窺視管,中間裝有照明光導束,帶有手柄、鏡盤、注氣嘴、光導束接口等組成的直腸鏡。
3.產品材料
(1)與人體接觸的內外鏡管、鏡鞘、窺視管一般採用1Cr18Ni9Ti管材製造。
(4)鏡體、光導束接頭、目端接管、窺鏡橋、閉孔器、操作器一般採用不鏽鋼材料或52銅材料加工之後電鍍。目前國外均不採用銅製造。
4.配套使用的器械
(1)喉鏡可以配套使用的器械主要有喉鉗、喉剪、聲帶息肉鉗、聲帶息肉剪等(爲第一類醫療器械)。
(2)鼻竇鏡可以配套使用的器械主要有光學鉗、鼻組織鉗、鼻咬骨鉗、鼻息肉鉗、鼻組織剪等(爲第一類醫療器械)。
(3)膀胱鏡、子宮鏡可以配套使用的器械主要有軟性活剪鉗、剪刀、鋸齒鉗(爲第一類醫療器械)。
(4)直腸鏡可以配套使用的器械主要有硬性活剪鉗(爲第一類醫療器械)。
(1)喉鏡、鼻竇鏡、膀胱鏡、直腸鏡、羊水鏡五個產品的產品結構、組成、材料、工作長度、外徑尺寸、配套使用的器械國內外基本相同,規格型號有所不同。
(2)子宮鏡國外使用的基本上是內窺鏡斜視30°,外加操作器、鞘套,國內有部分醫院使用,但國內更多的醫院使用22°彎角的子宮鏡。配套器械國內外相同,規格型號也相同。
(3)國外產品的視場角等各項指標相對比國內要求高;另,直徑較小的內窺鏡國內採用3mm的比較多,國外基本上採用2.7mm,而且國外產品的工藝水平更高,手感更好。
3.3 (三)產品的工作原理
1.產品的基本原理和實際使用描述
光學成像系統由物鏡系統、轉像系統、目鏡系統三大系統組成。工作原理:被觀察物經物鏡所成的倒像,通過轉像系統將倒像轉爲正像,並傳輸到目鏡,再由目鏡放大後,爲人眼所觀察。爲構成不同的視向角,需加入不同的棱鏡。不同用途的內窺鏡根據使用要求製作成不同的外形、外徑、長度,以達到使用所需的要求。
照明傳輸系統由光導纖維組成。工作原理:將冷光源的光經過光導纖維傳輸到內窺鏡前端,照亮被觀察物。
(2)硬管內窺鏡產品是利用人體自然腔道進入人體觀察和診察,不需切口或打孔穿刺進入人體。膀胱鏡、子宮鏡和直腸鏡可以利用鏡體本身的操作孔道進入活剪鉗、剪刀、鋸齒鉗進行活剪取樣、切割等臨牀手術;喉鏡、鼻竇鏡、羊水鏡本身不帶有器械孔道,不配有鏡鞘等,只能做檢查診斷用。硬管內窺鏡不需用人眼直接觀察,可與CCD直接相連接。
在操作膀胱鏡時,先將鞘套與閉孔器插入尿道及膀胱,退出閉孔器。將內窺鏡與鏡橋(觀察用插管時用插管器)聯接插入鞘套後鎖緊,進水和出水管聯接鞘套水閥上,導光束聯接內窺鏡上,打開光源及水閥即可進行手術,將異物鉗、剪刀、鋸齒鉗等插入器械孔道可進行活檢、取樣、息肉摘除等手術。
在操作子宮鏡時,先膨脹宮腔,然後將操作鞘套與閉孔器順宮腔方向插入到宮頸內口稍下方,退出閉孔器,將操作器及內窺鏡插入鞘套後鎖緊,將輸液管聯接鞘套水閥上,在80-180mmHg範圍的壓力下注入5%葡萄糖液以膨宮。待排水孔流出的液體清亮後,在直視下將鏡體進一步推進,待子宮腔充分擴張後即可進行觀察子宮異常或病變,若必要時可做相應的內膜活檢、輸卵管插管注藥、分離粘連等手術。
直腸鏡可以分爲二種型號,一種是帶有光學系統的內窺鏡,可在內窺鏡直視下活檢取樣,摘除息肉。另一種是不帶光學系統,具有觀察目的、內外鏡管之間裝有照明光束的內窺鏡,它可以在光導束的照明下直接下手術鉗進行活檢取樣。
(1)工作長度參數:
喉鏡工作長度≥180mm;
鼻竇鏡工作長度≥175mm;
膀胱鏡工作長度≥300mm;
22°角子宮鏡工作長度≥165mm;
直腸鏡工作長度≥150mm;
羊水鏡工作長度≥300mm。
(2)鏡管外徑:
不同用途(成人和兒童)的內窺鏡產品,其外徑尺寸也不相同,一般情況下:
喉鏡外徑尺寸Φ5mm、Φ8mm、Φ10mm;
膀胱鏡鏡鞘外徑尺寸以Fr爲單位,國內常用16.5Fr、18.5Fr、21Fr、23Fr,國外常用24Fr、25Fr;
(3)目鏡罩外徑尺寸關係到與CCD攝像系統的配合,國際通用尺寸直徑32mm。
① 視場角:鼻竇鏡、膀胱鏡、子宮鏡、直腸鏡、羊水鏡的視場角不能小於60°,否則影響觀察範圍。目前國外同類產品的視場角已達到90°以上,喉鏡的視場角在45°左右,國外同類產品相同。
②視向角:視向角一般分爲前視(00°、12°)、斜視(30°、45°)、側視(70°、90°)。
③分辨率:分辨率是內窺鏡重要的光學指標,普通內窺鏡一般應大於9.92Lp/mm(L=10mm)。
(5)照度:主要是照度的均勻性,如照度不能充滿視場,則周邊模糊,進而影響視野。
(6)機械性能:
① 密封性:內窺鏡的密封性關係到成像質量,如密封不好就容易滲水,破壞光學系統,影響觀察。通水閥鏡鞘與膀胱鏡的錐體配合處應密合,在1min內滲水應不超過5滴,否則配合不好容易漏水影響手術。
② 表面粗糙度:由於內窺鏡是直接進入人體內,它的表面質量很重要,因此內窺鏡表面不能有鋒棱、毛刺及明顯傷痕現象。
③ 連接部位牢固性:膀胱鏡器械各組成件之間的連接應牢固可靠,拆裝應靈活方便。
3.4 (四)產品應適用的標準
1.適用的國家標準、行業標準
YY 0068 醫用硬管內窺鏡通用技術條件
GB 11244 醫用內窺鏡及附件通用要求
GB 9706.1 醫用電氣設備 第一部分:安全通用要求
GB 9706.19 醫用電氣設備 第2部分:內窺鏡設備安全專用要求
及新出版的適用標準
2.適用的國際標準:
ISO8600-1 光學和光學儀器—醫用內窺鏡及內治療設備 第1部分:基本要求
ISO8600-2 光學和光學儀器 —醫用內窺鏡及內治療設備 第2部分:硬性支氣管鏡的專用要求
ISO8600-3 光學和光學儀器—醫用內窺鏡及內治療設備 第3部分:視場角和視向角的測定
ISO8600-4 光學和光學儀器—醫用內窺鏡及內治療設備 第4部分:插入部分的最大寬度
以及新出版的適用標準
3.可引用或參照的相關標準:
GB/T191 包裝儲運圖示標誌
GB9706.15 醫用電氣設備 第1部分:安全通用要求 1.並列標準: 醫用電氣系統安全要求
GB/T16886.1 醫療器械生物學評價 第1部分:評價與試驗
GB/T16886.5 醫療器械生物學評價 第5部分:體外細胞毒性試驗
GB/T16886.10 醫療器械生物學評價 第10部分:刺激與致敏反應試驗
YY0466 醫療器械 用於醫療器械標籤、標記和提供信息的符號
YY0505 醫用電氣設備 第1-2部分:安全通用要求-並列標準:電磁兼容-要求和試驗
3.5 (五)產品的預期用途
產品名稱 | 適用範圍 | |
喉鏡 | 2. 氣管異物病人一般應慎用。 | |
鼻竇鏡 | 5.嬰幼兒及孕婦慎用; 6.急性炎症。 | |
膀胱鏡 | 3.膀胱容量小於50ml者; 6.月經期及孕期婦女; | |
子宮鏡 | 5.宮頸難以擴張者; | |
直腸鏡 | 2.腸內異物尚未取出; 3.病變部位嚴重發炎,粘連後過度扭曲或縮窄; 4.精神病人或不合作病人; 5.疑有腸穿孔者。 | |
羊水鏡 | 1.前置胎盤; 2.先兆子癇; 4.性傳播疾病; 5.宮頸癌; 6.臀位。 |
3.6 (六)產品的主要風險
(1) 電能
①可能的危害:
與冷光源、攝像顯示系統等有源醫療器械互連使用時可能對使用者、患者產生電擊危害。
②可採取的風險控制措施:
——導光索兩端之間採用絕緣隔離;和/或:在配合使用的冷光源光輸出口與導光束之間採用絕緣隔離,確保互連後硬管鏡成爲冷光源的BF型應用部分;
——與CCD攝像頭相配接的目鏡罩採用合適的絕緣材料製造;和/或:CCD攝像頭物鏡適配器採用合適的絕緣材料製造;和/或:採用接口用合適絕緣材料製造的CCD攝像頭,使配合後硬管鏡成爲攝像顯示系統的BF型應用部分;
——使用說明書對與有源器械互連條件關於防止電擊危害作詳細說明。
③審查要點:
——關注硬管鏡相關電氣隔離部位的絕緣結構,如與CCD攝像頭相配接的目鏡罩、冷光源接口、導光索等相關附件的絕緣結構和材料等;
——檢查註冊產品標準中對相關安全條款的描述,如上述絕緣部位的電介質強度試驗要求等;
——檢查隨附文件(使用說明書等),隨附文件中應有與有源器械互連條件關於防止電擊危害的詳細說明,至少應說明互連使用時,硬管鏡(及其附件)應成爲該有源器械與硬管鏡組成的醫用電氣設備(系統)的BF/CF型應用部分;
(2)熱能
①可能的危害:
與冷光源等有源醫療器械互連使用時可能超溫,對患者產生灼傷危害。
②可採取的風險控制措施:
——在冷光源燈座反光鏡上鍍紅外增透膜、在光輸出口設置紅外濾光片,最大限度地限制紅外光的輸出;
——增加照明光路光纖密度,並提高界面拋光質量,減少光纖斷絲;
——使用說明書對與有源器械互聯條件關於防止超溫危害作詳細說明。
③審查要點:
——關注硬管鏡相關絕熱部位,如手握部分、目鏡和插入部分的絕熱結構和材料等;
——檢查隨附文件(使用說明書等),隨附文件中必須有與有源器械(如冷光源)互連條件關於防止超溫危害的詳細說明,如對冷光源的輸出光譜、高頻發生器的額定輸出頻率和額定輸出峯值電壓等參數作出規定,對中性電極與患者的接觸程度提出要求等。
(1)生物不相容性
①可能的危害:
如果製造硬管鏡插入部分的材料不符合生物相容性要求,就可能對患者產生細胞毒性、致敏、刺激等危害。
②可採取的風險控制措施:
與患者人體接觸的部件,採用無毒、無致敏、無刺激的材料製造,且所購物資均有質保書,並嚴格按檢驗規程進行進貨檢驗;
③審查要點:
(2)交叉感染
①可能的危害:
如果硬管鏡在使用前後,不按規範嚴格地清洗、消毒和滅菌,就可能對患者產生交叉感染的危害。
②可採取的風險控制措施:
在使用前後,應進行嚴格的清洗、消毒和滅菌,執行《內鏡清洗消毒技術操作規範》。例如:
——浸入2%戊二醛溶液中100min,然後再用35℃左右清水沖洗並擦乾;
——推薦用134℃,0.2MPa高壓蒸汽滅菌(硬管鏡應耐高溫)。
③審查要點:
——檢查使用說明書,其中必須有使用前後清洗、消毒和滅菌方法的內容。如:執行《內鏡清洗消毒技術操作規範》等。
——檢查使用說明書,應有使用前後不按規定進行清洗、消毒和滅菌,會導致交叉感染危險的警示性說明。
儲存或運行偏離預定的環境條件,意外的機械破壞。
①可能的危害:
如果硬管鏡在沒有按要求包裝運輸,或貯存環境不滿足要求,或使用時發生摔打、跌落和碰撞,就會造成鏡片損壞發黴發霧、光軸偏移、管子癟陷、密封性能變差而引起圖像不清等現象,可能對患者產生誤診等危害。
②可採取的風險控制措施:
——硬管鏡應進行合理包裝,如:先裝入中性塑料袋,再裝入內襯軟性塑料的硬質手提箱,並使各件分隔固定,硬質手提箱外套塑料袋,再裝入瓦楞紙箱內;
——硬管鏡應貯存在相對溼度不超過80%、乾燥、通風、無腐蝕性氣體的清潔室內;
——硬管鏡應放在專用箱內,不可交叉重疊放置;
——硬管鏡在儲運和使用過程中,應避免摔打、跌落和碰撞等。
以上各項,可在外部標記和隨附文件加以說明和警示。
③審查要點:
——檢查註冊產品標準中關於環境試驗、包裝、運輸、貯存、外部標誌的規定;
——檢查介紹中有關儲運、貯存方法的規定和硬管鏡損壞不得使用的警示性說明。
4.與硬管鏡使用有關的危害
(1)不適當的標記
①可能的危害:
硬管鏡的部件如鏡橋、鏡鞘、操作器的配合性要求較高,如配合件上沒有適當的配套用標識,或實際值與標識值不符,導致配合不當,可能對患者產生損傷組織等危害。
②可採取的風險控制措施:
——必要時硬管鏡上應有適當的配套用的標識;
——使用前檢查配套標識的一致性。
③審查要點:
(2)不適當的操作說明
①可能的危害:
——使用前檢查規範不適當,如未說明必須檢查硬管鏡成像清晰度等性能、電氣安全性是否良好,與導光束的配接及導光束與冷光源的配接是否良好等事項;
——硬管鏡和/或與之配合的器械使用操作說明不適當,就會由於設備共用不當而對患者產生危害;
——硬管鏡的維護規範不適當,如消毒滅菌方法不合適,導致硬管鏡性能變差、消毒滅菌不徹底,對患者產生誤診或交叉感染等危害。
②可採取的風險控制措施:
——仔細編寫操作說明,對硬管鏡配合器械的規範、使用前檢查規範、使用後維護規範進行充分、必要、簡潔的敘述。
——使用前的檢查可包括:
a) 硬管鏡成像清晰度等性能、電氣安全性是否良好,是否有銳邊、銳角;
b) 硬管鏡與導光束的配接、導光束與冷光源的配接是否良好;
c) 冷光源的工作是否可靠,連接後要確認插入部位溫度是否超過41℃,電氣安全性是否良好;
d) 配套使用的手術器械是否工作可靠:
-手術器械各聯接部位是否牢固,不會脫落;
-手術器械的開閉是否良好;
-手術器械的鉗齒是否清晰完整、無缺刃、崩刃現象;
-手術器械是否有良好的彈性和夾持力;
-外表是否光滑,無鋒棱、毛刺及明顯的碰傷和劃痕。
——使用前的患者準備規範可請有資歷的醫生編制。
③審查要點:
——檢查隨附文件(使用說明書等),是否具有必要的操作說明,如使用前檢查的內容、使用中的注意事項、使用後的處理等。
(3)由不熟練/未經培訓的人員使用
①可能的危害:
硬管鏡必須由經必要培訓而且操作熟練的醫生使用,不然可能對患者產生嚴重危害。
②可採取的風險控制措施:
——編寫培訓資料,包括視頻光盤;
——開辦培訓班;
——隨附文件中給出必須由經過培訓操作熟練的醫生使用的警示。
③審查要點:
檢查隨附文件(使用說明書等),是否具有“必須由經必要培訓而且操作熟練的醫生使用”的內容和相關警示性說明。
①可能的危害:
硬管鏡與其他醫療器械一樣,都有適應症、禁忌症和副作用,如果說明不充分,可能對患者產生嚴重危害。
②可採取的風險控制措施:
——編寫的使用說明書關於適應症、禁忌症和副作用部分請有資歷的臨牀醫生審定。
③審查要點:
——檢查隨附文件(使用說明書等),是否具有明確的適應症、禁忌症、副作用的充分說明和相關警示性說明。
——檢查臨牀驗證報告,並與使用說明書的適應症、禁忌症和副作用內容相比較。
(5)與消耗品、附件、其他醫療器械不相容
①可能的危害:
——硬管鏡使用時往往需要與消耗品、附件、其他醫療器械一起使用,它們之間是否相容,對安全影響很大。如硬管鏡與手術器械不相容,造成手術器械無法順暢插入,或無法出現在硬管鏡的視場中,導致危害發生。
②可採取的風險控制措施:
——若有可能,通過實際試驗,找出一批可與硬管鏡配合使用的消耗品、附件、其他醫療器械的清單供使用者選用;
——在使用說明書中將上述清單列出;
——在使用說明書中給出與不相容的消耗品、附件、其他醫療器械共用會產生危害的警示性說明。
③審查要點:
——檢查隨附文件(使用說明書等),是否有與不相容的消耗品、附件、其他醫療器械共用會產生危害的警示性說明;
(6)銳邊與銳尖
①可能的危害:
如果硬管鏡或配合器械插入部分表面存在非期望的尖銳邊緣或突出物等疵病,有可能損傷皮膚、粘膜、血管,甚至造成大出血。
②可採取的風險控制措施:
——通過設計、精密製造、良好的維護保養和使用前檢查,確保硬管鏡的表面無非期望的尖銳邊緣或突出物,手術器械的外表面光滑、杆部平直,無鋒棱、毛刺及明顯的碰傷和劃痕。
——通過使用前仔細檢查的提示,告知如發現有此類疵病,應及時處理、修復,不能使用。
③審查要點:
——檢查隨附文件(使用說明書等),其中應有使用前檢查硬管鏡外表面是否存在銳邊與銳尖的注意事項。
(7)色分辨能力和視場邊緣/中心光能比不良
①可能的危害:
硬管鏡的色分辨能力差,或視場邊緣光效性能太低,可能影響醫生的觀察和操作,造成誤診或手術失敗。
②可採取的風險控制措施:
通過設計和精密製造,改善硬管鏡的顏色分辨性能和視場邊緣光效性能。
③審查要點:
檢查風險管理文件的相關內容,應有防止色分辨性差,或邊緣、中心光能比太低危害的描述。
(8)接口混淆
①可能的危害:
硬管鏡有沖洗接口、送氣接口和手術器械通道口,如若操作使用中接口混淆,顯然會對患者造成傷害。
②可採取的風險控制措施:
——將手術器械通道口、沖洗接口和送氣接口等設計成不能互換的不同的型式;
——在隨附文件中給出提示,要求與其他器械連接時,應絕對避免連錯接口。
③審查要點:
——檢查隨附文件對避免接口混淆的警示。
(1)缺少維護規範和/或維護不適當
①可能的危害:
——硬管鏡的維護保養應有適當的規範。如清洗規範、消毒滅菌規範、搬運儲存規範等,不然會造成維護不當,破壞硬管鏡的性能;
——使用者未按規範進行適當的維護保養,破壞了硬管鏡的性能,如鏡片發黴損壞、光軸偏離、密封性降低、導光纖維折斷、視場變小、內部出現霧層、配套手術器械破壞等,可能對患者產生影響正確診斷等危害。
②可採取的風險控制措施:
——編制合適的維護保養規範,請設計、使用的專家審定;
——在隨附文件中給出上述維護規範和不按照規範維護會有嚴重後果的警示;
——對使用者進行適當的維護保養方面的培訓。
③審查要點:
——檢查隨附文件(使用說明書等),其中應有正確維護保養的內容。
(2)對硬管鏡壽命期缺少適當的規定
①可能的危害:
硬管鏡有一定的壽命期,在適當的壽命期外使用硬管鏡,會使風險增加。
②可採取的風險控制措施:
——經過理論估計和實際試驗,確定硬管鏡的適當的壽命期;
——在隨附文件中告知該壽命期,並給出在適當的壽命期外使用硬管鏡具有危險的警告。
③審查要點:
應有關於防電擊措施、防超溫措施、生物學評價、防止交叉感染、防止儲存或運行偏離預定的環境條件和意外的機械破壞、防止不適當標記危害、防止不適當操作說明危害、防止由不熟練或未經培訓的人員使用危害、防止適應症禁忌症和副作用說明不充分危害、防止與不相容的消耗品、附件、其他醫療器械共用危害、防止銳尖銳邊危害、避免接口混淆、防止維護規範和/或維護不適當危害、防止缺少壽命期規定危害等的描述(包括該危害的風險分析、降低該風險的措施、可接受水平或剩餘風險等內容)
3.7 (七)產品的主要技術性能指標
本條款給出需要考慮的產品主要技術性能指標,其中部分性能指標給出定量要求,其他性能指標因要求不統一或不是強制要求而未給出定量要求,企業具體可參考相應的國家標準、行業標準,以及企業自身的技術能力。以下如有不適用條款(包括國家標準、行業標準要求),企業在標準的編制說明中必須說明理由。
1.機械、理化性能
(1) 插入部外徑;
(2) 內徑:操作孔、注液孔;
(3) 工作長度;
(4) 鏡管粗糙度;
(5) 目鏡罩外徑;
(6) 密封性;
(7) 耐腐蝕性;
(8) 各連接部位牢固度。
有彎角的“子宮鏡”還需考慮“前端彎角及允差”和“前端彎曲長度”等要求。
(1)視場角,與企業標稱值的偏差不大於15%;
(2)視向角,與企業標稱值的偏差不大於10%;
(3)放大率;
(4)分辨率;
(5)照度;
(6)景深;
(7)內部不起霧;
(8)照明光源和觀察視場的重合性。
3.生物學評價
硬管內窺鏡的插入部外表面金屬材料,應選用醫用不鏽鋼材料,或按GB 16886.1進行生物學評價。
4.電氣安全
硬管內窺鏡自體是無源產品,然而該產品必須配合有源內窺鏡設備使用,因此需滿足GB 9706.1和GB 9706.19的互連要求。硬管內窺鏡配套使用的設備有:必配設備爲冷光源;選配設備爲攝像系統;內窺鏡手術中可能使用的設備爲沖洗吸引系統、刨削系統、氣腹機、高頻手術設備、激光設備等。
(1) 產品特徵
與硬管內窺鏡配套電氣設備的電氣類型屬BF或CF型,因此硬管內窺鏡屬內窺鏡設備的BF或CF型應用部分。
(2)外部標記
應至少有下列“永久貼牢的”和“清楚易認的”標記:
①製造廠或供貨單位的名稱和(或)商標,必須標在應用部分上;
②型式標記必須標在應用部分上。
(3)使用說明書
見GB9706.19中6.8.2條的要求。
(4)技術介紹
按GB9706.1中6.8.3條要求。(注:可與使用說明書合併)
(5)環境條件
①運輸和貯存
環境溫度範圍:-40℃~+70℃;
相對溼度範圍:10%~100%;
大氣壓力範圍:500hpa~1060hpa。
②運行
環境溫度範圍:10℃~40℃;
相對溼度範圍:30%~75%;
大氣壓力範圍:700hpa~1060hpa。
(6)應用部分的隔離
按GB9706.1中17 c)條要求。
(7)正常工作溫度下電介質強度
按表A1所規定的部位之間應能承受50Hz,正弦波及規定試驗電壓1min,無擊穿或閃絡現象。
表A1 電介質強度檢測部位及試驗電壓
(8) 潮溼預處理後的電介質強度
按表A1所規定的部位之間應能承受50Hz,正弦波及規定試驗電壓1min,無擊穿或閃絡現象。
(9) 面、角、邊的安全性
按GB9706.1中23條要求。
(10) 超溫危險的防護。
按GB9706.19中42條的要求
按GB9706.1中44.7條要求。
5.環境試驗
3.8 (八)產品的檢測要求
按照《醫療器械註冊管理辦法》第二章的要求檢測。
3.9 (九)產品的臨牀要求
1.在進行臨牀試驗時,對臨牀試驗機構、臨牀試驗方案和報告的要求:
(1)臨牀試驗應按照《醫療器械臨牀試驗規定》(5號令)的要求進行。
(2)臨牀試驗機構應爲國家食品藥品監督管理局認定公佈的藥品臨牀試驗基地。
(3)臨牀實驗方案的要求
① 臨牀試驗的項目內容應能反映產品的使用特性和預期目的,並與產品的安全性、實用性、可靠性、有效性密切相關;
② 明確臨牀試驗病例入選和排除的原則;
③ 對硬管內窺鏡產品,應臨牀觀察產品光潔度、密封性、電氣和生物安全性能、視場大小和質量、器械自身以及與配套器械的操作性能、產品結構和功能設計是否滿足臨牀需要、是否耐高溫滅菌、多次消毒(滅菌)後產品上述性能是否變化等方面內容;
④ 試驗過程的總體設計應滿足對照和隨機化的要求,保證樣本(受試人羣)具有代表性,即用最少的樣本得出較爲可靠的結果和結論,同時應遵循分組隨機化的原則;
⑤ 制訂客觀、公認的評價標準,以合理判定產品的臨牀試驗效果,保證臨牀試驗結論準確、可靠;
⑥ 試驗持續時間應根據醫療機構符合入選要求的病例數量多少、臨牀試驗效果顯現觀察時間以及統計學的要求確定,試驗例數也應依據相應的統計學方法進行確定,即滿足進行統計分析的要求;
⑧ 臨牀試驗如不設對照組,應說明理由。
(4)臨牀試驗報告的要求
① 臨牀報告的內容應和臨牀方案的內容相一致,特別是臨牀試驗範圍、病例選擇原則、臨牀評價標準、評價和統計處理方法;
② 按照臨牀試驗方案的規定對試驗數據進行分析處理,並對分析結果的統計學意義進行解釋,由此得出的試驗結論應反映受試產品是否具有預期的安全性和有效性;
③ 臨牀試驗的結論、適用範圍、注意事項和禁忌症等內容應清楚、準確;
④ 設置對照組的臨牀試驗,試驗組的臨牀試驗效果應等同於或優於對照組,只有這樣,臨牀試驗才能證明產品安全有效。
2. 依據《醫療器械註冊管理辦法》,對如下情況,企業可提交臨牀試驗材料:
國內如有同類產品已批准上市,可提交同類產品的臨牀試驗材料、對比說明及所對比的同類產品批准上市證明,以確認該產品的機理成熟,安全性和有效性在臨牀應用領域已經得到充分肯定。
(1)臨牀試驗資料可以是中國政府已批准註冊的同類產品在申請註冊時所提交的臨牀試驗報告;也可以是“省級以上核心醫學刊物公開發表的能夠說明產品預期臨牀使用效果的學術論文、專著以及文獻綜述”,文獻中提及的產品必須能根據文獻中的信息判定爲同類產品。
(2)同類產品的對比說明應包括產品基本原理、結構組成、材料、主要技術性能指標、適用範圍、禁忌症等方面的比較,以充分證明申報註冊產品與已批准上市產品爲同類產品。
(3)所對比的同類產品註冊證和登記表複印件。
3.企業可免於提交臨牀試驗材料的情況
依據《醫療器械註冊管理辦法》附件12中“執行國家、行業產品標準的檢驗、診斷類醫療器械,不需要提供臨牀實驗材料”,如果申請註冊產品執行國家、行業標準爲產品標準,則可免於提交任何臨牀材料;如相應的標準不是產品標準(如通用技術條件、零部件標準),則仍需按照規定提供臨牀試驗資料。
對硬管內窺鏡中的子宮鏡(YY91075)、膀胱鏡(YY91083),可免於提交臨牀試驗材料。
4.產品如增加適用範圍,增加的適用範圍應按照以上要求提供相應的臨牀試驗材料。
3.10 (十)該類產品的不良事件歷史記錄
根據國家食品藥品監督管理局藥品不良反應監測中心收集的硬管內窺鏡醫療器械不良事件,常見硬管內窺鏡在臨牀中出現的共同問題主要有以下幾點: 1.機械故障:內窺鏡活檢鉗部分機械不能打開關閉,操作失效;2. 操作失誤:造成穿孔、出血等嚴重事件;3.電源故障:斷電等突發事件; 4. 顯示器失效:顯示器醫用彩色監視器故障;5. 消毒不合格,傳染其它疾病;6. 冷光源故障;7. 醫用光學纖維內窺鏡漏水故障;8.內窺鏡電子圖像顯示儀的圖像偏移故障;9. 纖維內窺鏡送水送氣故障。
3.11 (十一)產品介紹、標籤和包裝標識
具體產品介紹、標籤和包裝標識的編寫要求應符合《醫療器械介紹、標籤和包裝標識管理規定》和《醫療器械用於醫療器械標籤、標記和提供信息的符號》(YY0466)的要求。
【產品名稱】
喉鏡、鼻竇鏡、膀胱鏡、子宮鏡、直腸鏡、羊水鏡(應與註冊證覈准的產品名稱一致,不得在產品名稱任意增加修飾性詞語)
【商品名稱】
如有商品名的,應符合有關產品商標管理的具體規定。名稱應真實體現產品特點和企業特色,不得帶有誇大產品宣傳、誤導使用者的信息。
【註冊證號】
覈准的註冊證號,如有變更情況的,應按變更後的註冊證號編寫。
【型號、規格】
按照註冊證覈准的型號、規格填寫,不得擅自改變產品型號規格的文字表述。
【執行標準】
按照註冊證標註的產品標準進行填寫,並應標註標準年代號。
附產品結構示意圖,具體將註冊產品標準中所列重要信息予以註明,尤其是安全性、有效性性能指標和產品構成部件,如光學參數、產品組成部件以及配套使用器械、電氣安全互連要求、產品所採用的原材料。
【注意事項】
1.每次使用前,必須檢查插入人體內部的內窺鏡附件部分是否有引起安全傷害的粗糙表面、尖銳邊緣或突出物;
2.插入人體內部的窺鏡部件的表面最高溫度不得超過41℃;
3.導光束不可過度彎曲,彎曲半徑不得小於5cm;
5.在其他器械配合使用時,尤其是咬合力較大的鉗、剪類器械應注意鏡管前端一定不要伸進器械的咬合口內,以免誤傷鏡管;
6.窺鏡配合激光、汽化、電切、微波、高頻等光電技術進行手術時,應注意窺鏡前端與治療點的距離,保證窺鏡前端不被點擊或燒灼;
7.窺鏡必須經必要培訓並具有實際操作經驗的醫生使用。
【禁忌症】
詳見本指導原則第(五)條內容。
【使用方法】
2.將導光束插入光源孔,將光源亮度調至最小處,再將導光束另一端與鏡體相聯接,最後打開光源,根據需要調整光源亮度,然後對內窺鏡進行調焦直至最清晰爲止;
【運輸、貯存及保養方法】
1.窺鏡應放在專用的包裝內,內襯柔軟的海綿式聚氨脂泡沫,窺鏡和配套手術器械應碼放整齊,不得交叉重疊放置,避免搬運時相互撞擊。包裝箱內應備有乾燥劑保持箱內乾燥。包裝後的窺鏡應貯存在相對溼度不超過80%、無腐蝕性氣體和通風良好的室內。
2.消毒方法;一是用5%福爾馬林溶液或醫用酒精浸泡10-15分鐘,然後用滅菌水沖洗乾淨;二是用福爾馬林蒸汽燻蒸後再用滅菌水沖洗乾淨,鏡體部分(前端)可置於2%戊二醛液體內消毒。(具體要求可根據衛生部《消毒管理辦法》、《醫院感染管理規範》及《消毒技術規範》予以確定。)
3.手術後的保養
(1) 硬管內窺鏡在手術後,先將可拆卸的光纜接口擰下,連同窺鏡用清水沖掉血和黏液,再用脫脂棉沾醫用酒精將窺鏡整體擦拭乾淨,光纜接口用棉籤沾醫用酒精擦拭乾淨後裝回原處。
(2) 在擦拭窺鏡兩端鏡面時,可用乙醚、丙酮擦拭,擦掉污物後再用酒精擦乾淨,不可用酸鹼性大的溶劑擦拭,以免腐蝕鏡片或溶化封裝膠,造成圖像分辨率下降或鏡體內進水,清洗污物時一般用棉籤裹脫脂棉擦拭,也可用軟毛刷(毛筆)刷洗,不可用硬毛刷清理,更不能用鋒利銳器剔除。
4.維修
窺鏡出現問題時,應找專業的技術人員維修或由生產商指定售後服務單位或維修形式。
3.12 (十二)註冊單元劃分的原則和實例
1.註冊單元劃分的原則是考慮其原(機)理、結構、主要性能、預期目的是否基本相同。
2.例如,對直腸鏡,是否有光學系統可作爲註冊單元劃分的依據。一種產品只是含有光導束、窺視管等,可提供光學照明,沒有光學系統,不存在視場角、分辨率等的性能指標;另外一種產品既含有光導束,提供光學照明,又含有光學系統,提供觀察和成像途徑(詳見典型產品結構示意圖),這兩種產品應作爲兩個註冊單元。
3.子宮鏡分爲固定式結構和組件式結構兩種(詳見典型產品結構示意圖),但他們的原(機)理、結構、主要性能、預期目的基本相同,可作爲同一註冊單元的不同型號產品。
4。其他產品,如喉鏡、鼻竇鏡、膀胱鏡、羊水鏡,原理、結構基本無大變化,每種產品作爲一個註冊單元。
3.13 (十三)同一註冊單元中典型產品的確定原則和實例
1.典型產品的確定原則
(1)典型產品應是同一註冊單元內能夠代表本單元內其他產品安全性和有效性的產品;
(3)如其他產品的主要性能與被檢產品不一致,則該產品也應作爲典型產品進行註冊檢驗。
2.同一註冊單元內不同視場角、視向角、分辨率的產品,可選其最大視場角和視向角、最高分辨率的產品作爲典型產品。
4 第二類硬管內窺鏡產品註冊技術審查指導原則編寫說明
4.1 一、指導原則編寫的原則
(一)本指導原則編寫的目的是用於指導和規範第二類硬管內窺鏡產品註冊申報過程中審查人員對註冊材料的技術審評。
(二)本指導原則旨在讓初次接觸該類產品的註冊審查人員對產品機理、結構、主要性能、預期用途等各個方面有個基本瞭解,同時讓技術審查人員在產品註冊技術審評時把握基本的要求尺度,以確保產品的安全、有效。
(三)本指導原則中的第二類硬管內窺鏡產品只包括2002年版《醫療器械分類目錄》中的喉鏡、鼻竇鏡、膀胱鏡、子宮腔鏡、直腸鏡、羊水鏡。
4.2 二、指導原則編寫的依據
(一)《醫療器械監督管理條例》
(二)《醫療器械註冊管理辦法》(16號令)
(三)《醫療器械臨牀試驗規定》(5號令)
(四)《醫療器械介紹、標籤和包裝標識管理規定》(10號令)
(五)《醫療器械標準管理辦法》(31號令)
(六)關於印發《境內第一類醫療器械註冊審批操作規範(試行)》和《境內第二類醫療器械註冊審批操作規範(試行)》的通知( 國食藥監械[2005]73號)
(七)國家食品藥品監督管理局發佈的其他規範性文件
4.3 三、指導原則中部分具體內容的編寫考慮
(一)產品的結構和組成內容中,給出了典型產品的結構示意圖,以便於表述和理解。
(二)在產品的工作原理中,介紹了該類產品的基本原理,每個產品的特點和一般要求,同時也介紹了產品的現狀和發展趨勢。
(三)因產品爲非治療類醫療器械,故本指導原則不包含產品作用機理的內容。
(四)產品應適用的相關標準中給出了現行有效的國家標準、行業標準(包括產品標準、基礎標準),以及相應的國際標準。爲了與標準今後可能的修改相適應,本指導原則只註明標準號,不註明年代。另外,雖然鼻鏡有行業標準YY/T 0189,但該標準所對應的產品是不含任何光學系統的第一類醫療器械,故本指導原則未包括該標準及其所對應的產品。
(五)產品的預期用途綜合了已批准上市產品的核準範圍、公開出版的臨牀醫學文獻的描述和臨牀專家的意見,將2002年版《醫療器械分類目錄》中第二類硬管內窺鏡產品(喉鏡、鼻竇鏡、膀胱鏡、子宮鏡、直腸鏡、羊水鏡)分別描述。
(六)產品的主要風險中,參照YY/T0316中附錄D,逐項考慮產品自身以及與互聯器械配套使用時可能的危害,介紹可採取的消除和降低風險的措施以及技術審查時的要點。因爲硬管內窺鏡產品涉及光學、機械、電氣、理化、生物等方面的要求,故風險分析描述的較爲詳細,便於審查人員進行安全性、有效性判斷,並嘗試給出審查要點。
(七)產品的主要性能指標中給出了產品需要考慮的各個方面,共性的要求給出了量化的要求;一些個性的性能指標需參照相關的國家標準、行業標準;有些指標則需要依據企業的技術能力。
(八)在產品的檢測要求中,因爲《醫療器械註冊管理辦法》第二章的規定較明確,本指導原則不再複述。
(九)產品的臨牀要求中考慮了需要進行臨牀試驗和提供臨牀試驗材料兩種情況;同時,根據《醫療器械註冊管理辦法》附件12的要求,執行行業產品標準的子宮腔鏡(YY91075)、膀胱鏡(YY91083),企業可免於提交臨牀試驗材料。
(十)產品的不良事件歷史記錄主要從國家食品藥品監督管理局的不良事件數據庫中查找,也徵詢了相關領域的臨牀專家。
(十一)針對硬管內窺鏡產品特點,使用說明書中重點強調互聯器械配套的要求,滅菌或消毒的方法,注意事項和維護保養。
4.4 四、其他產品
對2002年版《醫療器械分類目錄》外的其他第二類硬管內窺鏡產品,產品註冊的技術審評可參照本指導原則。
4.5 五、指導原則編寫人員
本指導原則的編寫成員由浙江省食品藥品監督管理局醫療器械產品註冊技術審評人員、行政審批人員、國家食品藥品監督管理局杭州醫療器械檢測中心專家、內窺鏡產品專業廠家代表、臨牀專家共同組成,以充分利用各方面的信息和資源,綜合考慮指導原則中各個方面的內容,儘量保證指導原則正確、全面、實用。