3 A羣C羣腦膜炎球菌多糖疫苗藥典標準
3.1 品名
3.1.1 中文名
3.1.2 漢語拼音
A Qun C Qun Naomoyanqiujun Duotang Yimiao
3.1.3 英文名
Group A and C MeningococcalPolysaccharide Vaccine
3.2 定義、組成及用途
本品系用A羣和C羣腦膜炎球菌培養液,分別提取和純化A羣和C羣腦膜炎球菌莢膜多糖抗原,混合後加入適宜穩定劑凍乾製成。用於預防A羣和C羣腦膜炎球菌引起的流行性腦脊髓膜炎。
3.3 1 基本要求
生產和檢定用設施、原材料及輔料、水、器具、動物等應符合“凡例”的有關要求。
3.4 2 製造
生產用菌種爲A羣腦膜炎球菌CMCC 29201 (A4)菌株和C羣腦膜炎球菌CMCC 29205 (C11)菌株。
3.4.1 2.1 混合前單價原液
3.4.1.1 2.1.1 混合前A羣腦膜炎球菌多糖原液
應符合“A羣腦膜炎球菌多糖疫苗”中2.1~2.2項的規定。原液製備過程中可採用經批准的方法去除內毒素。
3.4.1.2 2.1.2 混合前C羣腦膜炎球菌多糖原液
應符合“A羣腦膜炎球菌多糖疫苗”中2.1~2.2項的規定,沉澱多糖時加入冷乙醇的終濃度爲75%~80%。原液製備過程中可採用經批准的方法去除內毒素。
3.4.1.3 2.1.3 原液檢定
按3.1項進行。
3.4.2 2.2 半成品
3.4.2.1 2.2.1 配製
用無菌、無熱原乳糖和滅菌注射用水稀釋原液。每1次人用劑量含A羣多糖50μg,C羣多糖50μg,乳糖5~10mg。
3.4.2.2 2.2.2 半成品檢定
按3.2項進行。
3.4.3 2.3 成品
3.4.3.1 2.3.1 分批
3.4.3.2 2.3.2 分裝及凍幹
符合“生物製品分裝和凍幹規程”規定。凍幹過程中製品溫度應不高於30℃,真空或充氮封口。
3.4.3.3 2.3.3 規格
按標示量復溶後每瓶0.5ml。每1次人用劑量0.5ml,含A羣、C羣多糖各50μg。
3.4.3.4 2.3.4 包裝
3.5 3 檢定
3.5.1 3.1 原液檢定
3.5.1.1 3.1.1 鑑別試驗
採用免疫雙擴散法(2010年版藥典三部附錄Ⅷ C),本品應分別與A羣及C羣腦膜炎球菌抗體形成明顯沉澱線。
3.5.1.2 3.1.2 化學檢定
3.5.1.2.1 3.1.2.1 固體總量
依法測定(2010年版藥典三部附錄Ⅶ M),A羣多糖於50℃乾燥至恆重,C羣多糖予105℃乾燥至恆重。
3.5.1.2.2 3.1.2.2 蛋白質含量
A羣、C羣多糖應分別小於8mg/g(2010年版藥典三部附錄Ⅵ B第二法)。
3.5.1.2.3 3.1.2.3 核酸含量
A羣多糖應小於8mg/g,C羣多糖應小於9mg/g。核酸在波長260nm處的吸收係數(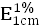 )爲200(2010年版藥典三部附錄Ⅱ A)。
)爲200(2010年版藥典三部附錄Ⅱ A)。
3.5.1.2.4 3.1.2.4 O-乙酰基含量
A羣多糖應不低於2mmol/g,C羣多糖應不低於1.5mmol/g(附錄Ⅵ F)。
3.5.1.2.5 3.1.2.5 磷含量
A羣多糖應不低於80mg/g(2010年版藥典三部附錄Ⅶ A)。
3.5.1.2.6 3.1.2.6 唾液酸含量
C羣多糖應不低於800mg/g(2010年版藥典三部附錄Ⅵ C)。
3.5.1.2.7 3.1.2.7 多糖分子大小測定
A羣、C羣多糖分子的KD值均應不高於0.40,KD值小於0.5的洗脫液多糖回收率:A羣多糖應大於76%,C羣多糖應大於80%(2010年版藥典三部附錄Ⅷ G)。
3.5.1.2.8 3.1.2.8 苯酚殘留量
A羣、C羣多糖均應不高於0.1g/L(2010年版藥典三部附錄Ⅵ M)。
3.5.1.3 3.1.3 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A).應符合規定。
3.5.1.4 3.1.4 細菌內毒素檢查
A羣、C羣多糖均應不高於25EU/μg(2010年版藥典三部附錄Ⅻ E)。
3.5.2 3.2 半成品檢定
3.5.2.1 無菌試驗
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.3 3.3 成品檢定
除裝量差異、水分測定、多糖含量、多糖分子大小測定和異常毒性檢查外,按製品標示量加入滅菌PBS復溶後進行其餘各項檢定。
3.5.3.1 3.3.1 鑑別試驗
按3.1.1項進行。
3.5.3.2 3.3.2 物理檢查
3.5.3.2.1 3.3.2.1 外觀
應爲白色疏鬆體,按標示量加入PBS應迅速復溶爲澄明液體,無異物。
3.5.3.2.2 3.3.2.2 裝量差異
依法檢查(2010年版藥典三部附錄Ⅰ A),應符合規定。
3.5.3.3 3.3.3 化學檢定
3.5.3.3.1 3.3.3.1 水分
應不高於3.0%(2010年版藥典三部附錄Ⅶ D)。
3.5.3.3.2 3.3.3.2 多糖含量
先測定A羣多糖磷含量應爲3.75~4.88μg(2010年版藥典三部附錄Ⅶ A),C羣多糖N-乙酰神經氨酸含量應爲37.5~48.8,再根據以下比例(A羣多糖含量:磷含量爲1000:75;C羣多糖含量:N-乙酰神經氨酸含量爲1000:750)計算出多糖含量。每1次人用劑量含A羣、C羣多糖應分別爲50~65μg。
3.5.3.3.3 3.3.3.3 多糖分子大小測定
來源於同批原液的成品可只抽取1批分別測定A羣腦膜炎球菌多糖和C羣腦膜炎球菌多糖的分子大小。KD值均應不高於0.40。KD值小於0.5的洗脫液多糖回收率:A羣多糖應大於75%,C羣多糖應大於80%(2010年版藥典三部附錄Ⅷ G)。
3.5.3.4 3.3.4 無菌試驗
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.3.5 3.3.5 異常毒性試驗
依法檢查(2010年版藥典三部附錄Ⅻ F),應符合規定。
3.5.3.6 3.3.6 熱原檢查
依法檢查(2010年版藥典三部附錄Ⅻ D),注射劑量按家兔體重每1kg注射0.2μg多糖,應符合規定。
3.5.3.7 3.3.7 細菌內毒素檢查
每1次人用劑量應不超過2500EU(2010年版藥典三部附錄Ⅻ E凝膠限度試驗)。
3.5.4 3.4 稀釋劑檢定
3.5.4.1 3.4.1 pH值
應爲6.8~7.2(2010年版藥典三部附錄Ⅴ A)。
3.5.4.2 3.4.2 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.4.3 3.4.3 異常毒性檢查
依法檢查(2010年版藥典三部附錄Ⅻ F),應符合規定。
3.5.4.4 3.4.4 熱原檢查
依法檢查(2010年版藥典三部附錄Ⅻ D),應符合規定。
3.6 4 保存、運輸及有效期
3.7 5 使用說明
【藥品名稱】
通用名稱:A羣C羣腦膜炎球菌多糖疫苗
英文名稱:Group A and C Meningococcal Polysaccharide Vaccine
漢語拼音:A Qun C Qun Naomoyanqiujun DuotangYimiao
【成分和性狀】
本品系用A羣和C羣腦膜炎球菌培養液,分別提取和純化A羣和C羣腦膜炎球菌莢膜多糖抗原,混合後加入適宜穩定劑凍乾製成。爲白色疏鬆體,加入所附PBS後可迅速溶解,復溶後爲澄明液體。
【接種對象】
2週歲以上兒童及成人。
【作用與用途】
接種疫苗後,可使機體產生體液免疫應答。用於預防A羣和C羣腦膜炎球菌引起的流行性腦脊髓膜炎。
【規格】
復溶後每瓶0.5ml,每1次人用劑量0.5m1,含A羣、C羣多糖各50μg。
(1)按標示量加入所附PBS復溶,搖勻立即使用。
(2)上臂外側三角肌下緣附着處皮下注射。
(3)接種1次,每1次人用劑量爲0.5ml。接種應於流行性腦脊髓膜炎流行季節前完成。
【不良反應】
常見不良反應
(1)接種後24小時內,注射部位可出現疼痛和觸痛,注射局部紅腫浸潤輕、中度反應,多數情況下2~3天內自行緩解。
(2)一般在接種疫苗後可能出現一過性發熱反應。其中大多數爲輕度發熱反應,一般持續1~2天后可自行緩解,不需處理;對於中度發熱反應或發熱時間超過48小時者,可給予對症處理。
罕見不良反應.
(2)注射局部重度紅腫或其他併發症,應對症處理。
極罕見不良反應:
(1)過敏性皮疹:一般在接種疫苗後72小時內可能出現皮疹,應及時就診,給予抗過敏治療。
(2)過敏性休克:一般在注射疫苗後1小時內發生。應及時搶救,注射腎上腺素進行治療。
(3)過敏性紫癜:出現過敏性紫癜反應時應及時就診,應用皮質固醇類藥物給予抗過敏治療,治療不當或不及時有可能併發紫癜性腎炎。
【禁忌】
(1)已知對該疫苗的任何成分過敏者。
(2)患急性疾病、嚴重慢性疾病、慢性疾病的急性發作期和發熱者。
【注意事項】
(1)以下情況者慎用:家族和個人有驚厥史者、患慢性疾病者、有癲癇史者、過敏體質者、哺乳期婦女。
(2)疫苗瓶有裂紋、標籤不清或失效者、疫苗復溶後出現渾濁等外觀異常者均不得使用。
(3)應備有腎上腺素等藥物,以備偶有發生嚴重過敏反應時急救用。接受注射者在注射後應在現場觀察至少30分鐘。
(4)嚴禁凍結。
【貯藏】
於2~8℃避光保存和運輸。
【包裝】
【有效期】
24個月。
【執行標準】
【批准文號】
【生產企業】
企業名稱:
生產地址:
郵政編碼:
電話號碼:
傳真號碼:
網 址:
3.8 版本
《中華人民共和國藥典》2010年版