3 凍幹乙型腦炎滅活疫苗(Vero細胞)藥典標準
3.1 品名
3.1.1 中文名
3.1.2 漢語拼音
Donggan Yixing Naoyan Miehuoyimiao(Vero Xibao)
3.1.3 英文名
Japanese Encephalitis Vaccine (Vero Cell), Inactivated, Freeze-dried
3.2 定義、組成及用途
本品系用乙型腦炎(以下簡稱乙腦)病毒接種子Vero細胞,經培養、收穫、滅活病毒、濃縮、純化後,加入適宜穩定劑凍乾製成。用於預防乙型腦炎。
3.3 1 基本要求
生產和檢定用設施、原材料及輔料、水、器具、動物等應符合“凡例”的有關要求。
3.4 2 製造
3.4.1 2.1 生產用細胞
生產用細胞爲Vero細胞。
3.4.1.1 2.1.1 細胞管理及檢定
應符合“生物製品生產檢定用動物細胞基質製備及檢定規程”規定。各級細胞庫細胞代次應不超過批准的限定代次。
取自同批工作細胞庫的1支或多支細胞,經復甦、擴增後的細胞僅用於一批疫苗的生產。
3.4.1.2 2.1.2 細胞製備
取工作細胞庫中的1支或多支細胞,細胞復甦、擴增至接種病毒的細胞爲一批。將復甦後的單層細胞用胰蛋白酶或其他適宜的消化液進行消化,分散成均勻的細胞,加入適宜的培養液混合均勻,置35~37℃培養形成緻密單層細胞。
3.4.2 2.2 毒種
3.4.2.1 2.2.1 名稱及來源
生產用毒種爲乙腦病毒P3株或其他經批准的Vero細胞適應株。
3.4.2.2 2.2.2 種子批的建立
乙腦病毒P3株原始種子應不超過第53代,主種子批和工作種子批應不超過批准的限定代次。
3.4.2.3 2.2.3 種子批毒種的檢定
主種子批應進行以下全面檢定,工作種子批至少應進行2.2.3.1~2.2.3.5項檢定。
3.4.2.3.1 2.2.3.1 鑑別試驗
將毒種做10倍系列稀釋,取10-1~10-5稀釋度的病毒液與乙腦特異性免疫血清等量混合爲試驗組,取10-4~10-8稀釋度的病毒液與乙腦陰性血清等量混合爲對照組,於37℃水浴90分鐘,試驗組和對照組每個稀釋度分別接種體重爲7~9g昆明小鼠或其他品系小鼠6只,每隻腦內注射0.03ml,逐日觀察,3天內死亡者不計(動物死亡數量應不得超過試驗動物總數的20%),觀察14天判定結果。中和指數應大於500。
3.4.2.3.2 2.2.3.2 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.4.2.3.3 2.2.3.3 支原體檢查
依法檢查(2010年版藥典三部附錄Ⅻ B),應符合規定。
3.4.2.3.4 2.2.3.4 病毒滴定
將毒種做10倍系列稀釋,取10-6~10-9稀釋度病毒液腦內接種體重爲7~9g昆明小鼠或其他品系小鼠,每稀釋度注射小鼠5只,每隻0.03ml,逐日觀察,3天內死亡者不計(動物死亡數量應不得超過試驗動物總數的20%),觀察14天。病毒滴度應不低於8.0 lg LD50/ml。
3.4.2.3.5 2.2.3.5 病毒外源因子檢查
依法檢查(2010年版藥典三部附錄Ⅻ C),應符合規定。
3.4.2.3.6 2.2.3.6 免疫原性檢查
用主種子批毒種製備原疫苗,腹腔免疫體重爲12~14g NIH小鼠或其他品系小鼠10只,每隻0.3ml,免疫2次,間隔7天,作爲試驗組。未經免疫的同批小鼠作爲對照組。初免後第14天,試驗組和對照組小鼠分別用不低於10000 LD50病毒量的非生產用乙腦病毒P3株進行腹腔攻擊,同時各組小鼠每隻腦腔注射0.03ml稀釋液,3天內死亡者不計(動物死亡數量應不得超過試驗動物總數的20%)。攻擊21天后免疫組應100%保護,對照組死亡率應不低於80%。
3.4.2.4 2.2.4 毒種保存
凍幹毒種應於-20℃以下保存;液體毒種應於-60℃以下保存。
3.4.3 2.3 原液
3.4.3.1 2.3.1 細胞製備
按2.1.2 項進行。
3.4.3.2 2.3.2 培養液
培養液爲含有適量滅能新生牛血清的199或其他適宜培養液。新生牛血清的質量應符合要求(2010年版藥典三部附錄Ⅻ D),且乙腦抗體應爲陰性。
3.4.3.3 2.3.3 對照細胞病毒外源因子檢查
依法檢查(2010年版藥典三部附錄Ⅻ C),應符合規定。
3.4.3.4 2.3.4 病毒接種和培養
細胞生長成緻密單層時,棄去細胞培養液,用Earle's液或其他適宜的洗滌液充分沖洗細胞,除去牛血清後,加入MEM維持液。工作種子批毒種按0.05~0.3MOI接種(同一工作種子批毒種應按同一MOI接種)。置適宜溫度下培養。
3.4.3.5 2.3.5 病毒收穫
經培養60~84小時,澄清過濾後收穫病毒液。根據細胞生長情況,可加入新鮮維持液繼續培養,進行多次病毒收穫。同一細胞批的同一次病毒收穫液檢定合格後可合併爲單次病毒收穫液。
3.4.3.6 2.3.6 單次病毒收穫液檢定
按3.1項進行。
3.4.3.7 2.3.7 病毒滅活
應在規定的蛋白質含量範圍內進行病毒滅活。單次病毒收穫液中加入終濃度爲200μg/ml甲醛,置適宜溫度滅活一定時問。病毒滅活到期後,每個病毒滅活容器應立即取樣,分別進行病毒滅活驗證試驗。
3.4.3.8 2.3.8 超濾濃縮
同一細胞批製備的多個單次病毒收穫液進行病毒滅活,檢定合格的病毒液進行適宜倍數的超濾濃縮至規定的蛋白質含量範圍。
3.4.3.9 2.3.9 純化
濃縮後的病毒液採用蔗糖密度區帶離心法或其他適宜的方法進行純化。
3.4.3.10 2.3.10 脫糖
採用蔗糖密度區帶離心進行病毒純化的應以截留分子質量100kD膜進行超濾脫糖。可加入適宜濃度的穩定劑,即爲原液。
3.4.3.11 2.3.11 原液檢定
按3.2項進行。
3.4.4 2.4 半成品
3.4.4.1 2.4.1 配製
將原液按規定的同一蛋白質含量或抗原含量進行稀釋,且總蛋白質含量應不超過20μg/ml,加入適宜的穩定劑即爲半成品。
3.4.4.2 2.4.2 半成品檢定
按3.3項進行。
3.4.5 2.5 成品
3.4.5.1 2.5.1 分批
3.4.5.2 2.5.2 分裝及凍幹
3.4.5.3 2.5.3 規格
復溶後每瓶0.5ml。每1次人用劑量0.5ml。
3.4.5.4 2.5.4 包裝
3.5 3 檢定
3.5.1 3.1 單次病毒收穫液檢定
3.5.1.1 3.1.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.1.2 3.1.2 支原體檢查
依法檢查(2010年版藥典三部附錄Ⅻ B),應符合規定。
3.5.1.3 3.1.3 病毒滴定
按2.2.3.4項進行,應不低於7.0 lg LD50/ml。
3.5.2 3.2 原液檢定
3.5.2.1 3.2.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A).應符合規定。
3.5.2.2 3.2.2 病毒滅活驗證試驗
取滅活後病毒液腦內接種體重12~14g小鼠8只,每隻0.03ml,同時腹腔接種0.5ml,爲第1代;7天后將第1代小鼠處死3只,取腦製成10%腦懸液,同法腦內接種12~14g小鼠6只,爲第2代;7天后將第2代小鼠處死3只,同法腦內接種12~14g小鼠6只,爲第3代,接種後逐日觀察14天,3天內死亡者不計(動物死亡數量應不得超過試驗用動物總數的20%),每代小鼠除處死和接種後非特異性死亡的以外,全部健存爲合格。
3.5.2.3 3.2.3 蛋白質含量
依法測定(2010年版藥典三部附錄Ⅵ B第二法),應按批准的標準執行。
3.5.2.4 3.2.4 抗原含量
可採用酶聯免疫法,應按批准的標準執行。
3.5.3 3.3 半成品檢定
3.5.3.1 3.3.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A).應符合規定。
3.5.3.2 3.3.2 抗原含量
可採用酶聯免疫法,應按批准的標準執行。
3.5.4 3.4 成品檢定
除水分測定外,應按標示量加入所附滅菌注射用水,復溶後進行以下各項檢定。
3.5.4.1 3.4.1 鑑別試驗
3.5.4.2 3.4.2 外觀
應爲白色疏鬆體,復溶後應爲無色澄明液體,無異物。
3.5.4.3 3.4.3 水分
應不高於3.0%(2010年版藥典三部附錄Ⅶ D)。
3.5.4.4 3.4.4 遊離甲醛含量
應不高於10μg/ml(2010年版藥典三部附錄Ⅵ L)。
3.5.4.5 3.4.5 效價測定
採用免疫小鼠中和抗體測定法,以蝕斑減少中和試驗測定中和抗體。參考疫苗(RA和RB)以及中和試驗陽性血清由國家藥品檢定機構提供。
將被檢疫苗(T)稀釋成1:32,參考疫苗(R)按要求的稀釋度稀釋,分別腹腔免疫體重爲12~14g小鼠10只,每隻0.5ml,免疫2次,間隔7天。第2次免疫後第7天採血,分離血清,同組小鼠血清等量混合,於56℃滅能30分鐘。稀釋陽性血清、被檢疫苗血清和參考疫苗血清,分別與稀釋病毒(約200PFU/0.4ml)等量混合,同時將稀釋後的病毒液與正常小鼠血清等量混合.作爲病毒對照,置37℃水浴90分鐘,接種6孔細胞培養板BHK21細胞,每孔0.4ml,置37℃培養90分鐘,加入含甲基纖維素的培養基覆蓋物,於37℃,5%二氧化碳孵箱中培養5天,染色,蝕斑計數,計算被檢疫苗和參考疫苗組對病毒對照組的蝕斑減少率。病毒對照組的蝕斑平均數應在50~150之間。

式中S爲被檢疫苗平均斑數;
CV爲病毒對照組平均斑數。

Y爲被檢疫苗的蝕斑減少數;
X爲蝕斑中和試驗時所用的血清稀釋倍數。
結果判定:
(1)合格:
(2)重試: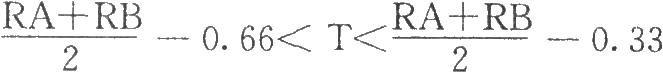
(3)不合格: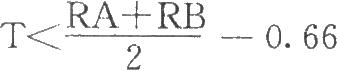
3.5.4.6 3.4.6 熱穩定性試驗
疫苗出廠前應進行熱穩定性試驗,於37℃放置7天,按3.4.5項進行效價測定,仍應合格。如合格,視爲效價測定合格。
3.5.4.7 3.4.7 牛血清白蛋白殘留量
應不高於50ng/劑(2010年版藥典三部附錄Ⅷ I)。
3.5.4.8 3.4.8 抗生素殘留量
生產過程中加入抗生素的應進行該項檢查。採用酶聯免疫法,應不高於50ng/劑。
3.5.4.9 3.4.9 Vero細胞DNA殘留量
應不高於100pg/劑(2010年版藥典三部附錄Ⅸ B第一法)。
3.5.4.10 3.4.10 Vero細胞蛋白質殘留量
採用酶聯免疫法,應不高於2μg/ml。
3.5.4.11 3.4.11 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.4.12 3.4.12 異常毒性檢查
依法檢查(2010年版藥典三部附錄Ⅻ F),應符合規定。
3.5.4.13 3.4.13 細菌內毒素檢查
應不高於50EU/ml(2010年版藥典三部附錄Ⅻ E凝膠限度試驗)。
3.6 4 保存、運輸及有效期
3.7 5 疫苗稀釋劑
3.7.1 5.1 裝量
3.7.2 5.2 包裝
3.7.3 5.3 執行標準
3.7.4 5.4 生產企業
3.7.5 5.5 有效期
3.8 6 使用說明
【藥品名稱】
通用名稱:凍幹乙型腦炎滅活疫苗(Vero細胞)
英文名稱:Japanese Encephalitis Vaccine (Vero Cell),Inactivated, Freeze-dried
漢語拼音:Donggan Yixing Naoyan Miehuoyimiao(Vero Xibao)
【成分和性狀】
本品系用乙型腦炎病毒接種Vero細胞,經培養、收穫、滅活病毒、濃縮、純化後,加入適宜穩定劑凍乾製成。爲白色疏鬆體,復溶後爲澄明液體。有效成分:滅活的乙型腦炎病毒P3株。
【接種對象】
【作用與用途】
接種本疫苗後,可刺激機體產生抗乙型腦炎病毒的免疫力。用於預防流行性乙型腦炎。
【規格】
復溶後每瓶爲0.5ml。每1次人用劑量爲0.5ml。
(1)按標示量加入所附滅菌注射用水,待疫苗復溶並搖勻後使用。
(2)於上臂外側三角肌下緣附着處皮下注射。
(3)基礎免疫應注射兩針,初免後第7天注射第2針,基礎免疫後1個月至1年內加強免疫1次。可根據當地流行情況在基礎免疫後的3~4年再加強1次。每次注射1劑。
【不良反應】
常見不良反應:
一般接種疫苗後24小時內,可出現一過性發熱反應。其中大多數爲輕度發熱反應,一般持續1~2天后可自行緩解,不需處理,必要時適當休息,多喝開水,注意保暖,防止繼發感染;對於中度發熱反應或發熱時間超過48小時者,可採用物理方法或藥物對症處理。
罕見不良反應:
極罕見不良反應:
(1)過敏性皮疹:一般接種疫苗後72小時內出現蕁麻疹,出現反應時,應及時就診,給予抗過敏治療。
(2)過敏性休克:一般接種疫苗後1小時內發生。應及時注射腎上腺素等搶救措施進行治療。
(3)過敏性紫癜:出現過敏性紫癜反應時應及時就診,可用皮質固醇類藥物給予抗過敏治療,治療不當或不及時有可能併發紫癜性腎炎。
【禁忌】
(1)已知對該疫苗所含的任何成分,包括輔料、甲醛以及抗生素過敏者。
(2)患急性疾病、嚴重慢性疾病、慢性疾病的急性發作期和發熱者。
(3)妊娠期婦女。
【注意事項】
(1)以下情況者慎用:家族和個人有驚厥史者、患慢性疾病者、有癲癇史者、過敏體質者。
(2)疫苗瓶有裂紋、標籤不清或失效者、疫苗復溶後出現渾濁等外觀異常者均不得使用。
(3)疫苗開啓後應立即使用。
(4)注射免疫球蛋白者應至少間隔1個月以上接種本品,以免影響免疫效果。
(5)應備有腎上腺素等藥物,以備偶有發生嚴重過敏反應時急救用。接受注射者在注射後應在現場觀察至少30分鐘。
(6)嚴禁凍結。
【貯藏】
於2~8℃避光保存和運輸。
【包裝】
按批准的執行。
【有效期】
24個月。
【執行標準】
【批准文號】
【生產企業】
企業名稱:
生產地址:
郵政編碼:
電話號碼:
傳真號碼:
網 址:
3.9 版本
《中華人民共和國藥典》2010年版