2 註解
電負性是原子在分子中吸引成鍵電子能力相對大小的量度。元素電負性的值是個相對的量,它沒有單位。電負性大的元素吸引電子能力強,反之就弱。同週期主族元素電負性從左到右逐漸增大,同主族元素的電負性從上到下逐漸減小。元素電負性的概念最先是由鮑林(Linns Pauling,1901—1994)於1932年在研究化學鍵性質時提出來的。他指定電負性最大的氟的值爲4.O,然後根據鍵能推算其他元素的相對電負性的數值。後來又有人作了更精確的計算,對鮑林的電負性值作了修改。1934年,馬利肯(Robert Sanderson Mulliken,1896—)採用電離能(I)和電子親和勢(EA)結合的方法求出電負性。1957年,阿萊-羅周(Allred-Rochow)又根據原子的有效核電荷(z*)對成鍵電子的靜電引力算出一套電負性數據XAR。他們所用公式是XAR=0.359z*/r2 0.744,式中r是原子的共價半徑(10-10米)。元素的原子在不同分子中的價態、所帶電荷量以及相應軌道雜化方式等因素都會影響原子吸引電子的能力,因此每一元素的電負性實際表現不是一成不變的。根據元素電負性大小可以判別化合物分子中鍵的性質。兩種元素的電負性差值(XA—XB)越大,形成鍵的極性越強。鮑林曾對A—B鍵的離子性大小提出如下經驗方程式。
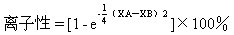 ?xml:namespace prefix = o ns = "urn:schemas-microsoft-com:office:office" /
?xml:namespace prefix = o ns = "urn:schemas-microsoft-com:office:office" /
當鍵的離子性爲5O%時,相當於兩元素電負性差值XA—XB=1.665。因此,習慣上就以電負性差值△X大於或小於1.7,作爲判斷該A—B鍵的離子性或共價性的依據。當△x>1.7時,多數屬於離子鍵;當△x<1.7時,多數屬於共價鍵。離子鍵和共價鍵沒有嚴格的界限。