1 拼音
W S / T 4 7 8 — 2 0 1 5 xuè qīng 2 5 - qiǎng jī wéi shēng sù D 3 jiǎn cè cāo zuò zhǐ nán tóng wèi sù xī shì yè xiāng sè pǔ chuàn lián zhì pǔ fǎ
2 英文參考
Operating guidelines for measurement of serum 25-hydroxyvitamin D3-Isotope dilution liquid chromatography tandem mass spectrometry
3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 478—2015《血清25-羥基維生素D3檢測操作指南 同位素稀釋液相色譜串聯質譜法》(Operating guidelines for measurement of serum 25-hydroxyvitamin D3-Isotope dilution liquid chromatography tandem mass spectrometry)由中華人民共和國國家衛生和計劃生育委員會於2015年11月06日《關於發佈〈D-二聚體定量檢測〉等2項推薦性衛生行業標準的通告》(國衛通〔2015〕15號)發佈,自2016年05月01日起實施。
4 發佈通知
關於發佈《D-二聚體定量檢測》等2項推薦性衛生行業標準的通告
國衛通〔2015〕15號
現發佈《D-二聚體定量檢測》等2項推薦性衛生行業標準,其編號和名稱如下:
WS/T 478—2015 血清25-羥基維生素D3檢測操作指南
上述標準自2016年 5月1日起施行。
特此通告。
國家衛生計生委
2015年11月6日
5 前言
本標準按照GB/T 1.1—2009給出的規則起草。
本標準起草單位:首都醫科大學附屬北京世紀壇醫院、中國醫學科學院北京協和醫院、北京醫院。
本標準主要起草人:張曼、周慧、邱玲、韓建華、張傳寶、張江濤。
6 標準正文
6.1 1 範圍
本標準規定了血清25-羥基維生素D3檢測的常規方法同位素稀釋液相色譜串聯質譜法的技術要求,包括試劑配製、樣本製備、儀器檢測、數據分析等內容。
本標準適用於常規實驗室利用同位素稀釋液相色譜串聯質譜法檢測血清25-羥基維生素D3。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
內標 internal standard
在定量分析時,加入到試樣中能與所有組分完全分離的已知量的純的化合物。
3.2
檢出限 limit of detection
由給定測量程序獲得的測得值,其聲稱的物質成分不存在的誤判概率爲β,聲稱物質成分存在的誤判概率爲α。
注1:國際理論和應用化學聯合會(IUPAC)推薦α和β的默認值爲0.05。
注2:有時使用縮寫詞LOD。
[JJF 1001—2011,定義7.18]
3.3
線性 linearity
在給定的測量範圍內,使測定結果與樣本中分析物的量直接成比例的能力。此處的測定結果指最終的分析結果,而非儀器輸出的原始信號。
[WS/T 408—2012,定義2.2]
3.4
線性範圍 linear range
使實驗系統的最終分析結果爲可接受的線性的濃度範圍,此時非線性誤差應低於允許誤差。
[WS/T 408—2012,定義2.3]
3.5
基質效應 matrix effect
[WS/T 356—2011,定義2.2]
6.4 4 符號與縮略語
下列符號與縮略語適用於本文件。
25(OH)VD3:25-羥基維生素D3( 25-Hydroxyvitamin D3)
BSA:牛血清白蛋白(bovine serum albumin)
CV:變異係數(coefficient of variation)
LOD:檢出限(limit of detection)
MRM:多反應監測(multiple reaction monitor)
SNR:信噪比(signal to noise ratio)
6.5 5 檢測原理和方法
本標準建立的25(OH)VD3檢測方法以同位素稀釋液相色譜串聯質譜法爲檢測原理。方法是以穩定同位素標記的25(OH)VD3爲內標添加至血清中,內標與血清均勻混合後,用液液萃取等方法提取血清中25(OH)VD3。加入飽和硫酸鋅溶液和乙腈沉澱蛋白,加入正己烷並提取上清液,氮氣吹乾後,經75%甲醇溶液溶解。利用液相色譜串聯質譜分離並檢測血清25(OH)VD3和內標特異的離子轉變。用25(OH)VD3和內標峯面積比計算血清25(OH)VD3濃度。
6.6 6 試劑和配製
6.6.1 6.1 試劑
可選用的試劑如下:
a) 水:除非有特別說明,應使用GB/T 6682定義的一級實驗用水;
b) 甲醇:色譜純;
e) 甲酸:色譜純;
f) 硫酸鋅七水合物(ZnSO4·7H2O):分析純,CAS號:7446-20-0;
g) 四氘代甲醇(d4-甲醇):純度≥99.9%,CAS號:811-98-3;
h) 磷酸氫二鈉七水合物( Na2HPO4·7H2O):分析純,CAS號:7782-85-6;
i) 磷酸二氫鈉一水合物(Na2HPO4·H2O):分析純,CAS號:10049-21-5;
k) 牛血清白蛋白(BSA):純度≥98%,Mr=66 kDa,CAS號:9048-46-8;
6.6.2 6.2 配製溶液
6.6.2.1 6.2.1 空白基質溶液
模擬人血清基質的條件,選擇適當離子強度、適當pH及蛋白成分的物質進行配製,儘量模擬人血清基質的環境。如獲得人血清純化後無25(OH)VD3的空白基質,則更佳。適用時,可採用下述方法進行:
a) 稱量2.140 g磷酸氫二鈉七水化合物(Na2HPO4·7H2O),0.268 g磷酸二氫鈉一水化合物(NaH2PO4·H20),0.900 g氯化鈉,5.000 g牛血清白蛋白;
b) 溶解於約75 mL水中;
d) 轉移到100 mL容量瓶中;
e) 加水定容至規定刻度。
6.6.2.2 6.2.2 飽和硫酸鋅溶液
適用時,可採用下述方法進行配製:
a) 稱量9.50 g硫酸鋅七水化合物(ZnSO4·7H2O);
b)加入10 mL水;
c) 充分混勻5 min;d)靜置1 min;
e) 再次混勻2 min以上,至無大塊顆粒不溶物爲止。
最終配製的溶液中硫酸鋅七水化合物(ZnSO4·7H2O)濃度爲0.2 mol/L。該溶液2℃~8℃穩定性爲1個月。
6.6.2.3 6.2.3 75%甲醇溶液
適用時,可採用下述方法進行配製:
a) 移取30 mL甲醇;
b) 加入10 mL水;
c) 混勻後,加入40 μL甲酸;
d)充分混勻。
6.6.2.4 6.2.4 流動相A
適用時,可採用甲酸水溶液,含0.1%甲酸的水溶液的配製方法爲移取300 mL水,加入300μL甲酸。流動相宜每日新鮮配製,可根據使用量適當調整。
6.6.2.5 6.2.5 流動相B
適用時,可採用甲酸甲醇溶液。含0.1%甲酸的甲醇溶液的配製方法爲移取300 mL甲醇,加入300μL甲酸。甲醇爲易揮發溶劑,宜根據每日使用量進行配製。
6.7 7 儀器
6.7.1 7.1 液相色譜串聯質譜聯用系統
液相色譜串聯質譜聯用系統應滿足以下使用要求:
a) 高效液相色譜儀;
b) 三重四級杆串聯質譜儀,配有穩定的源,如電噴霧離子源(ESI),質量校正合格,各項參數指標符合正常工作的要求。
6.7.2 7.2 液相色譜柱
液相色譜柱應滿足使用以下要求:
a) 反相C18色譜柱,具有良好穩定性和重現性;b) 規格內徑和理論塔板數滿足使用要求。
6.7.3 7.3 天平
萬分之一天平(最小分度0.1 mg),應校準合格並在強制檢定週期內。
十萬分之一天平(最小分度0.01 mg),應校準合格並在強制檢定週期內。
6.7.4 7.4 容量瓶
精度爲標稱容量±O.10 mL。
6.7.5 7.5 離心機
6.7.6 7.6 旋渦式混合器
6.7.7 7.7 吹乾裝置
可連接氮氣源的吹乾裝置。
6.7.8 7.8 微量移液器
經校準合格的微量移液器,規格1000 μL、200μL和20μL移液器各一支。
6.7.9 7.9 離心管
適用時,可選用規格1.5 mL,離心管材質中無可經有機溶劑萃取出的雜質。
6.8 8 樣本
6.8.1 8.1 通則
本方法適用於新鮮、冰凍或凍幹血清樣本的25(OH)VD3濃度檢測。
在處理樣本時,應嚴格遵從對潛在生物傳染性樣本處理的相關規定,使用時遵循生物安全規則,並根據規定對廢物進行處理。
6.8.2 8.2 樣本用量
最小取樣量不宜低於0.15 mL。
6.8.3 8.3 樣本的保存
新鮮血清樣本若不立即檢測,應於2℃~8℃避光保存,保存時間不超過1周。-20℃及以下避光可穩定保存至少3個月。使用前應在室溫下避光將血清融化、充分混勻。凍幹樣本應按照介紹描述的使用期限和條件保存,臨用前按照說明覆融重組,充分混勻。
6.9 9 檢測系統和分析部分的準備
6.9.1 9.1 液相色譜串聯質譜聯用系統的準備
6.9.1.1 9.1.1 質譜系統部分的準備
c) 真空度達到正常工作要求的範圍,所需輔助氣體純度符合要求、供應充足、氣路通暢。
6.9.1.2 9.1.2 液相系統部分準備
a) 流動相準備:按照6.2.4,6.2.5準備流動相A,流動相B,超聲10 min~15 min;
b)色譜柱的平衡:用合適的流動相比例(例如A:B體積比20:80)平衡色譜柱一定時間,直至色譜柱壓力達到平衡。
6.9.2 9.2 標準溶液和內標溶液的準備
6.9.2.1 9.2.1 標準品
6.9.2.1.1 9.2.1.125(OH)VD3標準品
純度≥99%。
6.9.2.1.2 9.2.1.2 同位素標記物質
應使用穩定同位素標記的25(OH)VD3爲內標,標記的穩定同位素個數應不低於3個。內標的使用、保存及使用期限應符合生產廠商提供的產品證書或使用說明書。
6.9.2.2 9.2.2 標準溶液及內標溶液的製備
a) 稱取25(OH)VD3標準品1.00 mg;
c) 充分混勻。
9.2.2.2 1 mg/mL內標儲備液
配製方法如下:
a) 稱取同位素標記的25(OH)VD31.00 mg;
c) 充分混勻1 min。
9.2.2.3 內標工作液配製方法如下:
a) 取0.010 mL已製備的1 mg/mL內標儲備液,加入0.990 mL甲醇,配成濃度爲10 μg/mL的基礎工作液;
b)取0.100 mL已製備的10 μg/mL基礎工作液,加入0.900 mL甲醇,配成濃度爲1μg/mL的內標工作液。
a) 取0.010 mL已製備的2 mg/mL標準品儲備液,加入0.990 mL甲醇,充分混勻,得到濃度爲20 μg/mL的標準品基礎工作液1;
b)取0.100 mL標準品基礎工作液1,加入0.900 mL甲醇,充分混勻,得到濃度爲2μg/mL的標準品基礎工作液2;
c) 將標準品基礎工作液2按照1:2:2:2:2:1.25:2:5配製標準品基礎工作液3~9,溶劑爲甲醇。分別得到濃度爲1 μg/mL,0.5 μg/mL,0.25μg/mL,0.125μg/mL,O.1μg/mL,0.05μg/mL,0.01 μg/mL的標準品基礎工作液。
a) 分別取不同濃度的標準品基礎T作液2~9各0.100 mL;
c) 充分混勻,得到濃度分別爲0.2 μg/mL,0.1μg/mL,0.05 μg/mL,0.025 μg/mL,0.0125μg/mL,0.01μg/mL,0.005μg/mL,0.001μg/mL的標準品T作液。
9.3 樣本前處理(包括標準品工作液和待測血清樣本)樣本前處理方法如下:
a) 移取血清樣本或標準品T作液0.150 mL,加入0.015 mL內標T作液(濃度爲1μg/mL),充分混勻;
c) 加入乙腈0.300 mL;
d) 劇烈震盪30 s,室溫(22℃~28℃)靜置15 min;
e) 加入正己烷0.750 mL;
f) 劇烈震盪30 s;
h) 可見樣本分爲三層,取最上層有機層0.500 mL於另一離心管中,注意不要觸及中間的水層;
i) 室溫下氮氣吹乾;
j) 加入75%甲醇溶液0.200 mL;k)充分混勻30 s。
6.9.3 9.4 檢測方法
6.9.3.1 9.4.1 液相色譜條件
6.9.3.1.1 9.4.1.1 液相色譜儀器條件
使用者可以實現目標物與基質干擾物的充分分離,以及實現目標物與其他分析物有效分離並獲得良好峯型爲原則進行條件優化,包括:
a) 色譜柱:見7.2;
b) 流動相:見9.1.2;
c) 流速:0.5 mL/min;
d) 進樣量:0.010 mL;
e) 柱溫:50℃。
6.9.3.1.2 9.4.1.2 液相色譜洗脫條件
使用者可根據實驗需要進行條件優化,見表1。
表1 液相色譜洗脫條件
時間 min | 流動相A % | 流動相B / |
0 | 20 | 80 |
2.3 | 20 | 80 |
2.4 | 2 | 98 |
3.9 | 2 | 98 |
4 | 20 | 80 |
6.9.3.2 9.4.2 質譜條件
使用者可以有效提高離子化效率爲原則,優化離子源的類型、溫度,以及霧化器、乾燥器溫度和流量等參數;以有效提高離子傳輸效率爲原則,優化錐孔電壓,碰撞能量等參數,進而實現提高檢測靈敏度的目的,合理選擇反應模式,進行條件優化,見表2。
表2 串聯質譜檢測條件
源 | 反應模式 | 霧化器壓力 kPa(psi) | 乾燥器 | 母離子 m/z | 子離子 m /z | 錐孔電壓 V | 碰撞能量 eV | 駐留時間 | ||
ESI | 345(50) | 溫度 ℃ | 流速 L/min | 25(OH)VD3 | 401.3 | 383.2a | 106 | 4 | 0.1 | |
159.1 | 106 | 24 | 0.1 | |||||||
275 | 10 | 同位素標記25(OH)VD3 | 404.4 | 386.3 | 106 | 4 | 0.1 | |||
a離子用於定量。 | ||||||||||
6.9.3.3 9.4.3 液相色譜串聯質譜檢測
按照以下步驟進行液相色譜串聯質譜檢測:
a) 按照9.3方法對標準品T作液和待測血清樣本進行前處理,按照9.4.1~9.4.2條件進行液相色譜串聯質譜參數設置和優化;
b) 標準品工作液經前處理後,按照濃度由低到高順序進行液相色譜串聯質譜分析;
6.9.3.4 9.4.4 結果計算
6.9.3.4.1 9.4.4.1 保留時間
25(OH)VD3在液相色譜中保留時間可依使用的色譜柱性能不同而有差異,建議與標準品溶液保留時間差值小於0.1 min。
6.9.3.4.2 9.4.4.2 工作曲線的建立
9.4.4.2.1 直線擬合
對25(OH)VD3和同位素標記25(OH) VD3按表2分別提取MRM離子色譜圖,積分得各自的峯面積。以標準品定量離子峯面積與內標峯面積的比值爲縱座標,以標準品濃度與內標物濃度的比值爲橫座標進行直線擬合,按式(1)得到工作曲線參數a,b值。
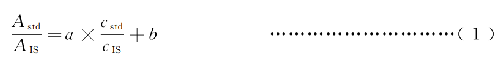
![]()
式中:
Astd——標準品T作液中25(OH)VD3定量離子MRM積分峯面積;
cstd——標準品工作液中25(OH)VD3的濃度;
cIS——標準品工作液中內標物的濃度,本方案中此濃度爲1μg/mL;
α——擬合直線的斜率;
b——擬合直線的截距。
直線擬合的相關係數R2>0.99。
9.4.4.2.2 建立工作曲線
將9.4.4.2.1中擬合得到的參數a,b帶人式(2),得到工作曲線。

式中: Atarget——血清樣本中25(OH)VD3定量離子MRM積分峯面積;
cIS——血清樣本中內標物的濃度,本方案中此濃度爲1 μg/mL;
a——按照9.4.4.2.1中擬合得到的直線斜率;
b——按照9.4.4.2.1擬合得到的直線截距。
對血清樣本中25(OH)VD3和同位素標記25(OH)VD3按照表2分別提取MRM離子色譜圖,積分得各白的峯面積。根據9.4.4.2.2得到的T作曲線,可計算得到式(2)中ctarget值,即血清樣本中25(OH)VD3的濃度。
6.10 10 方法的評價
6.10.1 10.1 說明
實驗條件優化後,需對方法進行多方面評價,例如精密度,正確度,線性,LOD,基質效應等。
6.10.2 10.2 精密度評價
依據臨牀實驗室標準化委員會( Clinical and Laboratory Standards Institute,CLSI)公佈或者已發佈的行業標準等規範性文件,對方法的精密度進行評價,見表3。
表3 精密度評價結果
6.10.3 10.3 正確度評價
適用時,可利用有證標準物質或者其他規範性文件方案進行評價,正確度評價結果在靶值±5%範圍內。
6.10.4 10.4 線性評價
依據CLSI公佈或者已發佈的行業標準等規範性文件,對方法的線性進行評價:
檢測血清樣本的線性範圍10.16 ng/mL~70.54 ng/mL。如收集到足量的更低濃度血清樣本,經驗證後,可擴大線性範圍的低限;如獲得加入純物質的更高值人血清,經驗證後,可擴大線性範圍的高限。
注:受標本本身濃度限制,高值血清爲人血清加入純物質獲得,低值血清爲收集人血清。
6.10.5 10.5 LOD
按照SNR≥3的最低濃度計算,例如檢出限爲0.5 ng/mL。
6.10.6 10.6 基質效應
依據行業內或專業領域認可的規範性文件,評價不同濃度時的基質效應:
7 參考文獻
[1] Susan S.-C.Tai, Mary Bedner, Karen W. Phinney. Development of a Candidate ReferenceMeasurement Procedure for the Determination of 25-Hydroxyvitamin D3 and 25-Hydroxyvitamin D2 inHuman Serum Using Isotope-Dilution Liquid Chromatography-Tandem Mass Spectrometry. Anal.Chem.2010,82,1942-1948.
[2] Stepman HC, Vanderroost A, van Uytfanghe K, et al. Candidate reference measurementprocedures for serum 25-hydroxyvitamin D3 and 25-hydroxyvitamin D2 by using isotope-dilution liquidchromatography-tandem mass spectrometry[J].Clin Chem,2011,57(3):441-448.