基本信息
《膀胱癌診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
1.原發性肺癌診療指南(2022年版)
2.膀胱癌診療指南(2022年版)
3.胃癌診療指南(2022年版)
4.食管癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
9.宮頸癌診療指南(2022年版)
10.卵巢癌診療指南(2022年版)
11.前列腺癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
14.淋巴瘤診療指南(2022年版)
15.黑色素瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
21.自身免疫性溶血性貧血診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
診療指南全文
膀胱癌診療指南(2022 年版)
一、概述
膀胱癌是泌尿系統最常見的惡性腫瘤之一。世界範圍內,膀胱癌發病率位居惡性腫瘤的第9 位,男性惡性腫瘤的第7位(9.5/10 萬),女性爲 10 位以後(2.410/10 萬);死亡率居惡性腫瘤的第 13 位,男性死亡率爲(3.2/10 萬),女性爲(0.9/10萬)。
膀胱癌存在地域、種族及性別的差異。各年齡段均可發病,高發年齡 50~70 歲,男性發病率爲女性的3~4 倍。根據 2019 年全國腫瘤登記中心發佈的數據:2015年我國膀胱癌發病率爲 5.80/10 萬,位居全身惡性腫瘤的第13位,男性發病率爲 8.83/10 萬,位居第7 位。女性發病率爲2.61/10萬,位居第 17 位。2015 年我國膀胱癌死亡率爲2.37/10萬,位居第 13 位,男性死亡率爲 3.56/10 萬,位居第11 位。女性死亡率爲 1.11/10 萬,位居第 16 位。
城市地區各年齡段膀胱癌發病率及死亡率均高於農村地區。2015 年城市地區膀胱癌發病率爲6.77/10 萬(男性10.36/10萬;女性 3.04/10 萬),農村地區發病率爲4.55/10 萬(男性6.89/10 萬;女性 2.06/10 萬)。2015 年城市地區膀胱癌死亡率爲2.69/10 萬(男性 4.01/10 萬;女性1.31/10 萬),農村地區死亡率爲 1.95/10 萬(男性 3.00/10 萬;女性0.85/10 萬)。相同分期的膀胱癌患者,男性預後優於女性患者。
膀胱癌是嚴重威脅人民健康的惡性腫瘤之一,規範化診斷及治療對提高我國膀胱癌的診療水平具有重要意義。
二、篩查和診斷
(一)膀胱癌的危險因素。
膀胱癌的發生發展是複雜、多因素、多步驟的病理變化過程,其具體發病機制尚未闡明,內在的遺傳因素與外在環境因素均有重要作用。
1.外在因素
吸菸和長期接觸工業化學產品是兩大外在致病危險因素,是目前最爲肯定的膀胱癌致病危險因素,約50%的膀胱癌患者有吸菸史,吸菸者膀胱癌的患病風險增加2~3 倍,風險率與吸菸強度和時間成正比。與煙中含有的芳香胺類化合物4-氨基聯苯有關係。吸菸對膀胱癌的復發及進展的影響尚不明確。
長期職業接觸工業化學產品是另一類重要的危險因素。約20%的膀胱癌患者發病與所從事的職業有關,如紡織、染料製造、橡膠化學、藥物製劑和殺蟲劑生產、油漆、皮革及鋁和鋼鐵生產領域,此類人羣長期接觸芳香胺類化合物、多環芳烴和氯代烴、β-萘胺、4-氨基聯苯等。
其他致病因素包括:膀胱內長期慢性炎症刺激(細菌、血吸蟲、人乳頭狀瘤病毒感染等)、長期異物刺激(留置導尿管、結石)與膀胱鱗狀細胞癌和腺癌關係密切。既往接受過環磷酰胺化療、濫用非那西汀及盆腔放療病史,治療糖尿病藥物吡格列酮等均能增加患膀胱癌的風險。大量攝入脂肪、膽固醇、油煎食物和紅肉、長期飲用砷含量高的水和氯消毒水、咖啡、人造甜味劑及染髮可能增加膀胱癌的患病危險。
2.內在因素(基因異常)
膀胱癌的發生發展與遺傳及基因異常有關,有家族史者發生膀胱癌的危險性明顯增加 2 倍,具體機制尚需進一步研究。
正常膀胱細胞惡變始於細胞的DNA 改變,化學致癌物質是膀胱癌的主要外在致病因素,包括芳香類化合物如2-萘胺、4-氨基聯苯等,存在於菸草及各種化工製品中,上述致癌物代謝後進入尿液,導致膀胱上皮細胞惡變。
與膀胱癌有關的癌基因包括HER-2、HRAS、BCL-2、FGFR3、C-myc、MDM2、MSH2 等。另一種分子機制是編碼調節細胞生長、DNA 修復或凋亡的蛋白抑制基因失活,使DNA受損的細胞不發生凋亡,導致細胞生長失控。如P53、RB、P21 等抑癌基因的 17、13 及 9 號染色體的缺失或雜合性丟失與膀胱癌的發生有關係。
尿路上皮腫瘤具有時間和空間的多中心性,上尿路尿路癌病史是膀胱尿路上皮癌的重要危險因素,此類患者出現膀胱癌的風險約 15%~50% 。
(二)臨牀表現。
依據患者病史、症狀及體徵,結合實驗室檢查、影像學檢查、尿細胞學及尿腫瘤標記物檢查、膀胱鏡檢查進行臨牀診斷。膀胱鏡是最重要檢查方法,膀胱鏡下活檢病理學檢查是診斷膀胱癌的金標準。上尿路影像學檢查除外合併腎盂或/和輸尿管腫瘤的可能性。
1.原發腫瘤本身局部生長引起的症狀
血尿是膀胱癌患者最常見的臨牀表現,約80%~90%的患者以間歇性、無痛性全程肉眼血尿爲首發症狀。尿色可呈淡紅色或深褐色不等,多爲洗肉水色,可形成血凝塊。部分患者爲初始血尿,提示膀胱頸部病變;終末血尿,提示病變位於膀胱三角區、膀胱頸部或後尿道。少數患者僅爲鏡下血尿。
血尿嚴重程度、持續時間及出血量與腫瘤惡性程度、分期、大小、數目、形態並不一致。部分患者是體檢或因其他疾病例行檢查時無意中發現膀胱癌。
約有 10%的膀胱癌患者伴有膀胱刺激徵,表現爲尿頻、尿急、尿痛。提示患者可能存在原位癌、肌層浸潤性尿路上皮癌、鱗狀細胞癌或腺癌等。
2.原發腫瘤侵犯鄰近器官、結構引起的症狀
其他症狀包括輸尿管梗阻所致腰部疼痛、下肢水腫、骨痛、尿瀦留、體重減輕等均爲晚期症狀。
(三)體格檢查。
膀胱癌患者一般無臨牀體徵,對早期患者(如Ta、T1期)的診斷價值有限。觸及盆腔腫塊提示爲局部晚期腫瘤。
(四)輔助檢查。
1.實驗室檢查
(1)實驗室一般檢測:
患者在治療前,需要行實驗室常規檢測,以瞭解患者的一般狀況以及是否適於採取相應的治療措施。①血常規;②肝腎功能及其他必要的生化免疫等檢測;③出凝血功能檢測。
(2)尿細胞學及腫瘤標記物檢查:
尿液檢查包括尿脫落細胞學檢查和尿腫瘤標誌物的檢測。
①尿細胞學檢查:尿細胞學檢查是膀胱癌診斷和術後隨訪的重要方法之一,尿液中檢測出癌細胞是腎盂癌、輸尿管癌和膀胱癌定性診斷之一。尿標本應儘量採用新鮮尿液,通過自然排尿收集,也可通過膀胱沖洗以提高診斷率。建議連續留尿3天 ,留取後離心固定。 尿 脫落細胞學檢查的敏感性爲13%~75%,特異性爲 85%~100%。其敏感性與腫瘤分級呈正相關,高級別腫瘤(包括原位癌)陽性率達84%;G1 和低級別腫瘤的敏感性爲 16%。
尿細胞學結果評估受脫落細胞少、尿路感染、結石或膀胱灌注治療等因素影響,特異性超過90%。尿中有可疑癌細胞,需多次檢查覈實,避免假陽性結果。尿細胞學檢查必須與膀胱鏡檢查及影像學檢查同時進行,以降低漏診率。流式細胞分析技術用於尿細胞學檢查,簡便客觀。原理是通過 DNA 特異性熒光劑染色尿中脫落細胞的染色質,通過分析軟件對 DNA 倍體進行分析,客觀反應細胞增殖狀態。腫瘤細胞增殖旺盛,呈多倍體。一般二倍體代表低度惡性、三倍體至四倍體爲高度惡性腫瘤。流式細胞分析技術診斷膀胱癌的敏感性與特異性與腫瘤分化程度及分期有關。但不能替代常規尿細胞學檢查。
②尿液膀胱腫瘤標誌物檢查:目前有多種相對成熟的尿液膀胱腫瘤標誌物檢查技術,包括核基質蛋白22(NMP22)、膀胱腫瘤抗原相關(BTAstat 及 BTAtrak)、免疫-細胞檢查、纖維蛋白原降解產物和尿熒光原位雜交(fluorescenceinsituhybridization,FISH)等。
其他包括:端粒酶、存活素、微衛星分析、細胞角蛋白檢查等,有較高的敏感性,但特異性均低於尿細胞學檢查。FISH 技術具有較高的敏感性及特異性,特異性低於尿細胞學檢查。有膀胱炎症、結石、放療等病史患者的尿液標本特異性低。FISH 技術在我國人羣尿路上皮癌具有較高的陽性預測值。
因尿液腫瘤標誌物檢測的敏感性高但特異性較低,臨牀上尚未廣泛應用,尚無能取代膀胱鏡檢查和尿細胞學檢查的尿腫瘤標誌物。
2.影像學檢查
影像學檢查包括超聲檢查、CT 及CT 尿路造影(computedtomogr aphy urography,CTU)、MRI 及磁共振尿路成像(magnetic resonance urography,MRU)、靜脈尿路造影(intravenous urography,IVU)、胸部X 線攝片或胸部CT等,主要目的是瞭解膀胱病變程度、範圍、胸腹盆腔臟器、腹膜後及盆腔淋巴結及上尿路情況,有助於判斷膀胱癌臨牀分期 。
(1)超聲檢查:
超聲檢查是診斷膀胱癌最常用、最基本的檢查項目。可同時檢查腎臟、輸尿管、前列腺、盆腔和腹膜後淋巴結及其他臟器情況。
超聲檢查可通過經腹、經直腸、經尿道三種途徑進行。經腹超聲檢查診斷膀胱癌的敏感性爲63%~98%,特異性爲99%。可以同時檢查腎臟、輸尿管和腹部其他臟器。經直腸超聲檢查能清楚顯示膀胱三角區、膀胱頸和前列腺,近距離觀察腫瘤基底部,判斷腫瘤浸潤深度優於經腹部超聲檢查,適用於膀胱充盈不佳的患者。
經尿道超聲檢查需在尿道表面麻醉下進行,雖然其影像清晰,判斷腫瘤分期準確性比較高,但屬於有創傷性檢查,未廣泛應用。
彩色多普勒超聲檢查可顯示腫瘤基底部血流信號,但腫瘤血流徵象對腫瘤分期、分級判斷價值有限。超聲造影可提高膀胱癌檢出率及評估膀胱腫瘤侵犯深度。超聲無法準確診斷膀胱原位癌。超聲圖表現:膀胱壁有異常的侷限性突起,不隨體位移動;或膀胱壁表面不規整,膀胱壁層次結構中斷消失;或強回聲或混合回聲結節或腫塊,呈乳頭狀或菜花狀,有蒂或無蒂;腫瘤可單發或多發。彩色多普勒檢查能顯示腫瘤內或邊緣的血流信號。
(2)CT 檢查:
CT 檢查(平掃+增強掃描)在診斷和評估膀胱腫瘤浸潤範圍方面有價值,可以發現較小腫瘤(1~5mm)。若膀胱鏡檢查顯示腫瘤爲寬基無蒂、惡性度高、有肌層浸潤的可能時建議 CT 檢查以判斷腫瘤浸潤範圍、是否鄰近臟器侵犯或遠處轉移。
CT 檢查對膀胱原位癌及輸尿管顯示欠佳;很難準確區分非肌層浸潤膀胱癌(Ta、T1)和 T2~T3a 期膀胱癌,很難確定腫大淋巴結性質。
肌層浸潤性膀胱癌 ( muscle-invasive bladder cancer,MIBC)患者 CT 檢查的準確率爲54.9%,其中約39%分期偏低,6.1% 分期偏高。既往有腫瘤手術史患者因局部炎症反應可導致分期升高。
CTU:建議膀胱多發性腫瘤、高危腫瘤及膀胱三角區腫瘤患者行 CTU 檢查。CTU 能提供上尿路、周圍淋巴結和鄰近器官的狀態等信息,已基本替代傳統IVU 檢查。CT 檢查圖像表現爲膀胱壁局部增厚或向腔內突出的腫塊。腫塊形態多種多樣,常表現爲乳頭狀、菜花狀和不規則形。外緣較光滑,腫瘤向壁外侵犯時可顯示爲膀胱壁外緣毛糙。較大腫塊內緣常見砂粒狀鈣化影,大而表淺的腫瘤可出現膀胱輪廓變形。平掃腫塊 CT 值 30~40HU,增強後呈不均勻明顯強化。腫瘤向壁外生長時,表現爲膀胱輪廓不清楚,膀胱周圍脂肪層消失,並可累及鄰近的組織器官,可顯示盆腔或腹膜後腫大淋巴結。
(3)多參數 MRI:
MRI 檢查具有良好的軟組織分辨率,能診斷及腫瘤分期。MRI 檢查有能顯示腫瘤是否擴散至膀胱周圍脂肪、淋巴結轉移及骨轉移等,可評估鄰近臟器的受侵犯情況。
膀胱腫瘤 T1 加權像與膀胱壁像似的低至中等信號強度,高於低信號的尿液、低於呈高信號的膀胱周圍脂肪。T2加權像尿液呈高信號,正常逼尿肌爲低信號,大多數膀胱腫瘤爲中等信號。低信號的逼尿肌出現中斷現象提示肌肉層浸潤。彌散加權成像(diffusion weighted imaging,DWI)對評估腫瘤是否侵犯周圍組織有價值。
動態增強 MRI 在顯示是否有肌層浸潤方面,準確性高於CT 或非增強 MRI;對<T3a 腫瘤準確率優於CT檢查,對淋巴結的顯示與 CT 相仿。多參數 MRI 檢查在評估膀胱癌肌層是否受侵犯方面有重要價值,其敏感性爲90%~94%,特異性87%~95%。高場強(3.0T)及 DWI 可提高診斷的敏感性及特異性。MRI 評估骨轉移的敏感性高於CT,甚至優於核素骨掃描。
MRU 檢查: MRU 能顯示整個泌尿道,顯示上尿路梗阻部位及原因、是否有上尿路腫瘤等。MRU 特別適用於對比劑過敏或腎功能不全患者、IVU 檢查腎臟不顯影及伴有腎盂輸尿管積水患者。
(4)IVU:
IVU 檢查目的是顯示是否伴有上尿路腫瘤。由於 IVU 檢查診斷上尿路腫瘤的陽性率低,漏診風險高,特別是小的上尿路腫瘤或尿路積水不顯影時更易漏診。CTU、MRU檢查可獲得更清晰的圖像,現已替代IVU 檢查。
(5)X 線攝片或胸部 CT 檢查:
胸部正、側位X線攝片是患者術前和術後常規檢查項目,瞭解有無肺部轉移,判定臨牀分期。
胸部 CT 檢查是肺部轉移更敏感的檢查方法。對肺部有結節或 MIBC 擬行全膀胱切除的患者推薦術前行胸部CT以明確有無肺轉移 。
肺轉移瘤在胸部 X 線片及胸部CT 片上表現爲單個、多發或大量瀰漫分佈的圓形結節性病竈。
(6)全身骨顯像:
全身骨顯像是檢測骨轉移最常用的方法,敏感性高,能評估是否有骨轉移病竈以明確腫瘤分期,比X 線片提前 3~6 個月發現骨轉移病竈。骨掃描不是膀胱癌患者的常規檢查項目,患者出現骨痛或血清鹼性磷酸酶升高,懷疑有骨轉移風險時推薦進行檢查。膀胱癌骨轉移竈爲溶骨性改變,多表現爲異常放射性濃聚,少數表現爲放射性稀疏、缺損。脊柱是骨轉移的常見部位,其次爲盆骨、肋骨、顱骨及股骨、肱骨的近端。骨顯像對骨轉移瘤的特異性不高,尤其是對單發或少發病竈的良惡性鑑別需要 CT 或 MRI 檢查確認。
(7)正電子發射計算機體層成像(positron emissiontomography-computed tomography,PET-CT):
示蹤劑氟脫氧葡萄糖(fluorodeoxyglucose,FDG)經腎臟排泌到膀胱,影響膀胱內較小腫瘤及膀胱周圍區域淋巴結的顯影,費用高,PET-CT檢查一般不作爲常規檢查項目。目前常用的新型示蹤劑包括膽鹼、蛋氨酸、乙酸等。碳-11(11C)-膽鹼和 11C-乙酸不經泌尿系統排泄,能同時顯示膀胱腫瘤及淋巴結轉移。PET-CT 診斷淋巴結轉移的準確性優於CT及MRI,用於 MIBC 患者的術前分期、晚期患者轉移情況及療效評價。PET-CT 尚無法取代 MRI 和骨掃描在骨轉移瘤診斷方面作用。
3.內鏡及其他檢查
(1)膀胱鏡檢查及活檢:
膀胱鏡檢查和活檢是診斷膀胱癌最可靠的方法,也是術後復發監測的主要手段之一。膀胱鏡檢查包括普通硬性膀胱鏡及軟性膀胱鏡檢查,推薦常規行無痛膀胱鏡檢查。如有條件,建議使用軟性膀胱鏡檢查,與硬性膀胱鏡相比,該方法具有損傷小、視野無盲區、相對舒適等優點。
膀胱鏡檢查可以明確膀胱腫瘤的數目、大小、形態(乳頭狀的或廣基的)、部位、生長方式及周圍膀胱黏膜的異常情況,可以對腫瘤和可疑病變進行活檢以明確病理類型。當尿脫落細胞學檢查陽性或膀胱黏膜異常時,建議行選擇性活檢,以明確診斷和了解腫瘤範圍。尿細胞學陽性而膀胱黏膜正常、懷疑存在原位癌時,應考慮行隨機活檢。原位癌、多發性癌或腫瘤位於膀胱三角區或膀胱頸部時,伴發尿道前列腺部癌的危險性增加,建議行前列腺部尿道活檢明確病理。尿細胞陽性或前列腺部尿道黏膜異常時,此部位行活檢。
目前不建議對非肌層浸潤性膀胱癌(non-muscle-invasivebladder cancer,NMIBC)的正常膀胱黏膜進行常規的隨機活檢或選擇性活檢(發現原位癌的可能性低於2%)。膀胱鏡檢查有可能引起泌尿男生殖系統感染、尿道及膀胱出血、尿道損傷和尿道狹窄等併發症。①熒光膀胱鏡: 熒光膀胱鏡檢查是通過向膀胱內灌注光敏劑,如: 5-氨基酮戊酸(5- aminolevulinic acid,ALA)、氨基酮戊酸己酯(hexyl aminolevulinate,HAL)、吡柔比星等,產生的熒光物質能高選擇性積累在新生的膀胱黏膜組織中,在激光激發下病竈部位顯示爲紅色熒光,與正常膀胱黏膜的藍色熒光形成鮮明對比,能發現普通膀胱鏡難以發現的小腫瘤或原位癌,檢出率可提高 14%~25%。
懷疑有膀胱原位癌或尿細胞學檢查陽性而普通膀胱鏡檢查黏膜正常時,建議選擇熒光膀胱鏡檢查。Meta 分析 12 項隨機對照研究,共2258 例NMIBC採用熒光膀胱鏡引導下手術,與常規手術相比能顯著降低術後複發率、延長首次復發時間間隔,延長無復發生存時間,提高腫瘤檢出率,但未能顯著降低進展爲MIBC 的風險。熒光膀胱鏡的缺點是診斷膀胱癌的特異性63%,低於普通膀胱鏡(81%)。特異性相對第低與炎症、近期膀胱腫瘤電切術和膀胱灌注治療等導致假陽性有關係。②窄帶成像(narrow band imaging,NBI)膀胱鏡:NBI的原理是通過濾光器過濾掉普通內鏡光源所發出紅、藍、綠中的寬帶光譜,選擇 415nm、540nm 窄帶光。與傳統白光模式內鏡相比,顯示膀胱黏膜表面微細結構和黏膜下血管更清晰、立體感更強,有助於早期發現與診斷微小病竈,提高膀胱原位癌的檢出率,降低術後複發率。
NBI 膀胱鏡對膀胱原位癌診斷的敏感度、特異度和準確率均優於普通膀胱鏡。只能通過 NBI 膀胱鏡發現而普通膀胱鏡未發現的腫瘤佔 17.1%,42%尿細胞學陽性而普通膀胱鏡檢陰性患者通過 NBI 膀胱鏡檢查發現膀胱腫瘤。與白光下電切術相比,NBI 引導下膀胱腫瘤電切術能降低NMIBC 患者術後複發率。
(2)診斷性經尿道膀胱腫瘤切除術(transurethral resectionof bladder tumours,TURBt):
如果影像學檢查發現膀胱內有腫瘤樣病變,可以省略膀胱鏡檢查,直接行診斷性TURBt。目的:一是切除腫瘤;二是明確腫瘤的病理診斷和分級、分期,電切標本基底部應包括膀胱壁肌層。
(3)輸尿管鏡檢查:
對膀胱癌有可疑上尿路病變的患者,CTU 或 MRU 檢查仍無法明確診斷患者,可選擇輸尿管鏡檢查及活檢明確診斷。
4.膀胱癌臨牀診斷方法推薦意見:見表1。
表 1:膀胱癌臨牀診斷方法推薦意見:
| 膀胱癌臨牀診斷方法推薦意見: | 推薦等級 |
| 病史、症狀、體徵、超聲、CT 及 MRI 檢查 | 強烈推薦 |
| 可疑患者行膀胱鏡檢查、病理活檢或診斷性 TURBt | 強烈推薦 |
| 可疑原位癌,尿細胞學陽性而黏膜正常考慮隨機活檢 | 可選擇 |
| 可疑原位癌可選擇熒光膀胱鏡或 NBI 膀胱鏡檢查 | 推薦 |
| MIBC 可疑骨轉移者可選擇骨掃描 | 推薦 |
| 尿細胞學檢查用於可疑患者輔助檢查及術後隨訪 | 推薦 |
| FISH 檢查用於無法耐受膀胱鏡及尿有不典型細胞 | 推薦 |
(五)鑑別診斷。
泌尿及男性生殖系統疾病中,血尿是常見的臨牀症狀之一。膀胱癌引起的血尿需要與泌尿系統結石、炎症、結核、畸形、外傷、前列腺增生、腎小球疾病等患者相鑑別。需要與其他腫瘤如臍尿管癌、前列腺癌及盆腔腫瘤、宮頸癌、結直腸癌侵犯膀胱、膀胱良性病變如腺性膀胱炎等疾病鑑別。
1.臍尿管癌
膀胱頂部區域的腫瘤需與臍尿管癌鑑別。臍尿管癌源自臍尿管殘跡,腫瘤主體位於膀胱壁外或膀胱壁中,若腫瘤向內侵透膀胱壁至膀胱腔內,會分泌黏液,導致尿液中出現黏液樣物質。
通過膀胱鏡檢查及活檢病理檢查以及盆腔影像學檢查進行鑑別診斷。膀胱鏡下可見膀胱頂部廣基腫物,表面黏膜完整或破潰。影像學檢查提示腫瘤的主體位於膀胱壁外側。
2.前列腺癌侵犯膀胱或前列腺增生
患者多有排尿困難症狀,超聲檢查、MRI 或CT掃描時可能誤認爲膀胱三角區腫瘤。血清前列腺特異抗原、直腸指診、MRI 檢查有助於鑑別診斷,膀胱鏡檢查能明確腫瘤來源。
3.盆腔其他臟器腫瘤侵犯膀胱
常見包括宮頸癌、結直腸癌侵犯膀胱。患者有原發疾病症狀或體徵。依靠病史、影像學檢查或腸鏡檢查等鑑別。
4.腺性膀胱炎
患者多以尿頻、尿急或無痛性血尿就診,影像學檢查顯示膀胱近頸部可見大片腫物。膀胱鏡:病變主要位於三角區及膀胱頸部,輸尿管管口看不清。病變形態呈多樣性多中心性,常呈濾泡樣、乳頭樣、分葉狀,腫物近透明狀,內無血管;需活檢明確病理。
5.內翻性乳頭狀瘤
多爲三角區及其周邊的單發腫瘤,多有細長蒂,表面黏膜光整。
三、病理組織學檢查和分期
(一)組織學類型。
目前,推薦採用 2004 年 WHO 尿路系統腫瘤分類標準。膀胱癌包括尿路上皮(移行細胞)癌、鱗狀細胞癌和腺細胞癌、臍尿管癌、苗勒氏管惡性腫瘤、神經內分泌腫瘤(如小細胞癌)、間葉性腫瘤、混合型癌、肉瘤樣癌及轉移性癌等。其中,膀胱尿路上皮癌最爲常見,佔膀胱癌的90%以上,膀胱鱗狀細胞癌約佔 3%~7% ;膀胱腺癌比例<2%。本指南主要探討膀胱尿路上皮癌的診斷及治療。
2016 年 WHO 對膀胱尿路上皮腫瘤病理類型進行更新,主要分爲兩大類,浸潤性尿路上皮癌和非浸潤性尿路上皮腫瘤。浸潤性尿路上皮癌又分爲不同變異亞型,不同變異亞型與患者預後密切相關。病理醫生除做出主要病理診斷外,還需要判斷是否合併各種變異亞型(表 2)。
表 2 2016 版 WHO 尿路上皮腫瘤病理類型及變異亞型
| 浸潤性尿路上皮腫瘤 | 非浸潤性尿路上皮腫瘤 |
| 浸潤性尿路上皮癌 | 尿路上皮原位癌 |
| 浸潤性尿路上皮癌伴不同分化 | 非浸潤性乳頭狀尿路上皮癌,低級別 |
| 尿路上皮癌伴部分鱗樣分化 | 非浸潤性乳頭狀尿路上皮癌,高級別 |
| 尿路上皮癌伴部分和/或腺樣分化 | 尿路上皮乳頭狀瘤 |
| 尿路上皮癌伴部分滋養層分化 | 低度惡性潛能乳頭狀尿路上皮腫瘤 |
| 尿路上皮癌伴部分 Müllerian 分化 | 內翻性尿路上皮乳頭狀瘤 |
| 浸潤性尿路上皮癌變異亞型 | 惡性潛能未定的尿路上皮增生 |
| 微乳頭型尿路上皮癌 | 尿路上皮異型增生 |
| 微囊型尿路上皮癌 | |
| 巢狀變異型尿路上皮癌(包括大巢狀) | |
| 淋巴上皮瘤樣癌 | |
| 漿細胞樣癌/印戒細胞癌/瀰漫型 | |
| 鉅細胞變異型癌 | |
| 未分化癌 | |
| 透明細胞性癌 | |
| 肉瘤樣癌 | |
| 富含脂質型癌 |
1.膀胱原位癌
膀胱原位癌又稱爲扁平癌,屬於高級別非肌層浸潤性癌,常爲多竈性。膀胱鏡下易於膀胱炎性改變混淆,需活檢確診。
2.膀胱癌的其他病理表現
癌組織標本中存在血管淋巴管浸潤與患者病理分期升高有顯著相關;尿路上皮癌亞型如微乳頭型、肉瘤樣癌及漿細胞癌等預後不佳。
(二)膀胱癌的組織學分級。
膀胱癌的惡性程度以分級(Grade,G)表示,分級與復發、侵襲風險密切相關。目前採用WHO 分級法(WHO1973,WHO 2004)。2016 年版的膀胱癌病理診斷標準仍推薦採用2004版分級方法。
1973 年 WHO 分級標準根據癌細胞的分化程度將膀胱癌分爲高分化、中分化和低分化 3 級,用G1、2、3 或GI、Ⅱ、Ⅲ表示 。
WHO 2004/2016 年分級標準將尿路上皮腫瘤分爲低度惡性潛能乳頭狀尿路上皮腫瘤(papillary urothelial neoplasms of lowmalignant potential,PUNLMP)、低級別乳頭狀尿路上皮癌和高級別乳頭狀尿路上皮癌。推薦採用2004 年的分級標準。見表3。
表 3 WHO 1973 及 2004 膀胱癌分級系統
| 乳頭狀瘤 | |
| WHO 1973 分級 | |
| 尿路上皮癌 1 級 | 分化良好 |
| 尿路上皮癌 2 級 | 中等分化 |
| 尿路上皮癌 3 級 | 分化不良 |
| WHO 2004 分級(乳頭狀瘤) | |
| 低度惡性潛能乳頭狀尿路上皮腫瘤 | |
| 低級別乳頭狀尿路上皮癌 | |
| 高級別乳頭狀尿路上皮癌 | |
WHO 1973 及 WHO 2004 膀胱腫瘤分級方法是兩種不同分級系統,不能完全對應。兩種分級方法在預測患者復發進展方面無顯著差別。目前採用 2004 版分級法。
(三)膀胱癌病理報告。
規範膀胱癌病理標本的送檢及處理流程十分重要。
1.膀胱腫瘤電切病理報告
需包括標本是否有肌層,腫瘤是否侵犯肌層,是否侵犯黏膜固有層、是否存在血管、淋巴管浸潤及原位癌等。
2.膀胱全切標本
需包括病理類型及分期,男性包括尿道、輸尿管切緣及前列腺是否受侵犯等。女性需包括子宮及陰道是否受侵犯。清掃淋巴結分區送檢。
3.膀胱癌免疫組化
免疫組化檢查有助於明確是否是尿路上皮來源、區分反應性增生及原位癌;有助於膀胱梭形細胞腫瘤及膀胱轉移癌診斷等。2013 ISUP 推薦:免疫標記物如GATA3、CK7、CK20、P63 、HMWCK 及 CK5/6 有助於明確是否是尿路上皮來源;CD44、CK20、P53 等有助於鑑別反應性增生及原位癌;ALK1、SMA、desmin、P63 、HMWCK 及CK5/6 有助於明確膀胱梭形細胞腫瘤及轉移癌診斷等。免疫組化對膀胱癌的診斷、分期及預後判斷有價值,但尚需要進一步驗證及研究。
(四)膀胱癌的分期。
膀胱癌的分期主要根據原發腫瘤侵犯範圍、區域淋巴結是否受累及其他部位是否轉移等進行評估。採用國際抗癌聯盟(UICC)制訂的 TNM 分期系統,推薦應用2017 年第8版。膀胱癌病理見表 4,臨牀分期見表5。
根據腫瘤是否浸潤膀胱肌層分爲NMIBC和MIBC。NMIBC 約佔膀胱腫瘤的75% ,包括Tis 期(原位癌,5%~10%)、Ta 期(70%~75%)及T1 期(20%~25%),其中原位癌(Tis 期)分化差,發生肌層浸潤風險高,屬於高風險腫瘤。MIBC 爲 T2 期及以上分期患者。
表 4 2017 年 UICC 膀胱癌TNM分期(第8版)
原發腫瘤(T)
Tx 不能評估原發腫瘤
T0 無原發腫瘤證據
Ta 非浸潤性乳頭狀癌
Tis 原位癌(“扁平腫瘤”)
T1 腫瘤侵及上皮下結締組織
T2 腫瘤侵犯肌層
T2a 腫瘤侵及淺肌層(內側 1/2)
T2b 腫瘤侵及深肌層(外側 1/2)
T3 腫瘤侵及膀胱周圍組織
T3a 顯微鏡下可見腫瘤侵及膀胱周圍組織T3b 肉眼可見腫瘤侵及膀胱周圍組織(膀胱外腫塊)
T4 腫瘤侵及以下任何一器官或組織:前列腺、精囊、子宮、陰道、盆壁、腹壁
T4a 腫瘤侵及前列腺、精囊、子宮或陰道
T4b 腫瘤侵犯盆壁或腹壁
N(區域性淋巴結)
Nx 區域性淋巴結無法評估
N0 無區域淋巴結轉移
N1 真骨盆腔單個淋巴結轉移(閉孔、髂內、髂外及骶前淋巴結)
N2 真骨盆腔多個淋巴結轉移(閉孔、髂內、髂外及骶骨前淋巴結)
N3 髂總淋巴結轉移
M(遠處轉移)
MX 無法評估遠處轉移
M0 無遠處轉移
M1 有遠處轉移
M1a 非區域淋巴結
M1b 其他部位遠處轉移
表 5 2017 年 AJCC 膀胱癌分期組合
| 分期 | TNM 情況 | ||
| 0a | Ta | N0 | M0 |
| 0is期 | Tis | N0 | M0 |
| Ⅰ期 | T1 | N0 | M0 |
| Ⅱ期 | T2a | N0 | M0 |
| T2b | N0 | M0 | |
| Ⅲ期A | T3a | N0 | M0 |
| T3b | N0 | M0 | |
| T4a | N0 | M0 | |
| T1~T4a | N1 | M0 | |
| Ⅲ期 B | T1~T4a | N2-3 | M0 |
| Ⅳ期 A | T4b | 任何N | M0 |
| 任何 T | 任何 N | M1a | |
| Ⅳ期 B | 任何 T | 任何 N | M1b |
(五)膀胱癌的分子分型(分子/基因組檢測)。
研究顯示 NMIBC 及 MIBC 的發生發展的分子機制不同,隨着基因檢測技術的進步,根據基因分析的多種膀胱癌分子分型初步應用於臨牀。2019 年膀胱癌分子分型協作組MIBC分子分型,分爲六種類型:管腔乳頭型(24%)、管腔非特異型(8%)、管腔不穩定型(15%)、基質富集型(15%)、基底/鱗狀細胞癌型(35%)及神經內分泌型(3%)。分子/基因組檢測可用於新型藥物的臨牀試驗研究,以達到更精準,更有效的目的。目前臨牀上最常見的相關基因異常包括:CDKN2A(34%);FGFR3(21%);PIK3CA(20%);ERBB2(17%);PD1/PD-L1 基因異常表達等。上述基因異常可能與部分藥物治療效果有關係。如厄達替尼與FGFR3或FGFR2 基因異常有關;阿替利珠單抗或帕博利珠單抗療效與PD-L1 表達水平有關。
除外患者的臨牀及病理分期、病理類型及分級與患者的預後密切相關。研究發現一些生物標誌物對對患者預後有預測作用。如血清血管內皮生長因子、循環腫瘤細胞和DNA損傷修復基因缺陷,包括 ERCC2、ATM、RB1 和FANCC可以預測順鉑爲基礎的新輔助化療的反應。最近,FGFR3 突變和基因融合與成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)抑制劑的反應有關。
分子亞型、免疫基因特徵以及基質信號可能在預測免疫治療反應中發揮重要作用。雖然 PD-L1 免疫組織化學和TMB的表達在某些情況下具有預測價值,還需要研究。前瞻性驗證的預測性分子生物標誌物將爲臨牀和病理數據提供有價值的數據,尚需大型Ⅲ期隨機對照試驗(randomized controlledtrial,RCT)驗證。
膀胱癌的分子分型目前主要用於判斷預後及預測藥物反應性,特別是對新輔助化療的反應性,同時與患者免疫治療的反應性有關係。目前仍尚處在研究探索階段,其價值仍需要大量的研究證實。
(六)膀胱癌病理診斷推薦意見:
見表6。
表 6 膀胱癌組織病理診斷推薦意見:
| 膀胱癌組織病理診斷推薦意見: | 推薦等級 |
| 採用 2017 版 TNM 分期 | 強烈推薦 |
| 採用 2004 版 WHO 分級法組織分級 | 強烈推薦 |
| 電切標本需描述是否有肌層及是否受侵犯 | 強烈推薦 |
| 全切標本需包括尿道輸尿管切緣、前列腺、陰道、子宮受累 | 強烈推薦 |
| 推薦區域淋巴結分區送檢 | 推薦 |
| 需記錄是否有血管淋巴浸潤及組織亞型 | 強烈推薦 |
| 需記錄是否有膀胱原位癌 | 強烈推薦 |
| 原位新膀胱術推薦尿道切緣術中冰凍 | 推薦 |
| 合併原位癌或分期≥T2,推薦術中輸尿管切緣冰凍檢查 | 可選擇 |
四、膀胱癌的治療
根據膀胱癌的分期、病理類型及患者狀態選擇不同的治療方案。
膀胱癌的治療基本方法:NMIBC 的標準治療手段首選TURBt,根據復發危險決定膀胱灌注治療方案。MIBC、鱗狀細胞癌、腺癌、臍尿管癌等以外科手術爲主的綜合治療,首選根治性全膀胱切除術,部分患者可選擇膀胱部分切除術。T2~4aN0M0 期膀胱尿路上皮癌推薦術前新輔助化療,術後根據病理結果決定是否輔助化療和/或放療。轉移性膀胱癌以全身化療爲主,可用姑息性手術、放療緩解症狀。
五、NMIBC 的治療
(一)NMIBC 的危險度分級。
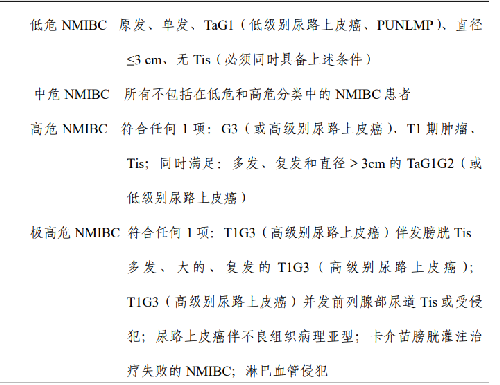
NMIBC 是指侷限於膀胱黏膜層(Ta)及固有層(T1),肌層未見浸潤的膀胱惡性腫瘤,包括Ta、T1、Tis 期。NMIBC約膀胱癌的 75%,其中 Ta 佔 70%、T1 佔20%、Tis 佔10%。Ta和 T1 分期雖然屬於 NMIBC,但兩者的生物學特性有顯著不同,固有層內血管及淋巴管豐富,T1 期容易發生擴散。影響 NMIBC 復發和進展的危險因素包括:腫瘤數量、大小、分期、分級、復發頻率、是否存在原位癌(Tis)等。與復發相關的危險因素包括腫瘤的數量(≥8 個)和復發頻率(>1 次/年);與進展相關的危險因素包括分期(T1)、分級(G3 或高級別尿路上皮癌)和存在Tis。根據復發風險及預後的不同,NMIBC 分爲 4 組(表 7):
表 7 NMIBC 患者危險度分組
(二)手術治療。
NMIBC 患者根據危險度分組來選擇手術方式、膀胱灌注及隨訪方案(表 8)。
1.TURBt
TURBt 既是 NMIBC 的標準治療方式,也是重要診斷方法。具有創傷小、出血少、術後恢復快的優點,是NMIBC患者首選治療方法。
TURBt 目的是把膀胱腫瘤完全切除,直至正常的膀胱壁肌層。腫瘤切除後,建議把基底部組織單獨送檢,利於準確評估腫瘤組織分級、病理分期,指導下一步治療方案。腫瘤完全切除的方式包括分塊切除(包括腫瘤、膀胱壁基底及切除區域邊緣)或整塊切除(用單極或雙極電切、銩激光或鈥激光等整塊切除腫瘤)。
若腫瘤較小(<1cm),可以將腫瘤與其基底的部分膀胱璧一起切除送病理檢查;如果腫瘤較大,則行分塊切除,先切除腫瘤的突起部分、然後切除腫瘤的基底部分,切除直至露出正常的膀胱壁肌層。標本需包含膀胱肌層成分,並進行基底部組織送檢,明確病理分期。TURBt 時儘量避免燒灼,以減少對標本組織的破壞。
門診膀胱鏡檢查時發現復發、小的Ta/G1 腫瘤並直接電灼治療,是可選擇的治療手段。
對多發病竈或原位癌患者,採用NBI 引導下TURBt,能提高腫瘤的發現率,降低遺漏病竈風險,但能否提高患者總體療效尚需驗證。
2. NMIBC 二次電切
NMIBC 電切術後,腫瘤殘餘是腫瘤術後復發重要原因之一。研究顯示:首次 TURBt 術後腫瘤殘留率爲4%~78%,與腫瘤分期、大小、數目以及醫師技術相關。首次單發腫瘤殘留率爲 22%,多發腫瘤的殘留率達45%。直徑<3cm殘留率爲19%,≥3 cm 殘留率爲 42%。中、高分級的T1 期膀胱癌期患者,首次電切術後腫瘤殘餘率達 33%~55%,TaG3 期爲41.4%。由於電切技術和送檢腫瘤標本質量問題,存在病理分期偏差。研究顯示:約 1.3%~25%首次電切爲T1 期的患者在二次電切後被證實爲 MIBC;若首次電切標本無肌層成分,二次電切發現 45%爲 MIBC,二次電切可糾正9%~49%患者病理分期。一項多中心回顧性研究:評估2451 例卡介苗(BacilleCalmette-Guérin,BCG)灌注治療的T1G3/HG級腫瘤(其中935 例二次切除),結果顯示,二次切除能改善初次切除標本中無肌肉成分患者的無復發生存率、無進展生存時間和總生存時間。可使 T1 期患者術後的腫瘤複發率由63.24%降到25.68%,腫瘤進展率由 11.76%降到 4.05%。高級別T1 期腫瘤二次電切後隨訪 10 年,無病生存率爲 69.7%,而單次電切者爲49.6%。二次電切可發現膀胱腫瘤殘留病竈,獲得更準確的病理分期,改善無復發生存率及患者預後,提高治療效果。
(1)二次電切適應證包括:
①首次TURBt 不充分;②首次電切標本中沒有肌層組織(除外TaG1/低級別腫瘤和單純原位癌除外);③T1 期腫瘤;④G3(高級別)腫瘤,單純原位癌除外。
(2)二次電切時機:
首次TURBt 術後間隔時間過長會影響後期灌注化療,若間隔時間過短,因黏膜炎性腫等與殘存腫瘤病變鑑別困難。
目前推薦首次術後 2~6 周左右行二次電切,原腫瘤部位需要再次切除,深度達深肌層。
(3)手術要點:
依次切除原腫瘤基底部位(包括周圍黏膜炎性水腫區域)、可疑腫瘤部位。需切除至膀胱深肌層。建議基底部以活檢鉗或電切環取活檢,必要時做隨機活檢。
(4)二次電切術後灌注:
推薦在二次電切術後24小時內即刻灌注治療。術中出現膀胱穿孔或嚴重的肉眼血尿者不建議灌注。對於高危 NMIBC 患者二次電切術後病理未見腫瘤殘存,推薦膀胱灌注 BCG 或灌注化療藥物。若術後有腫瘤殘存,推薦 BCG 膀胱灌注治療或膀胱切除術;若二次電切病理期爲MIBC,建議行根治性膀胱切除術。
3.經尿道膀胱腫瘤激光切除術
經尿道膀胱腫瘤整塊切除能獲得比較多的膀胱肌層組織,提高腫瘤標本質量,利於分期。激光技術汽化效果好,組織切割精準,術中出血和發生閉孔神經反射的概率低,更適合NMIBC 整塊切除。
目前應用於臨牀的激光包括鈥激光、綠激光、銩激光及1470 半導體激光等。
經尿道膀胱腫瘤激光手術的近期療效與TURBt 相似,尚缺少遠期療效證據。
4.膀胱部分切除術
絕大部分 NMIBC 患者可通過TURBt 切除。少數有足夠切緣的單發孤立的腫瘤、膀胱憩室內腫瘤且隨機活檢未發現原位癌的患者,爲降低電切造成膀胱穿孔風險,可選擇膀胱部分切除術。建議膀胱部分切除術同期行盆腔淋巴結清掃,範圍至少包含髂總、髂內、髂外、閉孔淋巴結。術後膀胱免疫灌注或全身輔助化療。
5.根治性膀胱切除術
對部分高危 NMIBC 亞組或極高危患者,若存在以下高危情況:多發及反覆復發高級別腫瘤、高級別T1 期腫瘤;高級別腫瘤合伴原位癌、淋巴血管浸潤、微乳頭腫瘤或BCG灌注失敗的患者,推薦行根治性膀胱切除術。不接受膀胱切除的患者可選擇同步放化療或 TURBt+BCG 膀胱灌注,需將不同治療方案的優缺點告知患者,與患者溝通討論後決定。
表 8 NMIBC 患者手術治療推薦意見


(三)TURBt 術後膀胱灌注治療。
NMIBC 患 者 TURBt 術 後複發率高,5 年內複發率爲24%~84%。復發與原發腫瘤切除不完全、腫瘤細胞種植或新發腫瘤有關;部分患者會進展爲 MIBC。因此,推薦所有NMIBC患者進行術後輔助性膀胱灌注治療,包括膀胱灌注化療和膀胱灌注免疫治療(表 9、表 10)。
1. 膀胱灌注化療(表 9)
(1)灌注治療的時機:
①TURBt 術後即刻膀胱灌注化療:術後即刻灌注化療能夠殺滅術中播散或/和創面殘留的腫瘤細胞,能顯著降低NMIBC患者的複發率。
研究顯示:2844 例 NMIBC 患者TURBt 術後即刻灌注絲裂黴素 C,複發率爲 27%,對照組爲36%;另一項Ⅲ期臨牀研究顯示:與對照組比,術後即刻灌注吉西他濱能使複發率降低34%。
最新薈萃分析顯示:2278 例NMIBC 患者,TURBt 術後即刻膀胱灌注化療 5 年複發率降低35%[風險比(hazardratio,HR)0.65,P<0.001),但不能降低患者進展及死亡風險。因此,爲預防腫瘤細胞種植,所有NMIBC患者均推薦行術後即刻膀胱灌注化療,應在術後24 小時內儘早完成灌注化療(最理想是術後 6 小時內完成灌注)。若術中膀胱穿孔或術後嚴重肉眼血尿時不建議即刻灌注。②術後早期和維持膀胱灌注化療:中危及高危NMIBC患者術後即刻灌注化療後需要維持灌注化療或BCG灌注治療以降低腫瘤複發率。目前不推薦持續1 年以上的膀胱灌注化療。
(2)膀胱灌注方案包括:
早期誘導灌注:術後4~8周,每週 1 次膀胱灌注;之後維持灌注:每月1 次,維持6~12個月。
①低危 NMIBC 患者術後即刻灌注後,腫瘤複發率很低,因此即刻灌注後不推薦維持膀胱灌注治療。
②中危 NMIBC 患者,一般建議術後即刻膀胱灌注後,繼續膀胱灌注化療,每週 1 次,共8 周,隨後每月1 次,共10個月,預防復發。也可選擇 BCG 灌注。
③對於高危 NMIBC 患者,推薦術後膀胱灌注BCG,預防復發及進展。若復發耐受 BCG,可選擇術後維持膀胱灌注化療。
目前,沒有證據顯示採用不同化療藥物的維持灌注方案療效有顯著差別,但不推薦 1 年以上的膀胱灌注化療。
(3)灌注化療藥物的選擇:
常用灌注化療藥物包括:絲裂黴素(劑量爲每次20~60mg )、吉西他濱(劑量爲每次1000mg)、吡柔比星(劑量爲每次30~50mg)、表柔比星(劑量爲每次 50~80mg)、多柔比屋(劑量爲每次30~50mg)、羥基喜樹鹼(劑量爲每次 10~20mg)等。化療藥物應通過導尿管灌入膀胱,並保留0.5~2小時。膀胱灌注化療效果與尿液 pH 值、化療藥物濃度及劑量、藥物作用時間有關。灌注前禁水 6 小時,減少尿液將藥物稀釋。膀胱灌注化療主要副作用是化學性膀胱炎,與灌注劑量和頻率相關,表現爲膀胱刺激徵及肉眼血尿,與灌注劑量及頻率有關。輕者在灌注間歇期可自行緩解,多飲水即可。若出現嚴重的膀胱刺激徵,應延遲或停止灌注治療,多數副作用在停止灌注後可自行改善。
表 9 膀胱癌常用膀胱灌注化療方案
| 藥物 | 劑量 | 溶媒及體積 | 保留時間(小時) |
| 絲裂黴素C | 40mg | NS 40ml | 2 |
| 表柔比星 | 50mg | NS 40ml | 1 |
| 吡柔比星 | 40mg | GS 40ml | 0.5 |
| 羥基喜樹鹼 | 40mg | NS 40ml | 2 |
| 吉西他濱 | 1000mg | NS 50ml | 1 |
注:NS,生理鹽水;GS,葡萄糖注射液。
2.膀胱灌注免疫治療
膀胱灌注免疫治療主要是 BCG 膀胱灌注治療,其他還包括銅綠假單胞菌、化膿性鏈球菌、紅色諾卡菌製劑等生物製劑。BCG 是高危 NMIBC 患者 TURBt 術後首選的輔助治療藥物。
BCG 的確切作用機制尚不清楚,BCG 是通過膀胱內灌注免疫製劑,誘導機體局部免疫反應,直接殺傷腫瘤細胞或誘導機體非特異性免疫應答,引起 Th1 細胞介導的免疫應答效應而間接發揮抗腫瘤作用。BCG 能預防膀胱腫瘤復發、控制腫瘤進展,但對患者總生存及腫瘤特異性生存沒有明確療效。
(1)BCG 膀胱灌注適應證:
包括:中危、高危NMIBC和膀胱原位癌,而低危非肌層浸潤性膀胱不推薦BCG灌注治療。與單純 TURBt 相比,TURBt 術後聯合BCG膀胱灌注能預防 NMIBC 術後復發,明顯降低中危、高危腫瘤進展的風險。因此,高危 NMIBC 患者推薦 BCG 膀胱灌注免疫治療。中危 NMIBC 患者術後 5 年的複發率爲42%~65%,腫瘤進展的風險爲 5%~8%。推薦中危 NMIBC 患者膀胱灌注化療。多中心 RCT 證實,對中危 NMIBC 患者,BCG灌注治療在預防腫瘤復發優於化療藥物,且療效相對持久,延緩腫瘤進展,據此,部分患者可選擇 BCG 灌注治療,持續灌注1年。2015 年 EORTC 分析 2 項Ⅲ期臨牀研究,BCG灌注治療1~3 年,隨訪 7.4 年,T1G3 期患者5 年發展爲MIBC概率爲19.3%。高危患者爲 45%。與絲裂黴素灌注相比,高危患者接受 BCG 灌注的復發風險降低 32%,腫瘤進展率降低27%。BCG 維持治療效果更佳。
膀胱原位癌患者,BCG 灌注治療的完全緩解率爲72%~93%,顯著高於膀胱灌注化療(48%),顯著降低腫瘤複發率及進展率。推薦膀胱原位癌患者術後BCG灌注治療。
(2)BCG 膀胱灌注禁忌證:
TURBt 術後兩週內;活動性結核患者、有嚴重血尿;外傷性導尿後;有症狀的尿路感染患者。免疫缺陷或損壞者(如艾滋病患者、正在用免疫抑制劑或放療的患者)、BCG 過敏者等。
(3)BCG 膀胱灌注方案及劑量:
BCG膀胱灌注治療的最佳方案及療程目前尚無定論。
①開始灌注時間:術後膀胱有創面或有肉眼血尿等,即刻BCG 灌注易引起嚴重的副作用,有造成結核播散風險。禁止術後即刻灌注,通常在術後至少 2~4 周後開始膀胱腔內BCG灌注。
②灌注方案及劑量:BCG 治療一般開始時採用每週1次共6 次灌注,稱爲誘導灌注。維持治療方案很多,但沒有證據表明任何一種方案明顯優於其他。國產 BCG 必賽吉推薦方案:6 次誘導灌注後,行2周1次,共 3 次強化灌注以維持良好的免疫反應,以後每月1次維持灌注,共 10 次,1 年共 19 次。RCT 研究顯示,第 1 年 19 次BCG 灌注組的1 年無復發生存率優於第 1 年 15 次灌注者。
BCG 灌注治療一般採用 60~120mg BCG溶於50~60ml 生理鹽水中膀胱灌注,每次保留 2 小時,國產BCG推薦全量劑量爲120mg。1 次/周,連續 6 周的誘導灌注後,維持BCG灌注1~3年(至少 1 年)。分別在第 3、6、12、18、24、36 個月時進行維持灌注,每週 1 次共 3 次(第1 年共15 次),以保持和強化BCG 的療效。全劑量 BCG 灌注比1/3 劑量BCG維持灌注效果更好。
高危膀胱癌患者,推薦採用3 年的BCG膀胱灌注維持治療,能有效地防止復發,中危患者推薦BCG維持灌注1年。
(4)BCG 膀胱腔內灌注不良反應:
總體不良反應發生率爲 71.8%。以局部不良反應爲主,其中1~2 級不良反應爲60.1%,主要不良反應包括膀胱刺激徵、血尿和流感樣綜合徵,發熱、少見的嚴重不良反應包括結核敗血症、肉芽腫性前列腺炎、附睾睾丸炎、膀胱攣縮、結核性肺炎、關節痛和/或關節炎、過敏反應等。通過停藥、對症治療可緩解。
(5)BCG 膀胱灌注失敗的類型
①BCG 難治:接受 BCG 充分治療後6 個月內發現高級別腫瘤或腫瘤在 1 個 BCG 治療週期後3 個月出現分級分期進展。
②BCG 復發:接受 BCG 充分治療後並維持無瘤狀態6個月之後出現高級別腫瘤復發(最後接受BCG治療的6~9個月內)。
③BCG 無反應:包括 BCG 難治及復發,此時患者應選擇根治性膀胱切除術。不適合手術的可選擇保留膀胱的綜合治療。
中危患者接受 BCG 治療後出現非高級別復發,可重複BCG 治療或選擇根治性全膀胱切除術。
3.帕博利珠單抗(免疫檢查點抑制劑)
一項單臂Ⅱ期臨牀研究(KEYNOTE-057),應用帕博利珠單抗治療 103 例既往 BCG 治療失敗、高危、有原位癌、不能或不同意行根治性膀胱切除的 NMIBC 患者。結果顯示:3個月的完全緩解率爲 38.8%[95%置信區間(confidence interval,CI),29.4%~48.9%],最後一次隨訪(中位數14.0 個月)時維持72.5%的完全緩解。本研究 96 例患者中完全緩解率爲41%(95% CI,31%~51%),中位持續緩解時間爲16.2 個月,46%的完全緩解至少維持 1 年。12.6%的患者出現≥3 級與治療相關的不良事件,免疫相關不良事件佔18.4%。
4.其他膀胱內治療方法
(1)光動力學治療:
光動力學治療是利用光敏劑(包括ALA、HAL)灌注到膀胱內,通過膀胱鏡用激光進行全膀胱照射的治療方法。腫瘤細胞攝取光敏劑後,在激光作用下產生單態氧,使腫瘤細胞變性壞死。可降低腫瘤複發率及進展率,但其確切療效尚需多中心大樣本的臨牀研究證實。。適應證:膀胱原位癌、反覆復發、不能耐受手術、BCG灌注治療失敗患者可嘗試選擇光動力學治療。
(2)熱灌注療法:
通過加熱設備對灌注化療藥物加熱,利用熱能及化療藥物聯合以提高抗腫瘤效果。如絲裂黴素灌注液(絲裂黴素 C 20mg+注射用水 50ml)加熱到42℃,維持1小時,與傳統灌注化療相比有一定優勢。
表 10 NMIBC 患者膀胱灌注治療

(四)膀胱原位癌的治療。
膀胱原位癌雖屬於 NMIBC,但通常分化差,屬於高度惡性腫瘤,發生肌層浸潤的風險高於Ta、T1 期膀胱癌。原位癌常與 Ta、T1 期膀胱癌或 MIBC 同時存在,是預後欠佳的危險因素。
原位癌的標準治療方案是 TURBt 術,術後輔助BCG膀胱灌注治療。若患者無法耐受 BCG 灌注,也可選擇灌注化療治療。
單純 TURBt 無法治癒原位癌,與膀胱灌注化療相比,BCG灌注治療原位癌完全緩解率高(72%~93%),明顯高於膀胱灌注化療( 48%),能顯著降低腫瘤復發和進展風險。約10%~20%的完全緩解患者最終進展爲MIBC,而無效者爲66%。
BCG 治療期間,每 3~4 個月定期進行膀胱鏡及尿細胞學檢查,若治療 9 個月時未達到完全緩解或發生腫瘤復發、進展,推薦行根治性膀胱切除術。當原位癌合併有MIBC時,推薦行根治性膀胱切除術。
(五)TURBt 後復發腫瘤的治療。
NMIBC 患者 TURBt 術後膀胱灌注化療後出現復發的患者,建議再次 TURBt 治療。術後可更換膀胱灌注化療藥物進行重新膀胱灌注治療,也可選擇 BCG 灌注。對反覆復發和多發者,建議行BCG 灌注治療或根治性膀胱切除。對於隨訪時出現 MIBC;BCG 灌注3 個月後出現高級別NMIBC;3~6 個月時發現原位癌;BCG 治療中或治療後出現高級別 NMIBC 的患者,考慮是 BCG 難治性膀胱癌,此類患者推薦行根治性膀胱切除。
(六)尿細胞學陽性,膀胱鏡及影像學檢查陰性患者治療。
TURBt 術後複查時發現尿細胞學陽性,但膀胱鏡檢查及影像學檢查陰性患者,建議行膀胱鏡下隨機活檢、尿細胞學檢查及影像學檢查明確上尿路是否有腫瘤,必要時行輸尿管鏡檢查。
若隨機活檢病理爲腫瘤,推薦BCG 膀胱灌注治療,若完全反應需維持灌注;若無效或部分緩解,可選擇全膀胱切除、更換灌注藥物或臨牀試驗藥物等。若上尿路腫瘤細胞陽性同時輸尿管鏡及影像檢查陽性需按照上尿路腫瘤治療。若隨機活檢及上尿路檢查均陰性,建議定期複查。
(七)NMIBC 患者的隨訪。
超聲檢查是最常規的複查手段。膀胱鏡檢查是NMIBC患者複查時的首選的方法,檢查中若發現膀胱黏膜可疑病變,應行活檢明確病理結果。必要時行尿脫落細胞學、CT/CTU或MRI/MRU 等檢查,但均不能完全代替膀胱鏡檢查。推薦所有 NMIBC 患者在術後3 個月時進行第一次膀胱鏡檢查,若手術切除不完全、腫瘤進展快可適當提前。低危患者術後 3 個月內進行膀胱鏡檢查,如第一次膀胱鏡檢查陰性,建議術後 1 年時行第二次膀胱鏡檢查,之後每年1次直到第 5 年。
高危患者推薦前 2 年每 3 個月行1 次尿細胞學及膀胱鏡檢查,第 3 年開始每 6 個月 1 次,第5 年開始每年1 次直到終身;高危患者每年 1 次上尿路檢查(CTU 檢查)。中危患者隨訪方案介於兩者之間,依據患者個體預後因素和一般情況決定。隨訪過程中,一旦出現復發,治療後的隨訪方案按上述方案重新開始。
患者隨訪期間出現細胞學檢查陽性和膀胱未見腫瘤時,推薦採用隨機活檢或熒光或 NBI 膀胱鏡引導活檢和CT/CTU(瞭解上尿路情況)、尿道前列腺活檢。
六、MIBC 患者的治療及隨訪
近年來,隨着新型藥物及臨牀研究進展,MIBC患者治療逐漸綜合化,根據具體分期選擇不同的治療方案。MIBC 患者總的治療原則:新輔助化療聯合根治性全膀胱切除術是 MIBC 患者的標準治療方案。局部進展期MIBC患者以全身系統治療聯合局部治療以提高療效。轉移性MIBC患者以全身系統治療聯合支持治療爲主。術前系統檢查,以明確臨牀分期及是否有轉移。其中胸部、腹部和盆腔 CT/CTU 或/和 MRI/MRU 檢查是MIBC最重要的檢查方法,必要時行 PET-CT 檢查。
MIBC 患者的治療方式包括:新輔助化療、根治性膀胱切除術、膀胱部分切除術、術後輔助化療、保留膀胱綜合治療等(表 11)。
(一)新輔助治療。
根治性膀胱切除術是臨牀分期爲cT2~T4aN0M0的MIBC患者的標準治療,但其 5 年總生存率約50%。爲提高治療效果,以順鉑爲基礎的聯合新輔助化療已廣泛應用,免疫檢查點抑制劑的新輔助免疫治療正常探索中。新輔助治療對達到ypT0或至少 ypT2 的患者的總生存率有重大影響
1.新輔助化療
cT2~4aN0M0 期 MIBC 患者,推薦以順鉑爲基礎的新輔助化療聯合根治性膀胱切除術;pT3~pT4 或淋巴結轉移的患者建議術後輔助化療。
因缺少臨牀數據支持,對無法耐受以順鉑爲基礎的聯合新輔助化療的患者,不推薦應用卡鉑代替順鉑,建議直接行根治性膀胱切除術,不推薦新輔助化療。多項隨機試驗和薈萃分析顯示:MIBC 患者接受順鉑爲基礎的新輔助化療可以明顯提高腫瘤完全緩解率並延長患者的總生存期,患者死亡風險降低 10%~13%,5 年總體生存率提高5%~8%,對 cT3 患者 5 年生存率提高可達11%。SWOG 研究 307 例 MIBC 患者,採用MVAC方案新輔助化療後行全膀胱切除術,患者中位總生存時間爲77 個月,單純手術組爲 46 個月,沒有增加患者治療相關死亡率。另一項 Meta 薈萃分析,共3005 例患者,發現MIBC患者接受以順鉑爲基礎的新輔助化療能顯著提高患者5年生存率(8%)及腫瘤特異性生存率(9%)。GETUG/AFU V05 試驗,探討MIBC 患者採用ddMVAC(劑量密集的甲氨蝶呤、長春鹼、多柔比星和順鉑)與CG方案新輔助化療,兩種方案具有相似的病理反應率(ypT0N0),分別爲 42%和 36%(P=0.2)。
(1)常用的新輔助化療方案包括:
①吉西他濱聯合順鉑(GC 方案):給藥方案一:吉西他濱 1000mg/m2第1、8 天靜脈滴注,順鉑 70mg/m2第 2 天靜脈滴注,每21 天爲1 個週期。給藥方案二:吉西他濱 1000mg/m2第1、8 靜脈滴注,順鉑70mg/m2第 1 或第 2 天靜脈滴注,每28 天爲1 個週期。一般新輔助化療 4 個週期,21 天或28 天爲一週期均可接受。其中 21 天方案時間短,劑量依從性可能更好。
②ddMVAC(劑量密集的甲氨蝶呤、長春鹼、多柔比星和順鉑)聯合生長因子,3~4 個週期。推薦用法:甲氨蝶呤 30mg/m2、長春新鹼3mg/m2、多柔比星 30mg/m2、順鉑 70mg/m2,第1 天靜脈滴注,每2周重複。
要求水化,化療期間常規預防性應用粒細胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)。
③CMV 方案(順鉑、甲氨蝶呤和長春鹼):CMV可用於一線方案新輔助化療。
甲氨蝶呤 30mg/m2、長春鹼4mg/m2,第1、8 天靜脈滴注,順鉑 100mg/m2第 2 天靜脈滴注,每3 周爲1 個週期。一項多中心隨機Ⅲ期隨機臨牀研究(BA06 30894),共入組 976 例,平均隨訪 8 年,結果顯示:CMV新輔助化療能使患者 10 年生存率從 30%提高到 36%。死亡風險降低16%(HR0.84,P=0.037)。
副作用以及是否會影響手術是影響是否採用新輔助治療決策的重要因素。根據目前的臨牀數據,新輔助化療主要引起包括消化道反應、貧血及白細胞降低等不良反應,未增加術後3~4 級併發症發生率,手術完成率與無化療組相似。
2.新輔助免疫治療
免疫檢查點[程序性死亡蛋白-1(programmed death-1,PD-1)/程序性死亡蛋白配體-1(programmed death ligand-1,PD-L1;B7 同源物 1)]抑制劑已用於不能切除和轉移的MIBC患者二線治療及無法耐受鉑類且 PD-L1 陽性患者的一線治療,並臨牀獲益。
檢查點抑制劑單藥或聯合化療或CTLA-4 檢查點進行新輔助免疫治療的Ⅱ 期或Ⅲ期臨牀研究逐漸增多,並取得初步結果。其中兩個Ⅱ 期試驗的數據令人鼓舞。使用帕博利珠單抗的Ⅱ期試驗結果顯示,患者完全病理緩解(pT0)爲42%,54%的患者出現病理反應(<pT2)。阿替利珠單抗治療的病理完全緩解率爲 31%。免疫治療在新輔助治療中尚未得到批准。3.MIBC 新輔助治療推薦原則cT2~4aN0M0 期 MIBC 患者,推薦新輔助化療聯合根治性膀胱切除術;不能耐受順鉑的患者,不推薦新輔助化療。新輔助免疫治療僅作爲臨牀試驗。
(二)根治性膀胱切除術。
新輔助化療後行根治性膀胱切除術及盆腔淋巴結清掃術,是 MIBC 的標準治療方案,是提高患者生存率、避免局部復發和遠處轉移的有效方法。
1.根治性膀胱切除術適應證
(1)無遠處轉移的 T2~4aN0~x,M0 期MIBC。
(2)高危 NMIBC 患者:BCG 治療無效腫瘤;復發或多發T1G3(高級別)腫瘤;伴發原位癌(Tis)的T1G3(高級別)腫瘤;TURBt 和膀胱灌注治療無法控制的廣泛乳頭狀腫瘤。
(3)術後反覆復發的 NMIBC。
(4)膀胱非尿路上皮癌如腺癌、鱗癌等病理類型。
(5)尿路上皮癌伴不良組織學亞型。
2.挽救性(姑息性)膀胱切除術的指徵包括:
非手術治療無效、保留膀胱治療後腫瘤無效或總量復發、非尿路上皮癌(腫瘤對化療和放療不敏感)。也用作姑息性干預手段,包括瘻管形成、疼痛和複發性血尿患者。
3.根治性膀胱切除術禁忌證
(1)已遠處轉移的膀胱癌。
(2)有嚴重出血傾向者。
(3)有嚴重合並症(心、肺、肝、腦、腎等疾病)及身體不能耐受手術者。
4.根治性膀胱切除的開始時間
MIBC 患者,若不行新輔助化療,推薦確診後3個月內進行根治性膀胱切除手術。
5.手術切除範圍
經典的根治性膀胱切除術的手術範圍包括:膀胱及周圍脂肪組織、輸尿管遠端,同時行盆腔淋巴結清掃術;男性應包括前列腺、精囊,女性應包括子宮、部分陰道前璧、附件。如果腫瘤侵犯尿道、女性膀胱頸部或男性前列腺部,或術中冰凍顯示切緣陽性,需全尿道切除。
保留性功能的膀胱切除術(sexual-preserving techniquesSPC):部分性功能要求高的男性MIBC 患者,若腫瘤侷限、前列腺、前列腺尿道部及膀胱頸部無腫瘤,可選擇保留性功能的膀胱切除術。男性患者選擇保留前列腺、保留前列腺包膜或精囊(保存精囊、輸精管和神經血管束)或單純保留神經血管束技術等有助於改善尿控及性功能。對於選擇原位新膀胱的患者,保留支配尿道的自主神經有助於改善術後尿控。女性患者若腫瘤未侵犯陰道前壁、子宮頸及卵巢,可選擇保留神經血管束及子宮、陰道及卵巢。一項有關經典根治性膀胱切除術與採用SPC技術的根治性膀胱切除術患者比較研究,中位隨訪3~5 年,兩組患者的局部復發、轉移、疾病特異性生存時間(disease specific survival,DSS)和總生存時間等無顯著差別。保留性功能的手術應以保證腫瘤根治效果爲前提,術後需規律隨訪。
保留性功能的根治性膀胱切除手術不是MIBC標準術式,部分對性功能有很高要求的患者可考慮選擇SPC。
6.盆腔淋巴結清掃術
盆腔淋巴結轉移是患者預後差的重要因素,盆腔淋巴結清掃既是治療手段,也爲評估預後提供信息,應與根治性膀胱切除術同期進行。
NMIBC 患者的淋巴結轉移風險爲1%~10%。MIBC患者淋巴轉 移風險 達 24% 以上 ,並與腫瘤浸潤深度相關(pT2a9%~18%、pT2b 22%~41%、pT3 41%~50%、pT4 41%~63%)。
盆腔淋巴結清掃是根治性膀胱切除術的重要組成部分。
(1)淋巴結清掃術式:包括標準淋巴結清掃和擴大淋巴結清掃兩種。
(2)標準淋巴結清掃範圍:92%的膀胱淋巴引流位於輸尿管跨越髂血管平面以下。髂總血管分叉處(近端),生殖股神經(外側),旋髂靜脈和 Cloquet 淋巴結(遠端),髂內血管(後側),包括閉孔、髂內及髂外淋巴結及骶骨前淋巴結。
(3)擴大淋巴結清掃範圍:在標準淋巴結清掃的基礎上向上擴展至腹主動脈分叉處,包括髂血管交叉輸尿管內側,髂總血管、腹主動脈遠端及下腔靜脈周圍淋巴脂肪組織、骶前淋巴結等。應清除雙側清掃範圍內的所有淋巴脂肪組織。與標準淋巴結相比較,擴大淋巴結清掃並不能改善總生存及無復發生存,術後淋巴囊腫增加。大部分患者推薦標準盆腔淋巴結清掃,術前或術中懷疑淋巴結轉移者可選擇擴大淋巴結清掃。
7.根治性膀胱切除術的手術方式
根治性膀胱切除術分爲開放手術和腹腔鏡手術兩種,腹腔鏡手術包括常規腹腔鏡手術和機器人輔助腹腔鏡手術。開放手術是經典手術方式。常規腹腔鏡手術對術者的操作技巧要求高、手術時間、總體併發症、術後切緣陽性率以及淋巴結清掃效果與開放手術相似,具有失血少、副損傷小、術後疼痛輕、恢復快等優點。機器人輔助腹腔鏡根治性膀胱切除術手術操作更精細,出血量更少。
完全腹腔鏡下根治性全膀胱切除術及尿流改道技術正在探索,並日趨成熟。單孔腹腔鏡相關設備及技術尚需改進。
8.根治性膀胱切除術的併發症和生存率
根治性膀胱切除術風險比較高,圍手術期併發症發生率約28%~64%,圍手術期死亡率爲 2.5%~2.7%,主要死亡原因包括心血管併發症、敗血症、肺栓塞、肝功能衰竭和大出血等。5 年無復發生存率及總生存率分別爲68%及66%;10年時分別爲 60%及 43%。無盆腔淋巴結轉移者5 年及10 年總生存率分別爲 57%~69%及 41%~49%,腫瘤特異性生存率分別爲67%及 62%。盆腔淋巴結轉移者 5 年及10 年總生存率分別爲25%~35% 及 21%~34% , 腫 瘤 特異性生存率分別爲31%及28%。
(三)膀胱部分切除術。
膀胱部分切除術不是 MIBC 患者首選的手術方式。適應證:位於膀胱頂部的單發MIBC(cT2);遠離膀胱頸部及三角區並有足夠手術切緣的腫瘤;無原位癌;膀胱憩室內腫瘤及有嚴重合並疾病不適合全膀胱切除的患者。推薦術前行以鉑類爲基礎的新輔助化療,膀胱部分切除術同時行盆腔淋巴結清掃術。術前未行新輔助化療的患者,根據術後病理結果,決定是否輔助化療或輔助放療(周圍組織侵犯、淋巴結轉移、切緣陽性、pT3~4a)。
(四)尿流改道術。
根治性膀胱切除時應同期行尿流改道手術。目前尿路改道術尚沒有標準的方案,有多種方法可選擇,包括不可控尿流改道、可控尿流改道及腸代膀胱手術等。保護腎功能、提高患者生活質量是尿流改道術的最終治療目標。需根據患者的具體情況如年齡、伴發疾病、預期壽命、既往盆腔及腹腔手術或放療史,結合患者意願及術者的技術水平,慎重選擇尿流改道術式。術前需要與患者詳細溝通,讓患者充分了解不同改道術的優缺點,由患者選擇具體改道方案。隨着腹腔鏡技術的普及,常規腹腔鏡手術和機器人輔助的腹腔鏡手術己廣泛應用於多種尿流改道術。既往多采用腹腔鏡下行膀胱切除術後通過小切口在腹腔外行尿流改道術。目前,腹腔鏡或機器人輔助腹腔鏡根治性膀胱切除術+體腔內尿流改道技術逐漸成熟。與體外尿流改道術相比,體腔內尿流改道技術在手術時間、切緣陽性率、生存率等方面無顯著差別,但患者術後腸道功能恢復快。尿流改道術主要包括以下幾種:
1.原位新膀胱術
原位新膀胱術由於患者不需要腹壁造口,維持患者生活質量及形象,成爲根治性膀胱切除術後尿流改道的主要方式之一。
首選末段迴腸去管化製作的迴腸新膀胱,如Studer 膀胱,M 形迴腸膀胱、邢氏新膀胱術等,其他術式包括改良U型新膀胱、IUPU 新膀胱等迴腸新膀胱構建方式及去帶乙狀結腸新膀胱術,但長期效果尚需觀察。升結腸、盲腸、胃應用相對較少。術後 1 年日間控尿率可達 87%~96%,夜間控尿率可達72%~95%。
(1)原位新膀胱應滿足以下條件:①尿道完整和外括約肌功能良好;②術中尿道切緣陰性;③腎臟功能良好;④腸道無明顯病變。
(2)禁忌證包括:高劑量術前放療、複雜的尿道狹窄、生活不能自理、腫瘤侵犯膀胱頸及尿道。
(3)併發症:約 22%患者出現併發症,如不同程度尿失禁和排尿困難,部分患者需長期導尿或間歇性自我導尿。日間或夜間尿失禁(分別約 8%~10%、20%~30%);輸尿管腸道吻合口狹窄(3%~18%);尿瀦留(4%~12%);代謝疾病等。存在尿道腫瘤復發風險(1.5%~7%),若多發原位癌或侵犯前列腺部尿道,複發率約爲 35%。
2.迴腸通道術
迴腸通道術是一種經典的簡單、安全、有效的不可控尿流改道的術式,是不可控尿流改道的首選術式,也是最常用的尿流改道方式之一。
主要缺點是需腹壁造口、終身佩戴集尿袋。術後早期併發症約 48%,包括尿路感染、腎孟腎炎、輸尿管迴腸吻合口漏或狹窄。主要遠期併發症是造口相關併發症(24%)、上尿路的功能和形態學上改變(30%)。各種形式的腸道尿流改道中,迴腸通道術的遠期併發症要少於可控貯尿囊或原位新膀胱。
伴有短腸綜合徵、小腸炎性疾病、迴腸受到廣泛射線照射的患者不適於此術式。無法採用迴腸的患者,可採用結腸通道術。
3.輸尿管皮膚造口術
輸尿管皮膚造口術是一種簡單、安全的術式。適用於預期壽命短、有遠處轉移、姑息性膀胱切除、腸道疾患無法利用腸管進行尿流改道或全身狀態不能耐受手術者。輸尿管皮膚造口術後出現造口狹窄和逆行泌尿系感染的風險比迴腸通道術高。
4.其他尿流改道方法
目前不推薦應用。
(1)經皮可控尿流改道術:由腸道去管重建的低壓貯尿囊,抗反流輸尿管吻合和可控尿的腹壁造口組成,患者術後需間歇性自行插管導尿。該術式併發症發生率高,目前已基本淘汰。
(2)利用肛門控尿術式:利用肛門括約肌控制尿液的術式包括:①尿糞合流術,如輸尿管乙狀結腸吻合術;②尿糞分流術,如直腸膀胱術。目前很少應用。無論採用何種尿流改道方式,術後應定期複查,瞭解是否有上尿路梗阻、感染及結石情況,及時處理以保護腎功能。
(五)保留膀胱的綜合治療。
對於身體條件不能耐受根治性膀胱切除術,或不願接受根治性膀胱切除術的 MIBC 患者,可選擇保留膀胱的綜合治療。患者的生活質量、身體狀態、性功能、腸道功能等優於根治性膀胱切除者。
適用於單發腫瘤、無淋巴結轉移、無廣泛或多竈性原位癌、無腫瘤相關性腎積水,治療前膀胱功能良好。MIBC 患者保留膀胱的綜合治療的基本方案:通過TURBt最大限度切除可見腫瘤,並聯合綜合治療措施如術後輔助放療、輔助化療等。術後密切隨訪,必要時行挽救性膀胱切除術。
1.保留膀胱的手術方式有 2 種最大限度 TURBt(complete TURBt,cTURBt)和膀胱部分切除術。
MIBC 患者採用保留膀胱綜合治療的5 年總體生存率爲45%~73%,10 年總體生存率爲 29%~49%。
2.目前保留膀胱的治療方法有以下幾種
(1)TURBt 聯合放療、化療:前瞻性數據研究顯示,單純的 TURBt、放療或化療很難取得保留膀胱的最佳療效。目 前 保 留 膀 胱 治 療 多 採 用手術聯合放療化療的三聯(Trimodality therapy,TMT)或多聯綜合治療(MulitimodalityTreatment,MMT)。化療藥物一般採用順鉑和絲裂黴素C加5-氟尿嘧啶方案。
有關比較根治性膀胱切除與MMT 治療效果的研究目前尚缺少高質量的研究結論,缺少前瞻性隨機對照研究數據。目前研究認爲,分別採用 TMT 和根治性膀胱切除術2種方案的 MIBC 患者的 DSS 和總生存時間無顯著差異。一項包括57項研究和 30 000 名患者的系統回顧比較了根治性膀胱切除術和TMT 療效,顯示採用 TMT 治療的患者10 年總生存時間和DSS有所改善,但根治性膀胱切除術和TMT 之間沒有統計學差異。但有回顧性研究顯示,與接受外放射治療或TMT的患者相比,根治性膀胱切除術患者的存活率顯著優於上述2 種方案。美國馬薩諸塞州綜合醫院研究cTURBt 聯合放療及以鉑類爲基礎化療的 MMT 方案治療 T2~4a 期MIBC患者療效:中位隨訪 7.7 年,T2 期完全緩解率爲79%,約22%患者需要挽救性膀胱切除。5 年、10 年疾病特異性生存率分別爲64%及59%。總生存率分別爲 52%及 35%。與同期的根治性膀胱切除療效類似。
另一項類似研究顯示 10 年膀胱保留率爲79%,總生存率、腫瘤特異性生存率及無轉移生存率分別達到43.2%、76.3%和79.2%。
美國放射治療協作組一項入組468 例MIBC患者的前瞻性MMT 研究:隨訪 4.3 年,69%患者部分緩解,5 年、10年腫瘤特異性生存率分別爲 71%、65%,總生存率分別爲57%、36%。
若聯合治療不敏感,推薦早期行根治性膀胱切除術。
(2)TURBt 聯合化療:對部分患者新輔助化療聯合cTURBt 是一種治療選擇,隨訪56 個月,44%患者保留膀胱,5年存活率爲 69%。病理完全緩解率爲8%~26%。T3/4期患者採用順鉑爲基礎的化療,其完全緩解率和部分緩解率分別爲11%和 34%。3 個週期化療後,通過膀胱鏡和活檢再次評估是否有殘餘病竈;如病竈仍存在,推薦行挽救性全膀胱切除。最新一項對 1538 例 MIBC 患者的回顧性分析研究,患者採用 TURBt 聯合多藥化療治療,患者2 年和5 年的總生存率分別爲 49%和 32.9%,cT2 組總生存率分別爲52.6%和36.2%。雖然數據顯示部分患者可實現保留膀胱的長期存活,但不建議常規採用。
(3)TURBt 聯合外放射治療:TURBt 術後輔助放療主要適用於不適合根治性膀胱切或不能耐受化療患者的替代方案。研究顯示:TURBt 術後聯合放化療與單獨輔助放療相比,前者中位生存時間爲 70 個月,優於後者的28.5 個月,術後聯合放化療療效更佳。
(4)單純 TURBt:部分腫瘤侷限於淺肌層,且對腫瘤基底二次電切術陰性的患者可採用,術後行BCG膀胱灌注治療。因基底活檢爲 pT0 或 pT1 的患者中有20%會進展成MIBC而被迫行全膀胱切除,腫瘤特異死亡率佔47%,因此不建議單獨採用,TURBt 作爲 MIBC 保留膀胱的手段。
(5)膀胱部分切除術聯合化療:雖然膀胱部分切除術存在腫瘤局部種植風險,但對應部分依從性好,不適合或不同意膀胱切除的 MIBC 患者,膀胱部分切除聯合化療可作爲MIBC患者的治療選擇之一。
MIBC 患者膀胱部分切除聯合化療或放化療,5 年總生存率爲 53.7%,無進展生存率爲 62.1%,約81.5%成功保留膀胱,生活質量佳。
(六)MIBC 術後輔助化療。
目前 MIBC 患者術後輔助化療的作用尚不完全明確。
多項回顧性研究顯示全膀胱切除術後輔助化療可以延緩復發和改善總生存時間,能臨牀獲益。2014 年一項Meta薈萃分析 945 例 MIBC 患者,顯示 MIBC 患者術後行輔助化療,死亡風險降低 23%(HR 0.77,P=0.049),提高腫瘤特異性生存時間,延長總生存時間。
2016 年的回顧性研究 5653 例pT3~pT4 和/或伴有淋巴結轉移的全膀胱切除術患者,術後 23%進行輔助化療,顯示輔助化療組 5 年生存率爲 37%,化療組爲29.1%,能延長總生存時間(HR 0.70,95% CI 0.06~0.76)。上述回顧性研究的結果分析中可能存在選擇性偏差問題,尚需要大樣本的隨機對照研究來證實輔助化療是否能使患者生存獲益。
因此,根據目前研究結果,MIBC 患者術後常規輔助化療尚缺少充分依據。術後病理爲≤pT2 且無淋巴結轉移或淋巴血管侵犯患者,屬於較低風險,不推薦術後輔助化療。推薦術後病理爲 pT3/4 和/或 pN+M0),特別是術前未接受新輔助化療、高復發風險的 MIBC 患者術後進行以順鉑爲基礎的輔助化療,能改善患者總體生存時間。卡鉑在輔助或新輔助化療中沒有顯示出生存獲益,不能用卡鉑代替順鉑進行輔助或新輔助化療。
(七)MIBC 術後輔助放療。
pT3~4 期 MIBC 患者根治性膀胱切除及盆腔淋巴結清掃術後出現復發轉移的概率高,預後差,其5 年存活率約爲10%~50%,術後輔助放療能提高局部控制率。一項針對 236 例 pT3a~pT4a 膀胱癌患者進行隨機研究顯示:與單純手術相比,術後輔助放療患者的5 年無複發率和局部控制均有改善。
雖然缺乏權威的數據證明術後輔助放療能改善患者OS,但目前認爲根治性膀胱切除或膀胱部分切除術後病理爲pT3/pT4N0~2,有殘存腫瘤或切緣陽性者,病理爲鱗狀細胞癌、腺癌或癌肉瘤、小細胞癌,姑息性切除術後等,進行術後輔助性盆腔放療可提高局部控制率,改善生存,是合理的治療選擇之一。
術後放療範圍包括膀胱切除牀、盆腔淋巴結及可能的腫瘤殘留區,劑量範圍爲 45~50.4Gy;根據正常組織的耐受程度,必要時針對手術切緣周圍延伸區域可提高到54~60Gy,針對腫瘤殘存區域,劑量可增加至 66~70Gy。局部複發性腫瘤,放療劑量爲 66~74Gy。
(八)術後輔助免疫治療。
多項評估免疫檢查點抑制劑(PD-1/PD-L1)術後輔助治療療效的隨機Ⅲ期試驗正常進行中,包括阿替利珠單抗、納武利尤單抗或帕博利珠單抗等,並取得初步結果,但此類藥物的具體輔助治療療效尚需要進一步隨訪驗證,目前僅用於參加臨牀試驗的患者。
表 11 MIBC 膀胱癌患者治療推薦意見

七、轉移性膀胱尿路上皮癌的治療
膀胱癌患者確診是約 10%~15%已發生轉移,根治性膀胱切除術的患者術後約 50%出現復發或轉移,其中局部復發佔10%~30%,其餘大部分爲遠處轉移。尿路上皮癌細胞對於鉑類、吉西他濱、阿黴素及紫杉醇等化療藥物敏感,以鉑類藥物爲基礎的聯合化療是轉移性膀胱尿路上皮癌患者最重要最基本治療方法,總體反應率可達50%左右,總生存時間爲 9~15 個月,若患者化療後再次復發,中位生存時間爲 5~7 個月。
(一)轉移性膀胱尿路上皮癌患者寡轉移瘤的切除。
多項研究證實,部分伴有寡轉移瘤的轉移性膀胱尿路上皮癌患者,轉移瘤切除可能臨牀獲益,特別是對化療反應好、孤立轉移瘤、肺部或淋巴結轉移的患者。寡轉移瘤切除適用於侷限於單個器官;轉移瘤少於3個;最大徑<5cm;無肝臟轉移瘤的膀胱癌患者。膀胱尿路上皮癌肺寡轉移瘤切除術的患者,3 年及5年總體生存率分別爲 59.8%和 46.5%,單發轉移瘤5 年總體生存率爲 85.7%,多發者爲 20%。
一項 Meta 薈萃分析顯示:共412 例轉移膀胱癌患者,與未手術組相比,寡轉移竈切除能提高患者總生存時間,5年總生存率爲 28%~72%,相對爲手術者有所改善。
目前相關研究證據等級不高,且相關手術難度高,必須嚴格選擇合適的患者進行此項手術。
(二)轉移性膀胱尿路上皮癌的一線治療方案。
以鉑類爲基礎的聯合化療方案是轉移性尿路上皮癌的標準治療方案。
根據順鉑耐受程度不同分爲以下2 類(表12):1.能耐受順鉑的患者(患者ZPS 評分0~1 或腎小球濾過率> 50~60 ml/min)
首選推薦:吉西他濱聯合順鉑;ddMVAC 聯合G-CSF。其次:可選擇吉西他濱+紫杉醇+順鉑。化療後患者可選擇阿維魯單抗進行維持治療。
(1) GC 方案(吉西他濱聯合順鉑):
GC 方案是目前臨牀最常用的標準一線治療方案,不良反應較 MVAC 方案輕而療效相似。一般4~6 個週期。推薦用法:
給藥方案一:吉西他濱 1000mg/m2第1、8 天靜脈滴注,順鉑 70mg/m2第 2 天靜脈滴注,每21 天爲1 個週期。給藥方案二:吉西他濱 1000mg/m2 第1、8、15天靜脈滴注,順鉑 70mg/m2 第 1 或第 2 天靜脈滴注,每28 天爲1個週期。
一項採用 GC 方案和 MVAC 方案治療晚期尿路上皮癌Ⅲ期隨機對照研究顯示:入組 405 例患者。兩種方案的療效相似,客觀緩解率分別爲 49.4%和 45.7%,中位總生存時間分別爲14.0 個月和 15.2 個月。其中 GC 方案完全緩解率爲15%,部分緩解率爲 33%,延長生存時間 13.8 個月。兩組患者的5年總生存率分別爲 13.0% 和 15.3%;無進展生存率分別爲9.8%和11.3%。GC 治療組的不良反應相對小。
(2) ddMVAC 方案:
ddMVAC 方案的反應率爲46%,延長生存時間爲 14.8 個月。
一項採用 ddMVAC 方案和傳統MVAC 方案一線治療晚期尿路上皮癌的Ⅲ期隨機對照研究顯示:兩組的客觀緩解率分別爲 62%和 50%,中位無進展生存期爲9.1 個月和8.2 個月;中位總生存時間爲 15.1 個月 14.9 個月;無顯著區別,但ddMVAC方案在相同時間內化療藥物劑量提高而不良反應低,耐受性更好,腫瘤的無進展生存時間及客觀緩解率優於傳統MVAC。另一項類似Ⅲ期隨機研究,比較ddMVAC和標準(28天)MVAC 方案的療效,中位隨訪 7.3 年。結果顯示:ddMVAC治療組有 24.6%患者存活,明顯優於標準MVAC組(13.2%)。根據上述研究結果,目前 ddMVAC 方案已經取代傳統MVAC方案。
推薦用法:甲氨蝶呤 30mg/m2、長春新鹼3mg/m2、多柔比星 30mg/m2、順鉑 70mg/m2,第1 天靜脈滴注,每2周重複。
要求水化,化療期間常規預防性應用G-CSF。
(3)紫杉醇+順鉑+吉西他濱方案(PCG方案)
一項 PCG 方案與 GC 方案一線治療晚期尿路上皮癌Ⅲ期隨機對照研究顯示:兩組的客觀緩解率分別爲55.5%和43.6%,中位無進展生存時間爲 8.3 個月和7.6 個月;中位總生存時間爲15.8 個月 12.7 個月;PCG 方案有效率更高;總生存時間有改善傾向,未增加不良反應。PCG 方案是轉移性尿路上皮一線治療選擇之一。
推薦用法:紫杉醇 80mg/m2 第1、8 天靜脈滴注,順鉑70mg/m2第 1 天或第 2 天靜脈滴注,吉西他濱1000mg/m2第1、8 天靜脈滴注,每 21 天爲 1 個週期。
2.不能耐受順鉑的患者(ZPS 評分2 或腎小球濾過率30~60ml/min)
首選:卡鉑聯合吉西他濱;化療後患者可選擇進行阿維魯單抗維持治療。阿替利珠單抗或帕博利珠單抗,兩種免疫治療藥適用於 PD-L1 表達陽性或不能耐受鉑類化療的患者。其次推薦:吉西他濱+紫杉醇;吉西他濱單藥化療。特殊情況可考慮用異環磷酰胺、阿黴素和吉西他濱。
(1)卡鉑聯合吉西他濱,推薦用法:
卡鉑按照濃度-時間曲線下面積(area under the concentration-time curve,ACU)=4.5 計算,第 1 天靜脈滴注,吉西他濱1000mg/m2第1、8天靜脈滴注,每 21 天爲 1 個週期。
(2)吉西他濱聯合紫杉醇,推薦用法:
吉西他濱1000mg/m2 第 1、8 天靜脈滴注,紫杉醇80mg/m2 第1、8天靜脈滴注,每 21 天爲 1 個週期。
(3)吉西他濱單藥化療,推薦用法:
①吉西他濱1000mg/m2 第 1、8 天靜脈滴注,每21 天爲1 個週期。②吉西他濱 1250mg/m2 第 1、8、15 天靜脈滴注,每28 天爲1個週期。
(4)免疫治療:
免疫治療是應用針對PD-1 或其配體PD-L1 的抗體,通過阻斷 PD-1/PD-L1 信號通路,利用人體自身的免疫系統殺傷癌細胞,改善患者總生存時間。以 PD-1/PD-L1 單抗爲代表的免疫檢查點抑制劑能顯著提高晚期尿路上皮癌二線療效。
目前 FDA 已批准免疫藥物主要包括:PD-L1 抑制劑:阿替利珠單抗(atezolizumab)、度伐魯單抗(durvalumab)、阿維魯單 抗 ( avelumab ) 等 。 PD-1 抑制劑:帕博利珠單抗(pembrolizumab)、納武利尤單抗(nivolumab)等。主要用於接受以鉑類爲基礎的聯合化療治療中或治療後12個月內出現進展的局部進展期或轉移性尿路上皮癌患者的二線治療。阿替利珠單抗及帕博利珠單抗也可以用於不能耐受鉑類化療、PD-L1 陽性的晚期尿路上皮癌患者的一線治療。
①能耐受鉑類化療患者的一線免疫治療:最新公佈2項Ⅲ期試驗的結果(IMvigor130 研究及KEYNOTE 361 研究),應用免疫檢查點抑制劑一線治療能耐受鉑類化療的晚期或轉移性膀胱癌尿路上皮癌患者。對能耐受鉑類化療的晚期或轉移性膀胱癌患者,與單純鉑化療相比,化療聯合帕博利珠單抗或阿替利珠單抗,兩組無進展生存時間和總生存時間均無統計學差異,無顯著生存獲益。
目前不推薦應用免疫檢查點抑制劑聯合化療或IO-IO一線治療能耐受鉑類化療晚期膀胱癌患者。
②不能耐受鉑類化療患者的一線免疫治療:Ⅱ期臨牀研究(KEYNOTE-052),評估帕博利珠單抗作爲一線治療不能耐受鉑類化療的晚期或轉移性尿路上皮癌尿路上皮癌患者;共入組370 例,總有效率爲 24%,5%患者達到完全緩解,19%達到部分緩解。6 個月總生存率爲 67%。Ⅱ期臨牀研究(IMvigor-210),評估阿替利珠單抗作爲一線治療不能耐受鉑類藥物化療的局部晚期或轉移性尿路上皮癌患者;共入組 119 例,客觀緩解率爲23%,9%的患者完全緩解;中位總生存時間爲 15.9 個月。3 級及以上的不良反應發生率爲 16%。
推薦:阿替利珠單抗及帕博利珠單抗可用於不能耐受鉑類化療且 PD-L1 表達陽的晚期或轉移性尿路上皮癌患者的一線治療。
表 12 局部晚期或轉移性膀胱尿路上皮癌者的一線治療

(三)轉移性膀胱尿路上皮癌一線化療後的維持治療。
以鉑類爲基礎的化療治療轉移性膀胱尿路上皮癌中位無進展生存時間爲 6~9 個月,患者會再次進展。免疫治療能延緩復發及改善生存時間。
晚期膀胱癌患者接受一線化療4~6 個週期後,病情穩定或客觀有效的患者可選擇維持治療:推薦患者首選參加新藥臨牀研究;其次可選擇阿維魯單抗,可考慮帕博利珠單抗。
1.阿維魯單抗:
一項Ⅲ期隨機對照研究(JAVELINBladder100 研究)晚期尿路上皮癌患者接受一線化療後病情穩定,接受阿維魯單抗或支持治療。結果顯示:阿維魯單抗組患者中位總生存時間爲 21.4 個月,顯著優於單純支持治療組的14.3個月(HR 0.69,P=0.0005),能顯著改善患者的無進展生存時間,分別爲 3.7 個月和 2.0 個月,所有亞組患者均生存獲益。47.4%患者出現≥3 級的不良反應,對照組爲25.2%。用法:阿維魯單抗 10mg/kg,每2 周給藥1 次。
2.帕博利珠單抗:
一項Ⅱ期隨機對照研究108 例一線化療後病情穩定的晚期尿路上皮癌患者,接受帕博利珠單抗和安慰劑維持治療。顯示帕博利珠單抗能顯著延長無進展生存時間,分別爲 5.4 個月和 3 個月。客觀緩解率分別爲23%或10%。總生存時間分別爲 22 個月和 18.7 個月,無統計學差別。用法:帕博利珠單抗 200mg,每3 周給藥1次。
(四)轉移性膀胱尿路上皮癌的二線治療方案。
與傳統的化療方案相比,目前研究顯示以免疫檢查點抑制劑(PD-1/PD-L1 單抗)爲主的免疫治療能顯著提高晚期尿路上皮癌患者的二線治療的有效率。推薦所有轉移性膀胱尿路上皮癌患者積極參加新藥的臨牀試驗研究,免疫檢查點抑制劑是患者優先考慮的二線治療方案(表13、表14)。
1.免疫治療藥物
(1)替雷利珠單抗:
替雷利珠單抗用於晚期尿路上皮癌治療失敗後的二線治療,Ⅱ期研究結果顯示:客觀緩解率爲23.1%,中位無進展生存時間爲2.1 個月,中位總生存時間爲9.8 個月。我國已批准用於既往鉑類化療失敗的局部晚期或轉移性 PD-L1 高表達的尿路上皮癌患者。用法:替雷利珠單抗每次 200mg,每3 周給藥1 次。
(2)特瑞普利單抗:
一項特瑞普利單抗治療既往治療失敗的晚期尿路上皮癌的Ⅱ期研究。其客觀有效率爲25.2%,其中,PD-L1 陽性患者的客觀緩解率爲39.6%,中位無進展生存時間爲 2.3 個月。
用法:特瑞普利單抗每次 3mg/kg,每2 周給藥1 次。
(3)帕博利珠單抗:
一項Ⅲ期隨機研究(KEYNOTE-045),比較帕博利珠單抗與化療(紫杉醇、多西他賽、長春氟寧)療效,共入組 542 例既往接受過鉑類化療後出現復發或進展的晚期膀胱尿路上皮癌患者。結果顯示:帕博利珠單抗比對照組顯著改善患者生存時間,總生存時間分別爲10.3個月和7.4 個月(P=0.002),客觀緩解率分別爲21.1%和11.4%。帕博利珠單抗組的不良反應發生率爲15.0%,顯著優於化療組(49.4%)。分析隨訪 2 年的研究結果,顯示,帕博利珠單抗組的中位持續緩解時間未到,而化療組爲4.4 個月,且不良反應發生率更低(62% 和 90.6%),可用於此類患者的二線治療。
用法:帕博利珠單抗每次 200mg,每3 周給藥1 次。
(4)阿替利珠單抗:
阿替利珠單抗是FDA批准的第一個PD-L1 抑制劑: Ⅱ期研究(IMvigor 210)共310 例既往接受過鉑類藥物治療的轉移性膀胱尿路上皮癌患者,治療組總反應率爲 15%,顯著高於對照組 10%(P=0.0058),中位隨訪11.7個月,84%(38/45)的患者仍有效果。對治療進展後結果分析顯示:與接受其他藥物治療(6.8 個月)和未接受進一步治療(1.2 個月)患者相比,繼續服用阿替利珠單抗的患者進展後總生存時間更長(8.6 個月)。
一項多中心Ⅲ期隨機對照研究(IMvigor211),比較阿替利珠單抗與化療(紫杉醇、多西他賽、長春氟寧)療效。共931例既往接受過鉑類藥物化療後出現復發或進展的晚膀胱尿路上皮癌患者。中位隨訪 17.3 個月,阿替利珠單抗治療組中位總生存時間爲 11.1 個月,與化療組(10.6 個月)沒有顯著區別(P=0.41)。客觀緩解率分別爲 23%及22%,沒有顯著差別。雖然兩組間總生存時間無顯著區別,但阿替利珠單抗治療組3級及以上的不良反應發生率爲 20%,明顯低於化療組(43%)。
(5)阿維魯單抗(avelumab):
Ⅱ期研究:共249例既往以鉑類藥物化療無效或不適合鉑類藥物治療的轉移性膀胱尿路上皮癌患者,阿維魯單抗治療的客觀緩解率爲17%,其中6%爲完全緩解,11%爲部分緩解。PD-L1 表達陽性(≥5%)客觀緩解率(24%)顯著優於 PD-L1 表達陰性患者(13%)。中位總生存時間爲 6.5 個月,PD-L1 表達陽性者爲8.2 個月,陰性者爲6.2 個月。PD-L1 表達陽性者無進展生存時間優於陰性者(11.9個月和 6.4 個月)。3 級不良反應8%。
(6)納武利尤單抗 :
納武利尤單抗的Ⅱ期研究(Checkmate 275):265 例既往接受過鉑類藥物治療出現進展的轉移性膀胱尿路上皮癌患者,治療組客觀緩解率爲19.6%,中位總生存時間 8.74 個月,3 級及以上的不良反應發生率爲18%。PD-L1 表達率≥1%患者中位總生存時間爲11.3個月,明顯優於 PD-L1 表達率<1%患者(5.95 個月)。分析最新數據,最短隨訪時間 37.7 個月,納武利尤單抗單藥治療的客觀緩解率爲 25.6%(95% CI 16.4%~36.8%),持續緩解時間中位數爲30.5 個月。
(7)度伐利尤單抗:
Ⅱ期研究分析191 例PD-L1陽性不適合手術或轉移性膀胱尿路上皮癌化療後進展的患者。接受度伐利尤單抗治療患者客觀緩解率爲17.8%,PD-L1 高表達者爲27.6%;低表達或不表達者爲 5.1%。所有患者的中位總生存時間爲 18.2 個月,PD-L1 高表達者爲20 個月。55%患者隨訪1年時存活。
最新Ⅲ期臨牀研究(DANUBE)結果,比較度伐利尤單抗和化療用於晚期尿路上皮癌的一線治療的療效。結果顯示:該研究未達到主要終點,與化療相比,單獨使用度伐利尤單抗或聯合使用 Tremelimumab 均未能提高總生存率,結果爲陰性。免疫治療可誘發免疫相關不良事件(immune-relatedadverse events,irAE),常見的不良反應包括瘙癢、乏力、噁心、腹瀉、無食慾、皮疹、發熱等,耐受性良好,致死性irAE發生率爲 0.64%,需要引起重視。
2.化療
有多個研究顯示:多西他賽、紫杉醇、白蛋白紫杉醇、長春氟寧、培美曲賽、吉西他濱+紫杉醇等化療藥物用於晚期尿路上皮癌的二線治療,並取得一定療效,但有效率均不高,且證據等級不高,需要進一步臨牀研究證實。
3.靶向藥物治療
厄達替尼是一種 FGFR 抑制劑,國外已經批准用於存在FGFR3 或 FGFR2 基因突變的鉑類化療失敗的局部晚期或轉移性尿路上皮癌患者。
BLC2001 研究厄達替尼治療99 例合併FGFR基因突變的既往化療失敗的晚期尿路上皮癌患者。其客觀緩解率爲40%(95% CI 31%~50%),完全緩解率爲3%,疾病控制率爲79%,中位無進展生存時間爲 5.5 個月,中位總生存時間爲13.8個月。
用法:厄達替尼片:每次 10mg,每日1 次口服,第1~7天,其後休息 1 周後重復,每 28 天爲一週期。
表 13 晚期或轉移性膀胱尿路上皮癌患者二線治療(鉑類化療失敗)

表 14 晚期或轉移性膀胱尿路上皮癌者的二線治療(免疫檢查點抑制劑治療失敗)

(五)轉移性膀胱癌的三線治療方案(表15)。
隨着新型化療藥物、靶向藥物及免疫檢查點抑制劑的出現,晚期膀胱癌的三線治療可供選擇藥物顯著增多,並取得一點療效。此類患者均推薦積極參加相關新藥的臨牀研究。既往未進行免疫治療的患者,優先推薦行PD-1/PD-L1 單抗的免疫治療。存在 FGFR2/3 基因變異的免疫治療失敗患者,可選擇厄達替尼治療,其客觀有效率達 59%。抗體偶聯藥物 Enfortumab Vedotin(EV)由腫瘤表面分子Nectin-4 的單克隆抗體與微管破壞劑MMAE 構成。EV-201 研究 EV 治療 125 例既往順鉑爲基礎化療或PD-1/PD-L1 免疫檢查點抑制劑治療失敗的轉移性尿路上皮癌患者,其客觀緩解率爲 44%,完全緩解率爲12%。中位無進展生存時間爲 5.8 個月,中位總生存時間爲11.7 個月,持續緩解時間爲 7.6 個月,54%患者發生≥3 級復副反應。美國已批准EV用於順鉑化療失敗或免疫治療失敗的轉移性尿路上皮癌的治療。一項比較 EV 與單藥化療的Ⅲ期RCT 初步結果顯示有顯著生存獲益。EV 聯合帕博利珠單抗作爲順鉑不耐受的局部晚期/轉移性尿路上皮癌患者的一線治療的結果:客觀緩解率爲73.3%,完全緩解率爲 15.6%。
用法:EV 注射劑:1.25mg/kg,第1、8、15 天,每28天爲一週期。
表 15 晚期或轉移性膀胱尿路上皮癌者的三線治療

(六)免疫檢查點抑制劑新探索。
目前預測患者是否對免疫治療有效的生物標記物包括PD-L1 的表達水平、膀胱癌分子分型、腫瘤突變負荷、基因標籤、ZPS 評分及轉移瘤情況等。
免疫檢查點抑制劑主要用於晚期尿路上皮癌的二線治療及一線治療。目前大量的臨牀研究正在進行中,包括新輔助免疫治療、輔助免疫治療、與其他藥物聯合治療及NMIBC患者治療等。尚處於臨牀研究階段,希望取得有效成果。
八、膀胱癌的放療
放療是膀胱癌患者治療方法之一,單純放療療效低於根治性膀胱切除聯合盆腔淋巴結清掃術患者。放療適用於不願意接受或無法耐受根治性膀胱切除術的MIBC 患者術。放療是保留膀胱綜合治療方法之一(表 16)。
(一)MIBC 患者術前放療。
T3~4 或 N+切除困難的 MIBC 患者,術前同步化放療可使腫瘤縮小降期,利於手術。4~6 周後出現病理降期達(9%~34%)。MIBC 患者術前新輔助放療一般放射劑量爲40~45Gy/4~5 周。
術前化放療或放療有降期作用,但是否能減少MIBC患者根治性膀胱切除術後的局部複發率,是否能延長總生存時間尚缺乏高質量研究證據。有薈萃分析顯示MIBC患者術前新輔助放療 5 年總生存率無顯著差異。目前不推薦常規術前放療。
(二)放療保留膀胱的綜合治療。
MIBC 患者保留膀胱的綜合治療中,經cTURBt 聯合GC方案化療及放療的療效顯著優於單純放療。5 年總生存率爲48%,保留膀胱率約爲 70%。國家癌症中心研究數據顯示MIBC 患者接受同步化放療的療效明顯優於單純放療,3年總生存率分別爲 64%和 30%。
多學科保留膀胱的綜合治療,腫瘤完全緩解率約爲60%~85%,5 年保留膀胱率爲40%~80%,5 年總生存率爲50%~60%。因此對部分侷限性 MIBC 患者可作爲除根治性膀胱切除術外的可選擇方案之一。
(三)根治性放療。
根治性放療適用於不耐受或不接受膀胱切除術的MIBC患者,不推薦單純採用放療,作爲保留膀胱綜合治療一種手段。MIBC 患者的放療推薦採用圖像引導的調強適形放療。靶區包括腫瘤區域、膀胱及部分尿道、盆腔淋巴引流區等。根治性放療推薦劑量爲 60~66Gy,分次劑量爲1.8~2.0 Gy。整個療程不超過 6~7 周。放療日程爲:①50~55Gy,分25~28次完成(>4 周);② 64~66Gy,分 32~33 次完成。放療的局部控制率約爲 30%~50%,MIBC患者5年總生存率爲 40%~60%,腫瘤特異性生存率爲35%~40%,局部複發率約爲 30%。
(四)姑息性放療。
放療是晚期膀胱癌患者減輕症狀的姑息性治療手段之一。適用於保守治療無效、保留膀胱治療後復發;非尿路上皮癌的治療;局部晚期膀胱癌(cT4b,侵及盆腔或腹壁)合併嚴重血尿、疼痛、排尿困難及尿路梗阻、瘻管形成。姑息性放療能改善因膀胱腫瘤引起血尿、疼痛及骨轉移疼痛等症狀,改善生活質量。90%患者有效,約50%症狀完全緩解,22%患者總生存時間延長 7 個月。姑息性放療一般採用大分割劑量方案,可採用30~35Gy/10次/2 周或 30Gy/5~6 次/2~3 周方案。放療的不良反應包括:放射性膀胱炎、尿道炎、直腸炎、小腸炎、骨髓抑制及性功能影響等。總髮生率爲20%~60%。嚴重併發症約 3%~5%作用。
表 16 膀胱癌患者放療推薦意見
| 膀胱癌患者放療推薦意見 | 推薦等級 |
| 不能手術的 MIBC(cT3~4 和/或 pN+),可選擇化療、同步化放療的綜合治療 | 強烈推薦 |
| 不能手術的 MIBC(cT3~4 和/或 pN+),可選擇同步化放療降期 | 推薦 |
| 單發竈(cT2~3N0M0、≤3cm、無尿路梗阻、無原位癌及腎功能損傷、膀胱容量正常),可選擇 TURBt、化療、同步化放療的綜合治療 | 推薦 |
| 切緣陽性、T4N±、姑息性切除術後病理爲鱗狀細胞癌、腺癌或癌肉瘤、小細胞癌等,術後放療或化放療 | 推薦 |
| 局部晚期伴疼痛、血尿、排尿困難及骨痛,姑息性放療或化放療推薦採用圖像引導的調強適形放療 | 強烈推薦 |
九、不能根治的膀胱癌的治療
(一)cT4b 期伴或不伴淋巴結陽性患者的治療。
1.cT4b 期膀胱癌治療
化療或放療聯合化療是 cT4bM0 患者的基本治療方法。患者化療或同步化放後 2~3 個月後評估,若完全緩解,可繼續鞏固化療或根治性放療或姑息性膀胱切除術;若評估仍有腫瘤殘存,建議更換化療方案繼續化療、姑息性膀胱切除術或放療。如伴發嚴重血尿、輸尿管腎嚴重積水等可姑息性膀胱切除並尿流改道。
2.M1a 期膀胱癌治療
應進行全身化療或同步化放療。完全緩解患者可選擇膀胱切除術或鞏固放化療或密切隨訪觀察。部分緩解患者可進一步增加放射劑量或姑息性膀胱切除術或參考轉移性癌治療方法。腫瘤進展的患者參考轉移性癌治療方案。
(二)盆腔多發淋巴結轉移膀胱癌治療(cN2~3 期)。
cN2~3 期膀胱癌患者預後差,治療方法包括化療或同步化放療。根據治療效果,結合患者具體狀態選擇後續治療方案。若評估達到完全緩解,隨後可選擇姑息性膀胱切除、同步放化療或隨訪觀察;若部分緩解,可選擇姑息性膀胱切除、同步放化療。若疾病進展,需按照轉移性膀胱癌進行系統治療。美國一項研究共入組 1783 例cN+膀胱癌患者,分爲單純化療組(1388 例),化療聯合放療組爲395 例。結果顯示:接受同步化放療的患者中位總生存時間爲19.0 個月,顯著高於單純化療組 13.8 個月(P<0.001)。
(三)姑息性膀胱切除。
對於手術無法治癒的局部晚期膀胱癌患者(T4b),常伴有出血、疼痛、排尿困難和尿路梗阻。對於頑固性血尿的膀胱癌患者,若其他治療無效情況下,姑息性膀胱切除及尿流改道是有效治療方法,但手術風險較高。局部晚期膀胱癌導致輸尿管梗阻、尿毒症,可選擇姑息性膀胱切除及輸尿管造口或永久性腎造瘻術以解除梗阻,改善腎功能,利用化療。
(四)對症治療。
不能根治的膀胱癌患者常存在以下問題:疼痛、出血、排尿困難和上尿路梗阻。對症治療有重要意義。
1.上尿路梗阻
首選輸尿管內支架;腎造瘻可以有效解決上尿路梗阻;若輸尿管支架管難以順利置入,尿流改道(加或不加姑息性膀胱切除)也是解除上尿路梗阻的有效措施之一。
2.出血和疼痛
對於無法根治的膀胱癌患者出現血尿,首先要明確患者是否存在凝血功能障礙或是否用抗凝藥物。出血不嚴重者可膀胱持續沖洗;沖洗無效者,可予膀胱內灌注1%硝酸銀或1%~2%的明磯以達到止血效果,無需麻醉。系統評估後對持續沖洗無效者可選擇經尿道電凝或激光凝固止血。膀胱腫瘤巨大,可選擇放療以起到止血鎮痛作用,其止血、鎮痛的控制率分別爲59%及 73%。若上述各種方法均無法控制出血,可選擇膀胱動脈栓塞或膀胱切除聯合尿流改道等。
(五)膀胱切除或放療後復發。
10%~50%的膀胱切除術後患者會出現局部復發或者轉移,治療方法包括化療、同步放化療、免疫檢查點抑制劑治療或放療等,不同治療方案可以聯合應有,以取得最優療效。
十、隨訪
膀胱癌患者接受根治性膀胱切除術和尿流改道術後必須進行長期隨訪,隨訪目的是評估腫瘤是否復發轉移、是否存在與尿流改道相關的併發症等。
膀胱癌術後復發轉移風險與組織病理類型及分期有關,術後 24~36 個月發生率最高,以後相對低。常規推薦:pT1 期患者每年進行一次檢查、血液生化檢查、胸部 X 線檢查、腹盆腔 B 超檢查、CT 和/或MRI 檢查;pT2 期患者 6 個月進行 1 次上述檢查;pT3 期腫瘤患者每3個月進行 1 次。對於 pT2~pT3 期腫瘤患者應該每半年進行1次胸腹盆腔 CT 檢查。上尿路影像學檢查對於排除輸尿管狹窄和上尿路腫瘤很有價值。
十一、膀胱非尿路上皮癌
膀胱非尿路上皮癌主要包括膀胱鱗狀細胞癌、腺癌、神經內分泌腫瘤(小細胞癌)等。治療原則是首選根治性膀胱切除術(表 17)。
(一)膀胱鱗狀細胞癌。
膀胱鱗狀細胞癌約佔膀胱惡性腫瘤的2.5%。女性發病率略高於男性。可分爲非血吸蟲病性膀胱鱗狀細胞癌和血吸蟲病性膀胱鱗狀細胞癌,在我國主要是前者。細菌感染、異物、慢性下尿路梗阻或膀胱結石等引起的慢性炎症,膀胱黏膜白斑、長期留置導尿管等可能與膀胱鱗狀細胞癌的發生有關。
膀胱鱗狀細胞癌多發於膀胱三角區和側壁,一般呈潰瘍和浸潤,約 8%膀胱鱗狀細胞癌確診時已經發生轉移。血尿是主要的臨牀表現,93%的患者伴有泌尿系統感染。診斷主要靠膀胱鏡檢查及活檢明確病理類型。主要治療手段是手術切除,部分患者可選擇放療。單純膀胱鱗狀細胞癌患者推薦行根治性膀胱切除術;部分患者可選擇膀胱部分切除術。根治性膀胱切除術療效優於放療。目前尚缺少術前新輔助化療或輔助化療有效的證據。高級別、高分期患者術前放療加根治性膀胱切除術比單純根治性膀胱切除術效果更好,有助於預防盆腔復發。術後切緣陽性患者術後放療;單純放療效果欠佳,不推薦單獨應用。部分晚期或轉移性膀胱鱗狀細胞癌患者可選擇紫杉醇、異環磷酰胺和順鉑的聯合化療,但有效率低。膀胱鱗狀細胞癌的 5 年生存率約爲25%,其中非肌層浸潤性鱗狀細胞癌爲 33%,肌層浸潤性癌爲28%,轉移性鱗狀細胞癌爲 6%。
(二)腺癌。
膀胱腺癌約佔膀胱惡性腫瘤的1.5%。根據組織來源膀胱腺癌可分爲三種類型:原發性非臍尿管腺癌、臍尿管腺癌、轉移性腺癌。診斷主要依據膀胱鏡活檢病理。超聲、CT以及MRI等檢查可顯示腫瘤大小、侵犯範圍及臨牀分期,特別是對臍尿管腺癌。針對膀胱腺癌或臍尿管癌患者,目前尚缺少術前新輔助化療或輔助化療有效的證據。治療主要選擇手術切除,部分患者可選擇放療。
1.非臍尿管腺癌
非臍尿管腺癌與移行上皮腺性化生有關係。長期慢性刺激、梗阻及膀胱外翻是引起化生的常見原因,常伴腺性膀胱炎。
膀胱腺癌主要症狀有血尿、尿痛、膀胱刺激徵、黏液尿。原發性膀胱腺癌多發生於膀胱三角區及膀胱側壁,病變進展較快,多爲 MIBC。
病理類型分爲:乳頭狀(腸型)、黏液型、印戒細胞型、非特異型及混合型。印戒細胞型腺癌預後差。臨牀就診時大多數已屬局部晚期,推薦行根治性膀胱切除術。經尿道切除或膀胱部分切除的療效差。術後輔以放療能提高腫瘤無復發生存率。進展期和已遠處轉移的膀胱腺癌患者可以選擇化療,推薦選用以 5-氟尿嘧啶爲基礎的化療方案。
2.臍尿管腺癌
臍尿管腺癌與臍尿管上皮增生及其內覆移行上皮腺性化生有關,約佔膀胱腺癌的 1/3。臍尿管腺癌發生在膀胱頂部前壁,可浸潤到膀胱壁深層、臍、恥骨後間隙及前腹壁。臍尿管腺癌診斷時分期較高,有較高的遠處轉移風險。臍尿管腺癌的臨牀分期:一般採用Sheldon 分期:Ⅰ期:腫瘤侷限於臍尿管黏膜;Ⅱ期局部侵犯突破黏膜但侷限於臍尿管;Ⅲ期:局部累及膀胱、腹壁、腹膜及其他鄰近器官;Ⅳ期:局部淋巴結轉移、遠處轉移。臍尿管腺癌的治療:手術治療是最主要的治療手段,包括擴大性膀胱部分切除術和根治性膀胱切除術,聯合盆腔淋巴結清掃術。放療和化療的效果不佳。擴大性膀胱部分切除術:整塊切除膀胱頂、臍尿管和臍,切除範圍包括部分腹直肌、腹直肌後鞘、腹膜及弓狀線。術後復發和轉移是治療失敗的主要原因,一般術後2 年內發生。淋 巴 結 轉 移 的 腺 癌 患 者 可參考用結直腸化療方案:FOLFOX(奧沙利鉑、亞葉酸和5-氟尿嘧啶)或GemFLP(5-氟尿嘧啶、亞葉酸、吉西他濱和順鉑)或ITP(紫杉醇、異環磷酰胺和順鉑)方案。
美國 2 項研究顯示:手術切緣是否陰性及淋巴結是否轉移是影響預後的重要因素,5 年總生存率爲40%,平均生存46個月。其中 I/Ⅱ期爲 10.8 年,Ⅲ/Ⅳ爲1.3 年。3.轉移性腺癌
轉移性腺癌是常見的膀胱腺癌,原發病竈包括直腸、胃、子宮內膜、乳腺、前列腺和卵巢等。治療上以處理原發病爲主的綜合治療。
(三)膀胱小細胞癌。
組織學上類似肺小細胞癌。腫瘤多發於膀胱兩側壁和膀胱底部。膀胱小細胞癌瘤體較大,平均約5cm。侵襲性高且容易轉移。就診時患者常有深肌層浸潤。膀胱小細胞癌的診斷包括:膀胱鏡檢查及活檢明確病理;影像學檢查明確侵犯範圍及是否轉移。治療方案一般採用輔助化療或新輔助化療聯合局部治療的綜合治療方案。膀胱小細胞癌患者新輔助或輔助化療方案推薦採用小細胞肺癌的化療方案,能耐受順鉑的患者,選擇順鉑聯合依託泊甙方案;不能耐受順鉑的患者,選擇依託泊苷聯合卡鉑方案。局部治療推薦根治性膀胱切除術或放療。研究認爲新輔助化療聯合根治性全膀胱切除術能顯著提高生存率。術後病理分期爲 T3、T4 期建議術後輔助化療。
表 17 膀胱非尿路上皮癌患者治療推薦意見:
| 膀胱癌化療推薦意見 | 推薦等級 |
| 手術治療 | |
| 膀胱非尿路上皮癌的治療原則是選擇根治性膀胱切除術 | 強烈推薦 |
| 高分級、高分期的膀胱鱗癌術前放療可改善預後 | 推薦 |
| 臍尿管腺癌選擇擴大性膀胱部分切除術+盆腔淋巴結清掃 | 強烈推薦 |
| 非臍尿管腺癌建議行根治性膀胱切除術,輔助放療或/和化療 | 可選擇 |
| 推薦 T3,T4 期膀胱小細胞癌術後行輔助化療 | 推薦 |
| 輔助放療 | |
| 腫瘤殘存、切緣陽性、鱗癌、腺癌或癌肉瘤、小細胞癌等 | 推薦 |
十二、膀胱癌患者的生活質量
健康相關生活質量研究目前已被廣泛應用於腫瘤臨牀治療方法的篩選、治療效果的評價等方面。
膀胱癌患者生活質量評估包含身體、情緒、社會活動方面的內容以及相關的併發症(如排尿問題、尿瘻、皮膚問題、性功能問題等)。生活質量測定主要是通過量表評估。目前膀胱癌研究中應用較多的生活質量測定量表包括FACT、EORTCQLQ-C30、FACT-BL 和 FACT-VCI。
泌尿外科醫師需充分重視膀胱癌患者的相關生活質量。治療前,醫師應該與患者就治療方法選擇及其併發症進行充分討論,以使患者治療後獲得最佳的生活質量。
附件 膀胱癌診療指南(2022 年版)編寫審定專家組(按姓氏筆畫排序)
組長:邢念增
成員:王鐵、馮曉莉、劉玉林、劉敏、紀志剛、李肖、李炯明、張勇、周芳堅、周愛萍、徐萬海、徐濤、高獻書、管考鵬、翟青、魏強