1 拼音
yī cì xìng shǐ yòng shǒu shù yī chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《一次性使用手術衣產品註冊技術審查指導原則》由國家食品藥品監督管理局於2011年5月11日食藥監辦械函[2011]187號印發。
本指導原則旨在指導和規範一次性使用手術衣產品的技術審評工作,幫助審評人員理解和掌握該類產品結構、性能、預期用途等內容,把握技術審評工作基本要求和尺度,對產品安全性、有效性做出系統評價。
本指導原則所確定的主要內容是在目前的科技認識水平和現有產品技術基礎上形成的,因此,審評人員應注意其適宜性,密切關注適用標準及相關技術的最新進展,考慮產品的更新和變化。
本指導原則不作爲法規強制執行,不包括行政審批要求。但是,審評人員需密切關注相關法規的變化,以確認申報產品是否符合法規要求。
3 二、技術審評要點
3.1 (一)產品名稱的要求
產品名稱應以預期用途爲依據命名,產品名稱爲一次性使用手術衣。
3.2 (二)產品的結構和組成
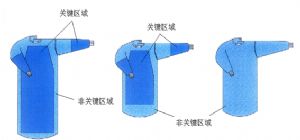
一次性使用手術衣爲手術人員穿着以防止感染原傳播的長袍,由前身、後身、袖子、繫帶等組成。
產品圖示舉例:
3.3 (三)產品適用的相關標準
GB 15980-1995 一次性使用醫療用品衛生標準
GB 18278-2000 醫療保健產品滅菌確認和常規控制要求 工業溼熱滅菌
GB 18279-2000 醫療器械 環氧乙烷滅菌確認和常規控制
GB 18280-2000 醫療保健產品滅菌確認和常規控制要求 輻射滅菌
GB/T 16886.1-2001 醫療器械生物學評價 第1部分:評價與試驗
GB/T 16886.7-2001 醫療器械生物學評價 第7部分:環氧乙烷滅菌殘留量
GB/T 16886.10-2005 醫療器械生物學評價 第10部分:刺激與遲髮型超敏反應試驗
GB/T 14233.1-2008 醫用輸血、輸液、注射器具檢測方法 第1部分:化學分析方法
GB/T 14233.2-2008 醫用輸血、輸液、注射器具檢測方法 第2部分:生物試驗方法
YY/T 0313-1998 醫用高分子製品包裝、標誌、運輸和貯存
YY/T 0287-2003 醫療器械 質量管理體系用於法規的要求
YY 0466-2003 醫療器械 用於醫療器械標籤、標記和提供信息的符號
YY/T 0615.1-2007 標示“無菌”醫療器械的要求 第1部分:最終滅菌醫療器械的要求
YY/T 0316-2008 醫療器械 風險管理對醫療器械的應用
YY /T 0506.1 病人、醫護人員和器械用手術單、手術衣和潔淨服第1部分:製造廠、處理廠和產品的通用要求
YY /T 0506.2 病人、醫護人員和器械用手術單、手術衣和潔淨服第2部分:性能要求和性能水平
YY /T 0506.3 病人、醫護人員和器械用手術單、手術衣和潔淨服第3部分:試驗方法
YY /T 0506.4 病人、醫護人員和器械用手術單、手術衣和潔淨服第4部分:幹態落絮試驗方法(ISO9073-10:2003,IDT)
YY /T 0 506.5 病人、醫護人員和器械用手術單、手術衣和潔淨服第5部分:阻幹態微生物穿透試驗方法
YY /T 0506.6 病人、醫護人員和器械用手術單、手術衣和潔淨服第6部分:阻溼態微生物穿透試驗方法
產品適用及引用標準的審查可以分兩步來進行。首先對引用標準的齊全性和適宜性進行審查,也就是在編寫註冊產品標準時與產品相關的國家、行業標準是否進行了引用,以及引用是否準確。可以通過對註冊產品標準中“規範性引用文件”是否引用了相關標準,以及所引用的標準是否適宜來進行審查。此時,應注意標準編號、標準名稱是否完整規範,年代號是否有效。
其次對引用標準的採納情況進行審查。即所引用標準中的條款,是否在註冊產品標準中進行了實質性的條款引用。這種引用通常採用兩種方式,內容繁多的、複雜的可以直接引用標準及條文號,比較簡單的也可以直接引述具體要求。
如有新版國家標準、行業標準發佈實施,應執行最新版本的國家標準、行業標準。
3.4 (四)產品的預期用途
一次性使用手術衣用於防止手術過程和其他有創檢查中病人和醫護人員之間感染原的傳播。
高性能手術衣:適用於病人血液中已知有傳染性病毒或緊急搶救時未知血液中是否有傳染性病毒的手術。
3.5 (五)產品的主要風險
一次性使用手術衣產品的風險分析報告應符合YY/T 0316-2008《醫療器械 風險管理對醫療器械的應用》的有關要求。審查要點包括:
(1)產品風險定性定量分析是否準確(依據YY/T 0316-2008附錄E);
(2)危害分析是否全面(依據YY/T 0316-2008附錄A);(3)風險可接收準則,降低風險的措施及採取措施後風險
的可接收程度,是否有新的風險產生。
以下依據YY/T 0316的附錄D從三個方面列舉了一次性使用手術衣產品的危害因素,提示審查人員從以下方面考慮。
類型 | 可能產生的危害 | 形成因素 | 控制措施 |
生物污染 | |||
生產引入了外來有害物質沒有被有效去除;環氧乙烷殘留量超標 | |||
不適當的標籤 | 外部標記不全面、標記不正確或不能夠清楚易認 | 標記印刷清晰正確;標記內容按相關要求標記全面。 | |
介紹上的注意事項不全 | 如缺少詳細的使用方法、缺少必要的警告說明; 產品等級標示不清 | 規範介紹; 介紹上提示 | |
由不熟練或未經訓練的人員使用 | 使用者未經培訓或培訓不足,不能正確使用產品; | 使用前培訓 | |
介紹中未包含只限一次性使用 | 規範介紹 | ||
不適當的預期用途表述 | 介紹中未能清楚表明產品用途 | 規範介紹 | |
不適當的產品包裝 | 生產、運輸、搬運和儲存過程中導致包裝破損; 包裝封口不嚴密; 包裝材料選擇不適當 | 規範包裝 | |
失去產品的完整性 |
3.6 (七)品的主要技術指標
本條款給出一次性使用手術衣產品需要評價的性能要求,其中部分性能要求給出了定量要求,其他性能要求企業可參考相應的國家標準、行業標準,根據企業自身產品的技術特點制定相應的要求,但不得低於相關強制性國家標準、行業標準的有關要求。如有不適用條款(包括國家標準、行業標準要求),企業在標準的編制說明中必須說明理由。
2.YY/T0506-2009《病人、醫護人員和器械用手術單、手術衣和潔淨服》中性能要求見下表:
性能名稱 | 單位 | 要求 | ||||
標準性能 | 高性能 | |||||
產品關鍵區域 | 產品非關鍵區域 | 產品關鍵區域 | 產品非關鍵區域 | |||
Log10 CFU | 不要求 | ≤2a,c | 不要求 | ≤2a,c | ||
IB | ≥2.8b | 不要求 | 6.0b,d | 不要求 | ||
Log10(cfu/dm2) | ≤2c | ≤2c | ≤2c | ≤2c | ||
潔淨度,微粒物質 | IPM | ≤3.5 | ≤3.5 | ≤3.5 | ≤3.5 | |
落絮 | Log10(落絮計數) | ≤4.0 | ≤4.0 | ≤4.0 | ≤4.0 | |
抗滲水性 | cmH2O | ≥20 | ≥10 | ≥100 | ≥10 | |
脹破強度,幹態 | kPa | ≥40 | ≥40 | ≥40 | ≥40 | |
脹破強度,溼態 | kPa | ≥40 | 不要求 | ≥40 | 不要求 | |
拉伸強度,幹態 | N | ≥20 | ≥20 | ≥20 | ≥20 | |
拉伸強度,溼態 | N | ≥20 | 不要求 | ≥20 | 不要求 | |
注:a試驗條件:挑戰菌濃度爲108CFU/g滑石粉,振動時間爲30min。
b用YY/T0506.6試驗時,在95%的置信水平處的IB的最小顯著性差異爲0.98。這是區分兩個材料之間有所不同的最小差異。小於等於0.98IB的材料變動可能無差異;而大於0.98IB則可能有差異(95%的置信水平意味着進行20次試驗,至少有19次是正確的)。
c在本部分中log10(CFU≤2)意味着最大300CFU。
d本部分中IB=6.0時,意味着無穿透。IB=6.0是最大可接受值。
3.其它性能指標
(1)粘合或縫製要求
粘合或縫製部位的性能應符合標準要求。
(2)無菌要求
一次性使用手術衣應無菌供應,應經過一個確認過的滅菌過程使其無菌。
(3)化學性能要求
一次性使用手術衣若採用環氧乙烷滅菌,環氧乙烷殘留量應不大於 10 mg/kg。
(4)生物性能要求
(5)結構要求
4.一次性使用手術衣的透氣性對產品的使用和手術質量的保證非常重要,考慮到目前對產品的透氣性指標提出一個統一要求的依據不夠充分,製造商應結合臨牀具體應用對產品的透氣性進行評價,並對各區域標示透氣性指標。
3.7 (八)產品的檢驗要求
出廠檢驗應至少包括環氧乙烷殘留量(若採用環氧乙烷滅菌)、無菌。
型式檢驗報告是證實生產過程有效性的文件之一。註冊申請時進行的型式檢驗應由具備合法資質的檢驗機構進行。型式檢驗時,若標準中無特殊規定,按相應的標準要求進行全性能檢驗,應全部合格。
3.8 (九)產品的臨牀要求
一次性使用手術衣產品設計定型、工藝成熟,臨牀應用多年,不改變常規用途,且無嚴重不良事件記錄,通過非臨牀評價、註冊檢驗及質量體系考核能夠保證產品的安全性、有效性,故原則上不要求臨牀試驗。
3.9 (十)產品的不良事件歷史記錄
暫未見相關報道。
3.10 (十一)產品介紹、標籤和包裝標識
1. 一次性使用手術衣介紹的編寫應符合《醫療器械介紹、標籤和包裝標識管理規定》及相關標準的要求。
2. 一次性使用手術衣產品介紹應當包括以下內容:
(2)生產企業名稱、註冊地址、生產地址、聯繫方法。
(3)《醫療器械生產企業許可證》編號、《醫療器械註冊證》編號、註冊標準代號。
(6)產品適用範圍。
(7)介紹中至少應有以下注意事項、警示以及提示性內容:
a.一次性使用的產品應當註明“一次性使用”字樣或符號,禁止重複使用;
b.已滅菌產品應當註明滅菌方式、“無菌”、“無菌失效年月”等字樣或者符號,如發現包裝破損,嚴禁使用;
d.使用前檢查包裝是否完好,並對包裝標誌、生產日期、滅菌有效期進行確認,並在滅菌有效期內使用;
3.介紹、包裝標識不得有以下內容:
(3)含有“保險公司保險”等承諾性的語言;
(4)利用任何單位或個人名義、形象作證明或者推薦的;
(5)法律、法規規定禁止的其他內容。
4.標籤和包裝標識
一次性使用手術衣產品的包裝標識應符合YY/T0313-1998《醫用高分子製品包裝、標誌、運輸和貯存》、YY0466-2003《醫療器械 用於醫療器械標籤、標記和提供信息的符號》等標準的要求。
3.11 (十二)產品註冊單元劃分的原則和實例
按照醫療器械註冊管理辦法第二十七條要求,“醫療器械產品的註冊單元原則上以技術結構、性能指標和預期用途爲劃分依據”。
根據以上原則,高性能和標準性能的手術衣可以作爲一個註冊單元。
3.12 (十三)同一註冊單元中典型產品的確定原則
1.同一註冊單元中典型產品是指能夠代表本註冊單元內其他產品安全性和有效性的產品,其功能最齊全,結構最複雜,風險最高。
2.典型產品的確定可以通過比較同一註冊單元內所有產品的技術結構、性能指標和預期用途等相應資料,說明能夠代表本註冊單元內其他產品的安全性和有效性。
3.舉例:高性能手術衣與標準性能手術衣相比,高性能手術衣性能指標要求更高。所以高性能手術衣和標準性能手術衣作爲一個註冊單元時,高性能手術衣應作爲這個註冊單元中的典型產品。
4 三、審查關注點
(一)產品註冊標準編寫的規範性,引用標準的適用性、準確性,內容是否符合YY0506-2009《病人、醫護人員和器械用手術單、手術衣和潔淨服》及有關標準的要求。
(二)產品技術報告應按國家食品藥品監督管理局對境內第二類醫療器械註冊審批的要求編寫,重點關注企業產品的分切、縫製、初包是否在相應淨化條件下進行生產加工,必要時提交《淨化車間潔淨度檢測報告》。
(三)安全風險管理報告要審查產品的主要風險是否已經列舉,控制措施是否有效,風險是否降到可接受的程度之內。
5 一次性使用手術衣產品註冊技術審查指導原則編寫說明
5.1 一、指導原則編寫的原則
(一)本指導原則編寫的目的是用於指導和規範第二類手術衣產品註冊申報過程中審查人員對註冊材料的技術審評。
(二)本指導原則旨在讓初次接觸該類產品的註冊審查人員對產品結構、主要性能、預期用途等各個方面有個基本瞭解,同時讓技術審查人員在產品註冊技術審評時把握基本的尺度,對產品安全性、有效性作出系統評價。
5.2 二、指導原則編寫的依據
(一)《醫療器械監督管理條例》
(二)《醫療器械註冊管理辦法》(局令第16號)
(三)《醫療器械介紹、標籤和包裝標識管理規定》(局令第10號)
(四)《醫療器械標準管理辦法》(局令第31號)
(五) 關於印發《境內第一類醫療器械註冊審批操作規範(試行)》和《境內第二類醫療器械註冊審批操作規範(試行)》的通知(國食藥監械[2005]73號)
(六) 國家食品藥品監督管理局發佈的其他規範性文件
(七) 現行的國家標準和行業標準
5.3 三、指導原則的編寫格式
指導原則正文的層次和目錄遵從國家食品藥品監督管理局的統一要求,語言表述採取提示方式,以利於審評人員直入審查內容。
5.4 四、指導原則中部分具體內容的編寫考慮
(一)產品的主要技術指標制定主要參考行業標準YY0506-2009《病人、醫護人員和器械用手術單、手術衣和潔淨服》。
(二)產品的預期用途是根據YY0506-2009《病人、醫護人員和器械用手術單、手術衣和潔淨服》提出的。爲方便審評人員在確定預期用途時更具可操作性,經徵求YY0506系列標準編寫專家意見,本指導原則分別給出了高性能和標準性手術衣的具體預期用途,供審評人員參考使用。
(三)考慮到本指導原則規定的手術衣爲一次性使用醫療器械產品,並結合目前國內該產品生產企業現狀,參考相關專家意見,所以本指導原則規定的一次性使用手術衣應以無菌方式供應。
(四)因爲一次性使用手術衣產品工藝成熟,臨牀應用多年,通過徵求醫療器械檢驗專家、臨牀專家及部分省市醫療器械技術審評人員意見,認爲通過非臨牀評價、註冊檢驗及質量體系考核能夠保證產品的安全性、有效性,所以本指導原則規定該產品原則上不要求進行臨牀試驗。
5.5 五、指導原則編寫人員
本指導原則的編寫成員由河南省醫療器械行政審批人員、註冊技術審評人員、醫療器械檢驗、臨牀專家及相關企業技術人員共同組成。以充分利用各方面的信息和資源,綜合考慮指導原則中各個方面的內容,儘量保證指導原則正確、全面、實用。