2 註解
在弱電解質溶液中加入跟該電解質有相同離子的強電解質,可以降低弱電解質的電離度,這種叫做同離子效應。在弱酸溶液中加入該酸的可溶性鹽(如在醋酸溶液中加入少量固體醋酸鈉),或在弱鹼溶液中加入該鹼的可溶性鹽(如在氨水中加入氯化銨),都會發生同離子效應。發生同離子效應的原理主要是加入相同離子後,使原電解質的電離平衡向生成原電解質分子的方向移動,從而降低原電解質的電離度。在電解質飽和溶液中加入跟該電解質有相同離子的強電解質,從而降低原電解質的溶解度,這種現象也叫同離子效應。這是因爲增加溶液中離子的濃度,使有關離子濃度的乘積超過原電解質的溶度積常數,使原電解質沉澱下來。
弱酸在水溶液中存在着解離平衡,且當加入與弱酸解離相同的離子時,解離平衡將移動。如在醋酸溶液中加入一定量的醋酸鈉,由於醋酸鈉爲強電解質,因而它的解離將增加溶液中醋酸根離子濃度,一定數目醋酸根離子同溶液中氫離子結合,生成醋酸分子,使醋酸解離平衡向着醋酸分子方向移動:
HAc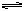 H Ac-
H Ac-
即HAc的解高度降低,溶液中氫離子濃度減少。這種由於加入相同離子而使弱電解質(弱酸、弱鹼等)解離度降低的現象,稱爲同離子效應。在化學反應中常常要用到同離子效應這一概念,如:MnS是難溶於水的,如在Mn2 離子的中性溶液中通入H2S氣可得到MnS沉澱。但在Mn2 離子的酸性溶液中不能產生MnS沉澱。這可用同離子效應解釋:由於在酸性溶液中H 離子對氫硫酸的解離產生同離子效應,使氫硫酸解離降低,S2-離子濃度很小,所以不能產生MnS沉澱。