2 英文參考
Analytical quality specifications for routine tests in clinical hematology
ICS 11. 100
C 50
中華人民共和國衛生行業標準
WS/T 406-2012 臨牀血液學檢驗常規項目分析質量要求
Analytical quality specifications for routine tests in clinical hematology
《臨牀血液學檢驗常規項目分析質量要求》由中華人民共和國衛生部於2012年12月25日發佈,自2013年8月1日起實施。
3 前言
本標準按照GB/T 1.1-2009給出的規則起草。
本標準由衛生部臨牀檢驗標準專業委員會提出。
本標準起草單位:衛生部臨牀檢驗中心、四川大學華西醫院、北京協和醫院。
本標準起草人:彭明婷、周文賓、谷小林、李臣賓、吳際、陸紅、江虹、李建英。
4 1 範圍
本標準規定了臨牀血液學檢驗常規項目(全血細胞計數和凝血試驗)的分析質量要求及驗證方法。
本標準適用於使用血液分析儀和血凝儀的臨牀實驗室、室間質量評價機構或體外診斷企業的內部質量控制、外部質量評價及檢測系統的性能驗證。
5 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
WS/T 408 臨牀化學設備線性評價指南
CLSI EP9-A2 用患者樣本進行方法學比對及偏倚評估:批准指南~第二版(Method comparison and bias estimation using patient samples: Approved guideline-Second edition)
6 3 術語和定義
下列術語和定義適用於本文件。
3.1
血液分析儀 hematology analyzer
主要用於檢測血液樣本,能對血液中的有形成分進行定性、定量分析,並提供相關信息的儀器。
3.2
血凝儀 coagulation analyzer
3.3
驗證 verification
提供客觀證據以認定規定要求得到滿足。
3.4
攜帶污染 carryover
由測量系統將一個檢測樣品反應攜帶到另一個檢測樣品反應的分析物不連續的量,由此錯誤地影響了另一個檢測樣品的表現量。
3.5
精密度 precision
在規定的條件下,獨立檢測結果間的一致程度,精密度的度量通常以不精密度表示。
3.6
不精密度 imprecision
同一實驗室用同種方法在多次獨立檢測中分析同一樣品所得結果的離散程度。
3.7
批內精密度 within-run precision
在相同的檢測條件下,對同一被測物進行連續測量所得結果間的一致程度。
3.8
日間精密度 inter-day precision
在不同天內對同一被測物進行重複測量所得結果間的一致程度。
3.9
線性 linearity
檢測樣本時,在一定範圍內可以直接按比例關係得出分析物含量的能力。
3.10
正確度 trueness
3.11
偏倚 bias
同一實驗室用同種方法在多次獨立檢測中分析同一樣品所得結果的均值與靶值之間的差異。
注1:靶值可以是參考方法測定值、有證標準物質定值或其他適當定值,如室間質量評價計劃的統計值。
注2:偏倚一般通過分析有證標準物質及其他適當參考物質、與參考方法或已知準確度的其他方法(如公認的指定比對方法)比對而獲得。
注3:偏倚可用絕對值或相對值表示。
3.12
準確度 accuracy
3.13
總誤差 total error
實驗室用某方法在多次獨立檢測中分析某樣品所得各個結果值與靶值之差在一定置信區間內的最大允許範圍。
3.14
可比性 comparability
7 4 縮略語
下列縮略語適用於本文件。
APTT 活化部分凝血活酶時間(activated partial thromboplastin time)
CLSI 美國臨牀和實驗室標準協會(Clinical and Laboratory Standards Institute)
Fib 纖維蛋白原測定(fibrinogen)
Hb 血紅蛋白測定(hemoglobin)
Hct 血細胞比容測定(hematocrit)
MCV 平均紅細胞容積(mean corpuscular volume)
MCH 平均紅細胞血紅蛋白含量(mean corpuScular hemoglobin)
MCHC 平均紅細胞血紅蛋白濃度(mean corpuscular hemogolobin concentration)
Plt 血小板計數(platelet)
PT 凝血酶原時間(prothrormbin time)
RBC 紅細胞計數(red blood cell count)
WBC 白細胞計數(white blood cell count)
8 5 全血細胞計數的分析質量要求及驗證方法
8.1 5.1 本底計數
8.1.1 5.1.1 本底計數檢測要求
血液分析儀本底計數各參數的結果應符合表1的要求。
8.1.2 5.1.2 驗證方法
用稀釋液作爲樣本在分析儀上連續檢測3次,3次檢測結果的最大值應在允許範圍內。
8.2 5.2 攜帶污染
8.2.1 5.2.1 攜帶污染檢測要求
8.2.2 5.2.2 驗證方法
分別針對不同檢測項目,取一份高濃度的臨牀樣本(EDTA-K2或EDTA-K3抗凝靜脈血),混合均勻後連續測定3次;再取一份低濃度的臨牀樣本,混合均勻後連續測定3次。按式(l)計算攜帶污染率。

式中:
CR -攜帶污染率;
8.2.3 5.2.3 臨牀樣本濃度要求
| 檢測項目 | WBC | RBC | Hb | Plt |
| 高濃度值 | >90×109/L | >6.20×1012/L | >220g/L | >900×109/L |
| 低濃度值 | >0~<3×109/L | >0~<1.50×1012/L | >0~<50g/L | >0~<30×109/L |
8.3 5.3 批內精密度
8.3.1 5.3.1 批內精密度檢測要求
批內精密度以連續檢測結果的變異係數爲評價指標,批內精密度應達到廠家介紹的要求,檢測正常濃度水平新鮮血的批內精密度至少應符合表4的要求。
| 檢測項目 | 檢測範圍 | 變異係數 |
| WBC | 4.0×109/L~10.0×109/L | ≤4.0% |
| RBC | 3.5×1012/L~5.5×1012/L | ≤2.0% |
| Hb | 110g/L~160g/L | ≤1.5% |
| Hct | 35%~55% | ≤3.0% |
| Plt | 100×109/L~300×109/L | ≤5.0% |
| MCV | 80fl~100fl | ≤2.0% |
| MCH | 27pg~34pg | ≤2.0% |
| MCHC | 320g/L~360g/L | ≤2.5% |
8.3.2 5.3.2 驗證方法
取一份濃度水平在上述檢測範圍內的臨牀樣本,按常規方法重複檢測11次,計算後10次檢測結果的算術平均值和標準差,按照式(2)計算變異係數。

式中:
CV-變異係數;
s——標準差;
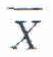
8.4 5.4 日間精密度
8.4.1 5.4.1 日間精密度檢測要求
日間精密度以室內質控在控結果的變異係數爲評價指標,日間精密度應符合表5的要求。
8.4.2 5.4.2 驗證方法
至少使用兩個濃度水平(包含正常和異常水平)的質控品,在檢測當天至少進行一次室內質控,剔除失控數據(失控結果已得到糾正)後按批號或者月份計算在控數據的變異係數。
8.5 5.5 線性
8.5.1 5.5.1 線性驗證檢測要求
線性迴歸方程的斜率在1±0. 05範圍內,相關係數r≥0.975或r2≥0.95。WBC、RBC、Hb和Plt項目滿足要求的線性範圍在廠家介紹規定的範圍內。
8.5.2 5.5.2 驗證方法
8.6 5.6 正確度
8.6.1 5.6.1 偏倚
8.6.2 5.6.2 驗證方法
至少使用10份檢測結果在參考區間內的新鮮血樣本,每份樣本檢測兩次,計算20次以上檢測結果的均值,以校準實驗室的定值或臨牀實驗室內部規範操作檢測系統(如使用配套試劑、用配套校準物定期進行儀器校準、儀器性能良好、規範地開展室內質量控制、參加室間質量評價成績優良、檢測程序規範、人員經過良好培訓的檢測系統)的測定均值爲標準,計算偏倚。
8.7 5.7 不同吸樣模式的結果可比性
8.7.1 5.7.1 適用條件
8.7.2 5.7.2 可比性要求
8.7.3 5.7.3 驗證方法
每次校準後,取5份臨牀樣本分別使用不同模式進行檢測,每份樣本各檢測兩次,分別計算兩種模式下檢測結果均值間的相對差異,結果應符合表7的要求。
8.8 5.8 實驗室內的結果可比性
8.8.1 5.8.1 偏差
實驗室內的結果可比性以相對偏差爲評價指標,相對偏差應符合表8的要求。
8.8.2 5.8.2 驗證方法
5.8.2.1 新儀器使用前,配套檢測系統至少使用20份臨牀樣本(濃度要求見表8),每份樣本分別使用臨牀實驗室內部規範操作檢測系統和被比對儀器進行檢測,以內部規範操作檢測系統的測定結果爲標準,計算相對偏差,每個檢測項目的相對偏差符合表8要求的比例應≥80%。
5.8.2.2 新儀器使用前,非配套檢測系統按CLSI頒佈的EP9-A9文件與配套檢測系統進行比對,至少使用40份臨牀樣本(濃度要求見表8),計算相對偏差,每個檢測項目的相對偏差符合表8要求的比例應≥80%。然後再按5.8.2.1的方法進行驗證。
5.8.2.3 常規檢測儀器使用過程中,至少使用20份臨牀樣本(血細胞計數項目所選標本的濃度水平應符合表8的要求,其他檢測項目所選標本應含正常、異常濃度水平各佔50%;比對可分次進行)定期(至少半年)進行一次結果比對,每個檢測項目的相對偏差符合表8要求的比例應≥80%。
5.8.2.4 以下情況,可按WS/T 407的方法和要求進行比對:
a) 室內質控結果有漂移趨勢時;
b) 室間質評結果不合格,採取糾正措施後;
c) 更換試劑批號(必要時);
d) 更換重要部件或重大維修後;
f) 臨牀醫生對結果的可比性有疑問時;
表8(續)
| 檢測項目 | 濃度範圍 | 樣本數量所佔比例 | 相對偏差 |
×1012/L | <3.00 | 5% | ≤3.0% |
| 3.00~4.00 | 15% | ||
| 4.01~5.00 | 55% | ||
| 5.01~6.00 | 20% | ||
| >6.01 | 5% | ||
g/L | <100.0 | 10% | ≤3.5% |
| 100~120 | 15% | ||
| 121~160 | 60% | ||
| 161~180 | 10% | ||
| >181 | 5% | ||
×109/L | <40 | 10% | ≤15.0% |
| 40~125 | 20% | ≤12.5%% | |
| 126~300 | 40% | ||
| 301~500 | 20% | ||
| 500~600 | 5% | ||
| >601 | 5% | ||
| Hct | ≤3.5% | ||
| MCV | ≤3.5% | ||
| MCH | ≤3.5% | ||
| MCHC | ≤3.5% |
8.9 5.9 準確度
8.9.1 5.9.1 總誤差
準確度驗證以總誤差爲評價指標,用相對偏差表示,相對偏差應符合表9的要求。
8.9.2 5.9.2 驗證方法
至少使用5份質評物或定值臨牀樣本分別進行單次檢測,計算每份樣本檢測結果與靶值(公議值或參考值)的相對偏差,每個檢測項目的相對偏差符合表9要求的比例應≥80%。
9 6 凝血試驗的分析質量要求及驗證方法
9.1 6.1 批內精密度
9.1.1 6.1.1 批內精密度檢測要求
批內精密度以連續檢測結果的變異係數爲評價指標,凝血試驗的批內精密度應符合表10的要求。
| 檢測項目 | Pta | APTTa | Fibb | |
| 變異係數 | 正常樣本 | ≤3.0% | ≤4.0% | ≤6.0% |
| 異常樣本 | ≤8.0% | ≤8.0% | ≤12.0% | |
a 異常樣本的濃度水平要求大於儀器檢測結果參考區間中位值的2倍。 b Fib異常樣本的濃度要求大於6 g/L或小於1.5 g/L 。 | ||||
9.1.2 6.1.2 驗證方法
取3個濃度水平(包含位於正常、中度異常和高度異常)的臨牀樣本(枸櫞酸鈉抗凝血漿)或質控品各一支,每支樣本按常規方法重複檢測11次,計算後10次檢測結果的算術平均值和標準差,按照式(2)計算變異係數。
9.2 6.2 日間精密度
9.2.1 6.2.1 日間精密度檢測要求
日間精密度以室內質控在控結果的變異係數爲評價指標,日間精密度應符合表11的要求。
9.2.2 6.2.2 驗證方法
至少使用兩個濃度水平(包含正常和異常水平)的質控品,在檢測當天至少進行一次室內質控,剔除失控數據後(失控結果已得到糾正)按批號或者月份計算在控數據的變異係數。
9.3 6.3 線性
9.3.1 6.3.1 線性驗證檢測要求
線性迴歸方程的斜率在1±0. 05範圍內,相關係數r≥0.975或r2≥0.95。Fib 項目滿足要求的線性範圍在廠家介紹規定的範圍內。
9.3.2 6.3.2 驗證方法
9.4 6.4 正確度
9.4.1 6.4.1 偏倚
9.4.2 6.4.2 驗證方法
至少使用10份檢測結果在參考區問範圍內的臨牀樣本,每份樣本檢測兩次,計算20次以上檢測結果的均值,以校準實驗室的定值或臨牀實驗室內部規範操作檢測系統(Clauss法)的測定均值爲標準,計算偏倚。
9.5 6.5 準確度
9.5.1 6.5.1 誤差
準確度驗證以總誤差爲評價指標,用相對偏差表示,相對偏差應符合表12的要求。
9.5.2 6.5.2 驗證方法
至少使用5份質評物或定值臨牀樣本分別進行單次檢測,計算每份樣本檢測結果與靶值(公議值或參考值)的相對偏差,每個檢測項目的相對偏差符合表12要求的比例應≥80%。
10 參考文獻
[1] CLSI: H26-A2 Validation,Verification,and Quality Assurance of Automated Hermatology. Analyzers ; Approved Standard-Second Edition. CLSI document. Wayne, Pa. : Clinical and Laboratory Standards Institute; 2010.
[2] CLSI: H57-A Protocol for the Evaluation, Validation, and Implementation of Coagulometers, Approved Guideline, CLSI document. Wayne, Pa.: Clinical and Laboratory Standards Institute; 2008.
[3] CLSI: EP15-A2 User Verification of Performance for Precision and Trueness; Approved Guideline-Second Edition. CLSI document. Wayne, Pa.: Clinical and Laboratory Standards Institute; 2006.