2 註解
雜化軌道理論:價鍵理論對共價鍵的本質和特點做了有力的論證,但它把討論的基礎放在共用一對電子形成一個共價鍵上,在解釋許多分子、原子的價鍵數目及分子空間結構時卻遇到了困難。例如C原子的價電子是2s22p2,按電子排布規律,2個s電子是已配對的,只有2個p電子未成對,而許多含碳化合物中C都呈4價而不是2價,可以設想有1個s電子激發到p軌道去了。那末1個s軌道和3個p軌道都有不成對電子,可以形成4個共價鍵,但s和p的成鍵方向和能量應該是不同的。而實驗證明:CH4分子中,4個C-H共價鍵是完全等同的,鍵長爲114pm,鍵角爲109.5°。BCl3,BeCl2,PCl3等許多分子也都有類似的情況。爲了解釋這些矛盾,1928年Pauling提出了雜化軌道概念,豐富和發展了的價鍵理論。他根據量子力學的觀點提出:在同一個原子中,能量相近的不同類型的幾個原子軌道在成鍵時,可以互相疊加重組,成爲相同數目、能量相等的新軌道,這種新軌道叫雜化軌道。C原子中1個2s電子激發到2p後,1個2s軌道和3個2p軌道重新組合成4個sp3雜化軌道,它們再和4個H原子形成4個相同的C-H鍵,C位於正四面體中心,4個H位於四個頂角。
雜化軌道種類很多,如三氯化硼(BCl3)分子中B有sp2雜化軌道,即由1個s軌道和2個p軌道組合成3個sp2雜化軌道,在氯化鈹(BeCl2)中有sp雜化軌道,在過渡金屬化合物中還有d軌道參與的sp3d和sp3d2雜化軌道等。以上幾例都是闡明瞭共價單鍵的性質,至於乙烯和乙炔分子中的雙鍵和三鍵的形成,又提出了σ鍵和π鍵的概念。如把兩個成鍵原子核間聯線叫鍵軸,把原子軌道沿鍵軸方向“頭碰頭”的方式重疊成鍵,稱爲σ鍵。把原子軌道沿鍵軸方向“肩並肩”的方式重疊,稱爲π鍵。例如在乙烯( )分子中有碳碳雙鍵(C=C),碳原子的激發態中2px,2py和2s形成sp2雜化軌道,這3個軌道能量相等,位於同一平面並互成120℃夾角,另外一個pz軌道未參與雜化,位於與平面垂直的方向上。碳碳雙鍵中的sp2雜化如下所示。
)分子中有碳碳雙鍵(C=C),碳原子的激發態中2px,2py和2s形成sp2雜化軌道,這3個軌道能量相等,位於同一平面並互成120℃夾角,另外一個pz軌道未參與雜化,位於與平面垂直的方向上。碳碳雙鍵中的sp2雜化如下所示。
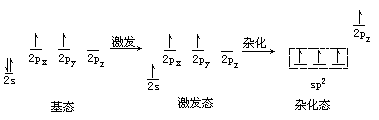
這3個sp2雜化軌道中有2個軌道分別與2個H原子形成σ單鍵,還有1個sp2軌道則與另一個C的sp2軌道形成頭對頭的σ鍵,同時位於垂直方向的pz軌道則以肩並肩的方式形成了π鍵。也就是說碳碳雙鍵是由一個σ鍵和一個π鍵組成,即雙鍵中兩個鍵是不等同的。π鍵原子軌道的重疊程度小於σ鍵,π鍵不穩定,容易斷裂,所以含有雙鍵的烯烴很容易發生加成反應,如乙烯(H2C=CH2)和氯(Cl2)反應生成氯乙烯(Cl—CH2—CH2—Cl)。
乙炔分子(C2H2)中有碳碳三鍵(HC≡CH),激發態的C原子中2s和2px軌道形成sp雜化軌道。這兩個能量相等的sp雜化軌道在同一直線上,其中之一與H原子形成σ單鍵,另外一個sp雜化軌道形成C原子之間的σ鍵,而未參與雜化的py與pz則垂直於x軸並互相垂直,它們以肩並肩的方式與另一個C的py,pz形成π鍵。即碳碳三鍵是由一個σ鍵和兩個π鍵組成。這兩個π鍵不同於σ鍵,軌道重疊也較少並不穩定,因而容易斷開,所以含三鍵的炔烴也容易發生加成反應。
