1 拼音
GBZ/T 240.10—2011 huà xué pǐn dú lǐ xué píng jià chéng xù hé shì yàn fāng fǎ dì 10bù fēn :tǐ wài bǔ rǔ dòng wù xì bāo jī yīn tū biàn shì yàn
2 英文參考
Procedures and tests for toxicological evaluations of chemicals—Part 10:In vitro mammalian cell forward gene mutation test
ICS 13.100
C 52
中華人民共和國國家職業衛生標準 GBZ/T 240.10—2011《化學品毒理學評價程序和試驗方法 第10部分:體外哺乳動物細胞 基因突變試驗》(Procedures and tests for toxicological evaluations of chemicals—Part 10:In vitro mammalian cell forward gene mutation test)由中華人民共和國衛生部於2011年08月19日發佈,自2012年03月01日起實施。
3 前言
根據《中華人民共和國職業病防治法》制定本部分。GBZ/T 240《化學品毒理學評價程序和試驗方法》現分爲以下四十四部分:
——第1部分:總則;
——第2部分:急性經口毒性試驗;
——第3部分:急性經皮毒性試驗;
——第4部分:急性吸入毒性試驗;
——第5部分:急性眼刺激性/腐蝕性試驗;
——第7部分:皮膚致敏試驗;
——第8部分:鼠傷寒沙門氏菌回覆突變試驗;
——第13部分:哺乳動物精原細胞/初級精母細胞染色體畸變試驗;
——第15部分:亞急性經口毒性試驗;
——第16部分:亞急性經皮毒性試驗;
——第17部分:亞急性吸入毒性試驗;
——第18部分:亞慢性經口毒性試驗;
——第19部分:亞慢性經皮毒性試驗;
——第20部分:亞慢性吸入毒性試驗;
——第21部分:致畸試驗;
——第22部分:兩代繁殖毒性試驗;
——第24部分:慢性經口毒性試驗;
——第25部分:慢性經皮毒性試驗;
——第27部分:致癌試驗;
——第28部分:慢性毒性/致癌性聯合試驗;
——第29部分:毒物代謝動力學試驗;
——第33部分:果蠅伴性隱性致死試驗;
——第35部分:體外哺乳動物細胞程序外DNA合成(UDS)試驗;
——第42部分:一代繁殖試驗;
本部分爲GBZ/T 240的第10部分。
本部分由衛生部職業衛生標準專業委員會提出。本部分由中華人民共和國衛生部批准。
本部分起草單位:廣西職業病防治研究所、中國疾病預防控制中心職業衛生與中毒控制所。
本部分主要起草人:陳曉琴、孫金秀、常兵、許建寧、林錚。
5 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅所注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
GBZ/T 224 職業衛生名詞術語
8 5 試驗概述
在加入或不加入肝微粒體酶的條件下,使細胞暴露於受試樣品一定時間,然後將細胞傳代培養,突變細胞在含有6-巰基鳥嘌呤(6-thiOguanine,6-TG)或三氟胸苷(trifluorothymidine,TFT)的選擇性培養液中能繼續分裂並形成集落。根據突變集落數可計算突變頻率,從而評價受試樣品的致突變性。
9 6 試驗方法
9.1 6.1 受試樣品配製
選定受試樣品的合適溶劑,首選無菌雙蒸水作爲溶劑,如果不溶於水的或水溶性低的化學品,首選二甲基亞碸。固體受試樣品需溶解或懸浮於溶劑中,用前稀釋至適合濃度;液體受試樣品可以直接加入試驗系統/或用前稀釋至適合濃度。受試樣品一般應在使用前新鮮配製。
9.2 6.2 劑量水平
至少應設置4個可供分析的劑量。對有細胞毒性的受試樣品,高劑量組的細胞存活率可爲10%~20%,低劑量組的細胞存活率應>80%。無細胞毒性的受試樣品,高劑量應達到5μL/mL,5 mg/mL或0.01 mol/L。應在預試驗中確定細胞毒性和溶解度,測定細胞毒性可使用指示細胞完整性和生長情況的指標,如相對集落形成率或相對細胞生長率等,應在S9系統存在或不存在的條件下測定細胞毒性。
9.3 6.3 對照
9.3.1 6.3.1 陽性對照
——甲磺酸乙酯(ethyl methanesulphonate,CAS號62-50-0);
——甲磺酸甲酯(methyl methanesulphonate,CAS號66-27-3);
——乙基亞硝基脲(ethyl nitrosourea,CAS號759-73-9)等。
——3-甲基膽蒽(3-methylcholanthrene,CAS號56-49-5);
——環磷酰胺(cyclophosphamide,CAS號50-18-0);
——N-亞硝基胍(N-nitroso-dimethylamine,CAS號62-75-9);
——7,12-Ⅱ甲基苯蒽(7,12-demethylbenzanthracene,CAS號57-97-6);
——苯並(a)芘(benzo(a)pyrene,CAS號50-32-8)等。
9.3.2 6.3.2 陰性對照
9.3.2.1 6.3.2.1 溶劑對照
溶劑應爲非致突變物,不與受試樣品發生化學反應,不影響細胞存活和S9活性。首選溶劑是水或
水溶性溶劑,亦可使用二甲基亞碸(DMSO),但濃度不應大於0.5%。
9.3.2.2 6.3.2.2 空白對照
如果沒有文獻資料或歷史資料證實所用溶劑無致突變作用時應設空白對照。
9.4 6.4 細胞株
用於本試驗的細胞株對化學致突變物應具有明確的敏感性,高度的繁殖能力以及穩定的自發突變率。應檢測細胞是否被支原體感染,若已被感染則不能使用。
HPRT位點突變分析常使用中國倉鼠肺細胞株(V79)和中國倉鼠卵巢細胞株(CHO),TK位點突變分析常用小鼠淋巴細胞株(L5178Y)和人類淋巴細胞細胞株(TK6,WTK1等)。
9.5 6.5 試劑配製
9.5.1 6.5.1 完全培養液
應根據試驗所用系統和細胞類型來選擇適宜的培養基。對於L5178Y或TK6細胞,常用PRMI1640培養基加入10%馬血清和適量抗菌素(青黴素100 IU/mL、鏈黴素100μg/mL)。對於V79或CHO細胞,常用MEM(Eaglc)培養基加入10%胎牛血清和適量抗菌素。
9.5.2 6.5.2 血清處理
將過濾除菌後的小牛血清或馬血清放入56℃水浴中,保溫30 min以滅活補體,然後分裝,保存於-20℃備用。
9.5.3 6.5.3 代謝活化系統
肝微粒體酶(S9混合液)。
9.5.4 6.5.4 無鈣鎂的磷酸鹽緩衝液(無鈣鎂PBS,pH爲7.2~7.4)成分
磷酸二氫鉀(KH2PO4) 0.20 g
氯化鉀(KCl) 0.20 g
氯化鈉(NaCl) 8.00 g
9.5.5 6.5.5 胰蛋白酶-EDTA溶液
分別用無鈣鎂PBS配製胰蛋白酶與EDTA鈉鹽溶液,胰蛋白酶溶液濃度爲0.05%,EDTA鈉鹽溶液濃度爲0.02%,兩溶液按1:1混合,存放於-20℃冰箱備用。
9.5.6 6.5.6 姬姆薩染液
取姬姆薩染料3.8 g,置瑪瑙乳鉢中,加少量甲醇研磨。逐漸加甲醇至375 mL,待完全溶解後,再加125 mL甘油,放入37℃溫箱中保溫48 h。保溫期間振搖數次,使充分溶解。取出過濾,2周後使用,作爲姬姆薩染液原液。使用時,取1份姬姆薩染液原液,與9份1/15 mol/L磷酸鹽緩衝液(pH6.8)混合。
9.5.7 6.5.7 選擇劑
6-巰基鳥嘌呤(6-TG)建議使用最終濃度爲5μg/mL;三氟胸苷(TFT)建議使用最終濃度爲3μg/mL。
9.6 6.6 試驗步驟
9.6.1 6.6.1 HPRT位點突變分析(V79)
9.6.1.1 6.6.1.1 細胞準備
將5×105個細胞接種於含完全培養液的直徑爲100 mm的平皿中,除未處理對照組外,每組3個平皿。於37℃ CO2培養箱中培養24 h。
9.6.1.2 6.6.1.2 接觸受試樣品
吸去上述供試培養皿中的培養液,用無鈣鎂PBS洗2次。將含有細胞的培養皿分爲兩大組,一組加S9混合液,另一組不加S9混合液。加S9混合液組,在培養皿中加入2 mL S9混合液,對不加S9混合液組,則用2 mL無血清培養液代替,再加不同劑量受試樣品的供試液,最後不含血清的培養液補足至10 mL,並將培養皿置CO2培養箱中培養3 h~6 h。處理結束後,吸去培養皿中液體部分,用無鈣鎂PBS洗滌細胞2次,再加入完全培養液10 mL,在CO2培養箱中培養19 h~22 h。陽性和陰性對照組也分爲加與不加S9混合液兩個組,操作方法同上。
9.6.1.3 6.6.1.3 表達
將培養物用胰蛋白酶-EDTA消化,待細胞脫落後,加入完全培養液,終止消化。混勻、計數並進行表達和細胞毒性測定。表達時,以5×105個細胞接種於直徑爲100 mm的平皿中。培養6 d~8 d後,分傳一次,仍接種5×105個細胞,培養3d後再進行突變體的選擇及集落形成效率(CFE)的測定。
9.6.1.4 6.6.1.4 細胞毒性測定
將上述消化計數後的細胞,每個平皿接種200個,每組5個平皿,於37℃ CO2培養箱內培養7d。取出樣本,固定並進行姬姆薩染色後,計數各平皿的細胞集落數。以相對CFE值表示細胞的毒性。
9.6.1.5 6.6.1.5 突變體的選擇及集落形成率的測定
表達結束後,消化細胞,分別接種,每組5個平皿,每個平皿接種2×105個細胞。待細胞貼壁後加入6-TG,終濃度爲5μg/ mL。放入CO2培養箱培養7 d~10 d。固定後進行姬姆薩染色,計數平皿內集落數,並計算其突變頻率(MF)。
9.6.2 6.6.2 TK位點突變分析
6.6.2.1 取生長良好的細胞,調整密度爲5×105/mL,按1%體積加入受試樣品,37℃震搖處理3h。離心,棄上清液,用PBS或不含血清的培養基洗滌細胞2遍,重新懸細胞於含10%馬血清的PRMI1640培養液中,並調整細胞密度2×105/mL。
6.6.2.2 PE0(0天的平板接種效率)測定取適量細胞懸液,作梯度稀釋至8個細胞/mL,接種96孔板(每孔加0.2 mL,即平均1.6個細胞/孔),每個劑量作1塊~2塊板,37℃,5%CO2,飽和溼度條件下培養12 d,計數每塊平板的集落生長的孔數。
6.6.2.3 表達對步驟6.6.2.1所得細胞懸液作2d表達培養,每天計數細胞密度並保持密度在106/mL以下。
6.6.2.4 PE2(第2d的平板接種效率)測定第2天表達培養結束後,取適量細胞懸液,按步驟6.6.2.2作稀釋梯度並接種96孔板,培養12 d後計數每塊平板有集落生長的孔數。
6.6.2.5 TFT抗性突變頻率(MF)測定 第2天表達培養結束後,取適量細胞懸液,調整細胞密度爲1×104/mL,加入TFT(三氟胸苷,終末濃度爲3μg/mL),混勻,接種96孔板(每孔加0.2 mL,即平均2000個細胞/孔),每個劑量作2塊—4塊板,37℃,5% CO2,飽和溼度條件下培養12 d,計數有突變集落生長的孔數。
10 7 數據處理與結果評價
10.1 7.1 HPRT位點突變分析按下列公式計算有關指標
——絕對CFE=形成集落數/接種細胞數;
一一相對CFE=(試驗組絕對CFE/溶劑對照組絕對CFE)×100%;
——突變頻率(MF)=(突變集落數/接種細胞數)×(1/絕對CFE);
——試驗結果用X2檢驗進行統計學處理。
10.2 7.2 TK位點突變分析按下列公式計算有關指標
7.2.1 平板效率(PE0和PE2)
平板效率計算見公式(1)。
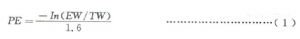
式中:
EW——無集落生長的孔數;
TW——總孔數;
1.6——每孔接種細胞。
7.2.2 相對存活率
相對存活率計算見公式(2)。
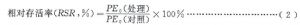
7.2.3 突變頻率(MF)
突變頻率計算見公式(3)。

式中:
EW——無集落生長的孔數;
TW——總孔數;
n——每孔接種細胞數(2000)。
10.3 7.3 評價原則
7.3.1 在下列兩種情況下可判定受試樣品在本試驗系統中爲陽性結果:
——受試樣品引起突變頻率的增加具有統計學意義、並有劑量一效應關係。
——受試樣品在任何一個劑量條件下,引起具有統計學意義,並有可重複性的陽性反應。
7.3.2 陰性結果的判定需在相對存活率(relative survival rate,RSR)<20%(即已產生明顯細胞毒性)的情況下未見突變頻率顯著增加時方可作出。評價時應綜合考慮生物學和統計學意義。