8 氟的特性
總體特性原子屬性物理屬性其他性質最穩定的同位素在沒有特別註明的情況下使用的是
國際標準基準單位單位和標準氣溫和氣壓
| |||||||
| 名稱, 符號, 序號 | 氟、F、9 | ||||||
| 系列 | 鹵素 | ||||||
| 族, 週期, 元素分區 | 17族(VIIA), 2, p | ||||||
| 密度、硬度 | 1.696 kg/m3(273K)、NA | ||||||
| 顏色和外表 | 淡黃綠色 | ||||||
| 地殼含量 | 0.03 % | ||||||
| 原子量 | 18.9994 原子量單位 | ||||||
| 原子半徑(計算值) | 50(42)pm | ||||||
| 共價半徑 | 71 pm | ||||||
| 範德華半徑 | 147 pm | ||||||
| 價電子排布 | [氦]2s22p5 | ||||||
| 電子在每能級的排布 | 2,7 | ||||||
| 氧化價(氧化物) | -1(強酸) | ||||||
| 晶體結構 | 正方形 | ||||||
| 物質狀態 | 氣態 | ||||||
| 熔點 | 53.53 K(-219.62°C) | ||||||
| 沸點 | 85.03 K(-188.12 °C) | ||||||
| 摩爾體積 | 11.20×10-6m3/mol | ||||||
| 汽化熱 | 3.2698 kJ/mol | ||||||
| 熔化熱 | 0.2552 kJ/mol | ||||||
| 蒸氣壓 | 無數據 | ||||||
| 聲速 | 無數據 | ||||||
| 電負性 | 3.98 (鮑林標度) | ||||||
| 比熱 | 824 J/(kg·K) | ||||||
| 電導率 | 無數據 | ||||||
| 熱導率 | 0.0279 W/(m·K) | ||||||
| 第一電離能 | 1681.0 kJ/mol | ||||||
| 第二電離能 | 3374.2 kJ/mol | ||||||
| 第三電離能 | 6050.4 kJ/mol | ||||||
| 第四電離能 | 8407.7 kJ/mol | ||||||
| 第五電離能 | 11022.7 kJ/mol | ||||||
| 第六電離能 | 15164.1 kJ/mol | ||||||
| 第七電離能 | 17868 kJ/mol | ||||||
| 第八電離能 | 92038.1 kJ/mol | ||||||
| 第九電離能 | 106434.3 kJ/mol | ||||||
同位素丰度半衰期衰變模式衰變能量衰變產物
| |||||||
9 性質
氟是一種具有極強腐蝕性的淡黃色雙原子氣體。是自然界電負性最強的元素,也是最強的單質氧化劑。在常溫下,能同所有元素發生化合反應,並劇烈放熱。和氫氣即便在-250攝氏度的黑暗中混合也能發生爆炸,故液氟和液氫也用作高能火箭的液體燃料。在一般化合物中,氟都顯-1價。有人認爲,在少量氟氣通過冰面時反應生成的HFO(次氟酸)中F爲+1價。
由於氟的高度活性,稀有氣體的化合物也是最早從氟或含氟化合物開始製備的。最早得到的是六氟合鉑酸氙(XePtF6),此後還得到XeF2、XeF6、XeO3以及氪的氟化物等。此外,氟單質也用於獲得一些高價的過渡金屬化合物,比如CuF4、AuF5、UF6等。
氟及其一些化合物都有毒和較強的腐蝕性。氫氟酸可以腐蝕玻璃。而氟離子在人體組織內有滲透性。氫氟酸接觸皮膚如不及時處理可以腐爛至骨而造成永久性的損傷,而氟離子可以和鈣離子結合而使人發生中毒。而且氫氟酸的灼傷不易被發覺,一般是麻痹1-2小時後纔有疼痛感。一旦接觸氫氟酸,應該立即用大量水沖洗,並塗上20%氧化鎂的甘油懸浮液。而FSO3、SbF5等化合物具有遠強於硫酸等一般強酸的酸性,特定比例的混合物甚至可以分解石蠟。參見超強酸。
一般單質氟氣以特製銅鎳合金鋼瓶貯存。在有機化學中使用氟氣可以直接氟化羰基、羥基等官能團,其中使用的是摻有5%或10%氟的乾燥氮氣。
鏈烷基上的氫可以完全或部分被氟取代。完全被氟取代的化合物通常稱爲“全氟代物”。與碳氫化合物不同,由於氟原子半徑略大於氫原子,所以全氟碳鏈上的氟原子排列略呈螺旋狀。這一類化合物具有與衆不同的惰性。一般全氟的高分子非常穩定,耐熱耐寒、抗腐蝕性強。如聚四氟乙烯(Teflon),可以耐高達260攝氏度的溫度,不沾水和一般有機溶劑。故被用於製作不粘鍋,以及一些化學反應容器。只有元素氟、三氟化氯和熔融鹼金屬可以在高溫下腐蝕聚四氟乙烯。全氟代有機物在室溫下與一般溶劑難以互溶(醚、酯等除外),而加熱後,溶解度有所增加。這類全氟代有機物用作溶劑時,在溶液中和有機溶劑、水分成單獨的一個相,一般稱作“氟碳相”。隨着氟鏈的增長或者增多,全氟代有機物在有機溶劑和全氟溶劑中的溶解度都會顯著下降。QSAR的計算表明,有機分子中,如果氟原子的質量比重超過60%,就可以呈現出“全氟”的特性。
長鏈的簡單全氟代有機物一般從長的直鏈單羧酸出發製備,通過電解它們和氟氫化鉀的混合物,使鏈上的氫原子全部被氟原子取代,(如:全氟辛酸)再進一步合成其他化合物。
11 發現和單質製備
氟(Fluorine)這個名字來自拉丁文fluere,意思是幫助熔融的物質,也就是氟化鈣(螢石)的最初用途。因爲氟的化合物很穩定,所以氟單質很難分離。使用一般的化學方法,往往只能得到氟化氫。也正是這個原因,很多曾經嘗試分離單質氟的化學家因此中毒,甚至獻出生命。
元素氟最終是由法國化學家亨利·莫瓦桑在1886年6月26日用鉑銥合金爲陽極、金屬鉑爲電解槽,電解氟化鉀的20%無水氟化氫熔融液的方法首先分離出來的。此時距離元素氟的被發現已然近一百年,而亨利·莫瓦桑本人也因此獲得1906年的化學諾貝爾獎。
實驗室中用化學方法製備單質氟是1986年Karl Christe報導的。以HF、KF、SbCl5和KMnO4爲原料,首先分別製備出K2MnF6和SbF5,再以K2MnF6和SbF5爲原料製備MnF4,MnF4不穩定,可分解放出F2:

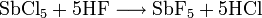
 (在423K)
(在423K)
12 主要用途
用作火箭燃料中的氧化劑,以及用於氟化合物、含氟塑料、氟橡膠等的製造。
氟的用途包括:
製造含氟高分子材料(如聚四氟乙烯塑料、含氟質子交換膜如杜邦公司Nafion膜等)。
含氟農藥。由於有機分子中的氟原子和三氟甲基等有強的親酯性,故在農藥分子中引入氟原子可以顯著降低其用量。
氟碳相的應用。利用氟碳相在高溫與有機相互溶、低溫下則不互溶的性質,可以用於萃取有機相中的含氟化合物。也可以由此特性使用親氟或含氟的催化劑,在反應過程中使包含催化劑的氟碳相和有機相互溶,而反應完成後則降溫,使大部分催化劑仍然留在氟碳相中,從而節約催化劑的用量。 不少商家在牙膏中加入含氟化合物,可以有效防止蛀牙。
氯氟碳化合物(氟氯代烷)(俗稱氟里昂Freon)或者溴氟碳化合物等。被用作滅火劑和空調製冷劑。需要指出的是,導致臭氧層分解的是氟里昂因光解產生的氯自由基,而非氟原子。所以現在一些綠色冰箱製造商所打的“不含氟”口號容易造成“氟元素破壞臭氧層”的誤解。其中的“氟”應爲含氯的“氟里昂”。
六氟化鈾(UF6),用於使用氣體擴散法分離同位素U-235和U-238。和Pu-239一樣,前者可以用於製造核彈。當一定形狀的U-235超過臨界質量後,中子可以引發其鏈式反應而瞬間釋放巨大能量。後者U-238則只能用於增殖彈。氣體擴散法利用六氟化鈾-235和六氟化鈾-238分子質量的微小差異,通過擴散來富集前者。由於擴散速率和分子量的平方根成反比,所以這個方法需要龐大且耐腐蝕(六氟化鈾易水解釋放出有毒且腐蝕性的UO2F2和HF)的設備,因而代價高昂。二戰時美國的“曼哈頓工程”就是通過這個方法濃縮到足夠製造核彈的U-235的。
人造血液。一些全氟醚類化合物可以攜帶氧氣和部分人體需要的養料和排泄物等。在需要全身換血時,可以用它暫時代替病人體內的血液;由於其揮發性,待幾天後可自行排出。因爲全氟化合物很穩定,一般很少有毒副作用。
15 毒理學資料及環境行爲
毒性:屬高毒類。
危險特性:強氧化劑。是最活潑的非金屬元素,幾乎可與所有的物質發生劇烈反應而燃燒。與氫氣混合時會引起爆炸。特別是與水或雜質接觸時,可發生激烈反應而燃燒,使容器破裂。氟對許多金屬有腐蝕性,並能形成一層保護性金屬氟化物。
19 泄漏應急處理
迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。從上風處進入現場。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。將殘餘氣或漏出氣用排風機送至水洗塔或與塔相連的通風櫥內。漏氣容器要妥善處理,修復、檢驗後再用。儲罐區最好設稀酸噴灑設施。
廢棄物處置方法:建議把含氟廢氣通過活性炭牀,生成的四氟化碳直接排空,剩餘的氟氣在氟-烴空氣燃燒器中燃燒,再通過鹼溶液洗滌後經煙囪排空。
