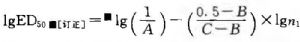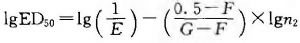2 附錄Ⅺ A 人用狂犬病疫苗效價測定法(NIH法)
本法系將供試品免疫小鼠後,產生相應的抗體,通過小鼠抗體水平的變化測定供試品的免疫原性。
2.1 試劑
稀釋液(PBS) 量取0.9%磷酸二氫鉀溶液75ml、2.4%磷酸氫二鈉(Na2HPO4·12H2O)溶液425ml、8.5%氯化鈉溶液500ml,混合後加水至5000ml,調pH值至7.2~8.0。
2.2 攻擊毒株CVS製備
啓開毒種,稀釋成10-2懸液,接種10~12g小鼠,不少於8只,每隻腦內接種0.03ml,連續傳2~3代,選擇接種4~5天有典型狂犬病症狀的小鼠腦組織,研磨後加入含2%馬血清或新生牛血清製成20%懸液,經每分鐘1000轉離心10分鐘,取上清液經病毒滴定(用10只18~20g小鼠滴定)及無菌檢查符合規定後作攻擊毒用。參考疫苗的稀釋 參考疫苗用PBS稀釋成1: 25、1: 125和1: 625等稀釋度。
2.3 供試品溶液的製備
供試品用PBS做5倍系列稀釋。測定法 用不同稀釋度的供試品及參考疫苗分別免疫12~14g小鼠16只,每隻小鼠腹腔注射0.5ml,間隔1周再免疫1次。
小鼠於第一次免疫後14天,用經預先測定的含5~100 LD50的病毒量進行腦內攻擊,每隻0.03ml;同時將攻擊毒稀釋成100、10-1、10-2和10-3進行毒力滴定,每個稀釋度均不少於8只小鼠。小鼠攻擊後逐日觀察14天,並記錄死亡情況,統計第5天后死亡和呈典型狂犬病腦症狀的小鼠。計算供試品和參考疫苗ED50值。
計算相對效力:

式中P爲供試品效價,IU/ml;
T爲供試品ED50的倒數;
dT爲供試品的1次人用劑量,ml;
2.4 【附註】
(2)各組動物均應在同樣條件下飼養。
(3)攻擊毒原病毒液(100)注射的小鼠應80%以上死亡。
3 附錄Ⅺ B 吸附破傷風疫苗效價測定法
本法系用破傷風毒素攻擊經供試品與標準品分別免疫後的小鼠(或豚鼠),比較其存活率,計算出供試品的效價。
3.1 標準品和供試品溶液的製備
用生理氯化鈉溶液將破傷風類毒素標準品和供試品以適當比例稀釋成3~5個稀釋度(居中的稀釋度必須在攻毒後能保護約半數動物)。測定法 用每一稀釋度的破傷風類毒素標準品和供試品溶液分別免疫體重14~16g同性別或雌雄各半NIH小鼠至少14只(或250~350g豚鼠至少10只),每隻小鼠皮下注射0.5ml(或每隻豚鼠皮下注射1ml)。另外10只未注射的小鼠作爲對照(或另外未注射的5只豚鼠作爲對照)。攻擊用破傷風毒素使用0.2%明膠磷酸鹽緩衝液稀釋。免疫4周後,每隻免疫小鼠皮下注射50LD50破傷風毒素0.5ml(或每隻免疫豚鼠皮下注射100LD50破傷風毒素1.0ml)。對照組每隻小鼠皮下注射1LD50破傷風毒素0.5ml(或對照組每隻。豚鼠注射1LD50破傷風毒素1.0ml)。攻擊後觀察5天,每日記錄結果。根據第5天存活率的劑量反應曲線,用平行線法計算結果。95%可信限應在效價的50%~200%,否則95%可信限的低限應大於相應品種中要求的效價規格。
3.2 【附註】
試驗成立應具備的條件;
(1)供試品的最低稀釋度能保護半數以上動物;
(2)供試品的最高稀釋度能保護半數以下動物;
(3)供試品和標準品的劑量反應曲線在平行性及直線性上的差異無顯著意義;
(4)對照組動物應部分死亡而不全部死亡。
4 附錄Ⅺ C 吸附白喉疫苗效價測定法
4.1 第一法 豚鼠毒素攻擊法(仲裁法)
本法系用白喉毒素攻擊經供試品與標準品分別免疫後的豚鼠,比較其存活率,計算出供試品的效價。
4.1.1 標準品和供試品溶液的製備
將標準品和供試品用生理氯化鈉溶液按等比間隔稀釋3~5個稀釋度,使中間稀釋度在攻毒後必須能保護約半數動物。
4.1.2 測定法
用稀釋好的標準品和供試品溶液分別免疫250~350g同性別或雌雄各半豚鼠,每個稀釋度至少免疫10只。另取5只不免疫豚鼠同時飼養,作爲對照。
免疫4周後,每隻免疫豚鼠皮下注射100LD50白喉毒素1.0ml。對照組豚鼠注射經100倍稀釋之上述毒索,每隻皮下注射1.0ml。攻毒後觀察5天,每日記錄動物死亡情況。根據第5天存活率,以標準品的效價爲標準,用平行線法計算供試品的效價。95%可信限應在效價的50%~200%,否則95%可信限的低限應大於相應品種中要求的效價規格。
4.1.3 【附註】
試驗成立的條件:
(1)供試品的最低稀釋度能保護半數以上動物;
(2)供試品的最高稀釋度能保護半數以下動物;
(3)對照組動物應部分死亡而不全部死亡;
(4)供試品和標準品的劑量反應曲線在平行性及直線性上的差異無顯著意義。
4.2 第二法 小鼠-Vero細胞法
本法系用Vero細胞法測定經供試品與標準品分別免疫後的小鼠血清中的白喉抗毒素水平,計算供試品的效價。
4.2.1 試劑
(1)適宜培養液 臨用時於培養液中加入新生牛血清、3%谷氨醯胺、青黴素、鏈黴素適量,使其終濃度分別爲10%、0.03%、100IU/ml和100IU/ml。用7%碳酸氫鈉溶液調pH值至7.0~7.2。
(2)無Ca2+、Mg2+緩衝液 稱取氯化鈉8.0g、氯化鉀0.2g、磷酸氫二鈉1.15g,加水溶解並稀釋至1000ml。
(3)0.25%胰酶溶液 稱取胰酶2.5g、乙二胺四乙酸二鈉0.2g,用無Ca2+、Mg2+緩衝液溶解,並稀釋至1000ml,用7%碳酸氫鈉溶液調pH值至7.0。
4.2.2 Vero細胞懸液的製備
將Vero細胞培養於150cm2培養瓶中,待單層細胞長滿至80%~100%時,棄去上層培養液,加入0.25%胰酶溶液10ml,置37℃消化數分鐘,棄去胰酶,加入10ml培養液,分散細胞進行計數,用培養液調整細胞濃度至每1ml含2.5×105個細胞。
4.2.3 標準品及供試品溶液的稀釋
用生理氯化鈉溶液將吸附白喉類毒素的標準品和供試品分別以2倍系列稀釋法稀釋成3~5個適當稀釋度。
4.2.4 測定法
(1)免疫與採血 用吸附白喉類毒素標準品和供試品的每一稀釋度分別免疫10~14g同性別NIH小鼠8只,每隻小鼠皮下注射0.5ml。免疫5周後,採血,分離血清,56℃、30分鐘滅能,於-20℃保存。
(2)陽性對照小鼠血清 用含白喉類毒素成分的疫苗免疫1批小鼠,免疫5周後採血,分離血清,56℃、30分鐘滅能,分裝小管,冷凍,於-20℃保存。
(3)毒素試驗量測定 Vero細胞測定白喉抗體試驗時毒素濃度採用1/10000Lcd。
在96孔培養板中用MEM培養液將毒素做2倍系列稀釋,每孔50μl,然後向各孔中加入標準白喉抗毒素(0.0001IU) 50μl,加蓋,室溫放置1小時後,加入Vero細胞懸液50μl,加蓋,用封板膜封板,於37℃二氧化碳孵箱培養6~7天后,觀察結果,使細胞死亡的最大毒素稀釋度(紅色)即1/10000Lcd。
1/10000Lcd的毒素量相當於1×10-4 Lf的毒素,適合本試驗。
①向每孔加入50μl培養液,但A11、A12孔和H11、
H12孔不加,而G11、G12孔加100μl培養液。
②取8份待檢血清,分別加入A1至H1孔各50μl,橫向做2倍系列稀釋,直至A10和H10孔。
③將標準白喉抗毒素稀釋至每1ml含0.008IU,加入A11、A12、B11和B12孔各50μl,從B11和B12孔開始豎向做2倍稀釋至D11和D12孔。
⑤除G11和G12孔外,向其餘各孔中加入毒素(1/10000Lcd) 50μl,輕輕轉動培養板,混勻,加蓋後,置室溫1小時。
⑥收集Vero細胞,進行計數,並稀釋成每1ml含2.5×105個細胞的懸液。
⑦室溫放置1小時的培養板,每孔立即加入50μl Vera細胞懸液,加蓋,用封板膜封板後,於37℃二氧化碳孵箱培養6~7天。
⑧取出培養板,根據培養液顏色變化記錄結果,黃色爲(+),紅色(-),顏色不明顯者則可用顯微鏡觀察,如單層細胞完整無損爲(+),否則記錄(-)。最終結果用以2爲底的指數表示,終點爲變成黃色的最高稀釋度孔的指數。例如變黃色的最後1孔稀釋倍數是256,即爲28,則結果記爲8。用平行線分析法進行結果計算。供試品和標準品的劑量反應曲線在平行性及直線性上的差異無顯著意義。95%可信限應在效價的50%~200%,否則95%可信限的低限應大於相應品種中要求的效價規格。
4.2.5 【附註】
試驗要求:
(1)E11、E12、F11和F12孔代表毒素量和Vero細胞敏感度,應出現(-),如果出現(+),則毒素量和細胞敏感度都很低,應重試;
(2)細胞孔G11、G12和陽性對照孔H11、H12都必須是(+),如出現(-),應重試;
(3)如毒素用量準確(1/10000Lcd),則A11、A12和B11、B12孔均應爲(+),而C11、C12和D11、D12均應爲(-),否則應重試;
(4)細胞計數應準確。
5 附錄Ⅺ D 類毒素絮狀單位測定法
本法系依據類毒素與相應抗毒素在適當的含量、比例、溫度、反應時間等條件下,可在試管中發生抗原抗體結合,產生肉眼可見的絮狀凝集反應。根據抗毒素絮狀反應標準品可測定供試品的絮狀單位值。試劑 硼酸鹽緩衝液 稱取四硼酸鈉(Na2B4O7·10H2O) 0.5g、硼酸4.5g、氯化鈉8.5g,加水溶解並稀釋至1000ml。pH值爲7.0~7.2。
5.1 標準品溶液的製備
精密量取白喉或破傷風抗毒素絮狀反應國家標準品,用硼酸鹽緩衝液準確稀釋至每1ml含100Lf的溶液。
5.2 供試品溶液的製備
5.3 測定法
精密量取每1ml含100Lf的抗毒素絮狀反應標準品溶液0.3ml、0.4ml、0.5ml、0.6ml、0.7ml,分別加入絮狀反應管,精密量取供試品溶液1ml,快速準確加入上述各絮狀反應管內,搖勻,置45~50℃水浴中,連續觀察,並記錄絮狀出現次序和時間。再取5支絮狀反應管,重複上述試驗,將最先出現絮狀之管放中間,前後各加兩管不同量抗毒素絮狀反應標準品溶液,每管間隔0.05ml,再向各管中加入供試品1ml,觀察絮狀出現情況。根據結果,再重複試驗1次,將最先出現絮狀之管放中間,前後各加兩管不同量抗毒素絮狀反應標準品溶液,每管間隔0.02ml,同上法觀察並記錄結果,以2~3次相同值爲最終測定值。
按下式計算:
供試品絮狀單位(Lf/ml)=V×n×100式中V爲最先出現絮狀時使用的每1ml含100Lf的抗毒素絮狀反應標準品溶液的體積,ml;
n爲供試品稀釋倍數。
6 附錄Ⅺ E 白喉抗毒素效價測定法(家兔皮膚試驗法)
本法系依據抗毒素能中和毒素的作用,將供試品與標準品進行對比試驗,推算出每1ml供試品中所含抗毒素的國際單位數(IU/ml)。
6.1 試劑
稀釋液(硼酸鹽緩衝鹽水) 稱取氯化鈉8.5g、硼酸4.5g、四硼酸鈉(Na2B4O7·10H2O) 0.5g,加水溶解並稀釋至1000ml,過濾,滅菌後pH值爲7.0~7.2。
6.2 白喉抗毒素標準品溶液的製備
取白喉抗毒素標準品適量,稀釋至每1ml含1/15IU,即與毒素等量混合後每0.1ml注射量中含1/300IU。白喉抗毒素標準品原倍溶液的一次吸取量應不低於0.5ml。
6.3 供試品溶液的製備
將供試品稀釋成數個稀釋度,使每1ml含抗毒素約1/15 IU,其稀釋度間隔約爲5%~10%。
6.4 測定法
將毒素稀釋至每1ml含20個試驗量(1/300L),即與抗毒素等量混合後每0.1ml注射量中含1個試驗量(1/300Lr)。定量吸取稀釋後的抗毒素標準品溶液及不同稀釋度的供試品溶液分別加入小試管中,每管加入等量的稀釋毒素溶液,混合均勻,加塞,37℃結合1小時後,立即注射。
選用體重2~3kg的健康白皮膚家兔,試驗前1天用適宜方法進行背部脫毛,凡皮膚發炎或出現大量斑點現象者不應使用。每份供試品溶液注射2只家兔,每隻家兔不能超過4份供試品溶液。每稀釋度注射0.1ml於家兔皮內(應在近背脊兩側)。每隻家兔至少應包括3個不同注射部位(前、中、後)的對照試驗。標準品溶液與供試品溶液不得用同一支注射器注射。
6.5 結果判定
試驗家兔於注射後48小時及72小時各觀察1次,並測量反應面積。以48~72小時結果作最後判定。注射對照部位一般於48~72小時內輕度發紅,其直徑應爲10~14mm。供試品的效價應以與多數對照的反應強度相同的最高稀釋度判定之,但反應強度不得超過對照。有下列情況之一者應重試:
(2)供試品的稀釋度過高或過低;
(3)反應不規則。
6.6 【附註】
毒素由國家藥品檢定機構提供,亦可自行製備,但應選經保存1年以上、毒力適宜的毒素。試驗用的毒素須以國家藥品檢定機構分發的標準抗毒素準確標定其試驗量(1/300Lr),並應每3個月複檢1次。毒素應保存於2~8℃避光處,並加入甲苯或其他適宜防腐劑。
7 附錄Ⅺ F 破傷風抗毒素效價測定法(小鼠試驗法)
本法系依據抗毒素能中和毒素的作用,將供試品與標準品進行對比試驗,推算出每1ml供試品中所含抗毒素的國際單位數(IU/ml)。
7.1 試劑
硼酸鹽緩衝鹽水 稱取氯化鈉8.5g、硼酸4.5g、四硼酸鈉(Na2B4O7·10H2O)0.5g,加水溶解並稀釋至1000ml,過濾,滅菌後pH值爲7.0~7.2。
7.2 破傷風抗毒素標準品溶液的製備
(1)破傷風抗毒素標準品的稀釋 抗毒素標準品用硼酸鹽緩衝鹽水稀釋至每1ml含0.5IU,即與毒素等量混合後每0.4ml注射量中含1/10IU。抗毒素標準品原倍溶液的1次吸取量應不低於0.5ml。
(2)破傷風毒素的稀釋 毒素用硼酸鹽緩衝鹽水稀釋至每1ml含5個試驗量(1/10L+),即與抗毒素等量混合後每0.4ml注射量中含1個試驗量(1/10L+)。試驗用的毒素須以國家藥品檢定機構頒發的抗毒素標準品準確標定其試驗量(1/10L+),並須每3個月複檢1次。供試品溶液的製備 用硼酸鹽緩衝鹽水將供試品稀釋成數個稀釋度,使每1ml含抗毒素約0.5IU,即與毒素等量混合後每0.4ml注射量中含抗毒素約1/10IU。稀釋度的聞隔約爲5%。
7.3 測定法
定量吸取稀釋後的抗毒素標準品溶液及不同稀釋度的供試品溶液,分別加入小試管中,每管加入等量的稀釋毒素溶液,混合均勻,加塞,37℃結合1小時後,立即注射。
於17~19g小鼠腹部或大腿根都皮下注射0.4ml,應注意勿使注射液流出,標準品及供試品的每個稀釋度各注射小鼠至少3只。標準品溶液與供試品溶液不得用同一支注射器注射。同一供試品的不同稀釋度溶液可用同一支注射器注射。由高稀釋度向低稀釋度依次注射。在更換稀釋度時應用下一稀釋度溶液洗2~3次。每日上、下午至少觀察試驗小鼠1次,連續5天,並記錄其發病及死亡情況。
7.4 結果判定
對照小鼠應於72~120小時內全部死亡。供試品的效價爲與對照小鼠同時死亡或出現破傷風神經毒症狀最重者的最高稀釋度。
有下列情況之一者應重試:
(1)供試品的稀釋度過高或過低;
(2)對照試驗小鼠在72小時前或120小時後死亡;
(3)死亡不規則以及在同一稀釋度的小鼠中有2只以上屬非特異死亡。
7.5 【附註】
使用乾燥毒素時,須精密稱定,每次稱取量應不低於10mg。毒素溶解後應一次用完。剩餘的乾燥毒素應封存於裝有乾燥劑的真空器皿中,亦可用乾燥毒素製成液體毒素,即乾燥毒素以生理氯化鈉溶液溶解,與中性甘油(經116℃、10分鐘滅菌)等量混合,每1ml至少含20個試驗量。毒素應保存於2~8℃避光處。
8 附錄Ⅺ G 氣性壞疽抗毒素效價測定法(小鼠試驗法)
本法依據抗毒素能中和毒素的作用,將供試品與標準品做系列稀釋,分別與相應毒素結合,注入小鼠體內,在規定的時間內,比較小鼠存活和死亡情況,以測定供試品效價。
8.1 試劑
(1)稀釋液 稱取氯化鈉8.5g、硼酸4.5g、四硼酸鈉(Na2B4O7·H2O)0.5g,用水溶解並稀釋至1000ml,過濾。滅菌後pH值應爲7.0~7.2。
(2)氣性壞疽毒素溶液 由國家藥品檢定機構提供,亦可自備。試驗用的氣性壞疽毒素須以國家藥品檢定機構分發的氣性壞疽抗毒素標準品準確標定其試驗量(見測定參數表),並每3個月複檢1次。使用前將毒素用稀釋液稀釋至每1ml含5個(水腫型爲20個)毒素試驗量。氣性壞疽抗毒素標準品溶液的製備 氣性壞疽(產氣莢膜、水腫、敗毒、溶組織)抗毒素標準品由國家藥品檢定機構提供,於2~8℃處避光保存。使用時,將氣性壞疽抗毒素標準品溶液用稀釋液稀釋至每1ml含測定參數表所示效價。氣性壞疽抗毒素標準品原倍溶液的1次吸取量應不低於0.5ml。
8.2 供試品溶液的製備
將供試品用稀釋液稀釋成數個稀釋度,使每1ml約含5個試驗量(水腫型爲20個試驗量)。各稀釋度之間的間隔約爲5%~10%。
8.3 測定法
精密量取氣性壞疽抗毒素標準品溶液0.8ml、1.0ml、1.2ml分別置小試管中,按管序分別補加稀釋液0.7ml、0.5ml、0.3ml。精密量取不同稀釋度的供試品溶液各1.0ml分別加入小試管中,每管補加稀釋液0.5ml(可在抗毒素之前加入)。以上各管分別加入氣性壞疽毒素溶液1.0ml(水腫型爲0.5ml),混合均勻,加塞,20~25℃結合1個小時,按測定參數表所示劑量與途徑,立即注射17~19g小鼠。每稀釋度注射小鼠4只。結果判定 每天上、下午各觀察試驗動物1次,並記錄發病及死亡情況,連續3天。標準品組動物在3天內,注射氣性壞疽抗毒素量最少(即0.8ml)的4只動物中至少應有2只以上死亡。對比標準品組與供試品組動物死亡情況,推算供試品的效價。
有下列情況之一者應重試:
(1)標準品組動物在3天內全部死亡或者全無死亡,或者注射氣性壞疽抗毒素量最少的4只動物死亡不足半數,注射氣性壞疽抗毒素量最多的4只動物死亡超過半數;
(2)供試品組動物在3天內全部死亡或者全無死亡;
(3)動物死亡數極不規則,以致無法進行判定;
(4)每稀釋度注射的動物中有2只以上屬非特異死亡。
稀釋 | 混合 | 注射 | |||||||||
抗毒素種類 | 毒素試驗量 | /IU·ml-1 | 毒素試 驗量/ml | /ml | /ml | 稀釋液/ml | /ml | /IU | 毒素試驗量 | 動物 /只 | 途徑 |
產氣莢膜 敗毒 溶組織 | 1/5L+ L+ 1/2L+ 1/50L+ | 1.0 5.0 2.5 0.2 | 5 5 5 20 | 1.0 1.0 1.0 1.0 | 1.0 1.0 1.0 0.5 | 0.5 . 0.5 0.5 0.5 | 0.5 0.5 0.5 0.2 | 1/5 1 1/2 1/50 | 1 1 1 1 | 4 4 4 4 | 肌內 |
8.4 【附註】
(1)自備氣性壞疽毒素的製法(包括菌種、培養基、培養條件及乾燥方法等)應與國家藥品檢定機構分發者相同。
(2)使用乾燥氣性壞疽毒素時,須精密稱定,每次稱取量應不低於10mg,溶解後應1次用完。剩餘的乾燥毒素應封存於裝有乾燥劑的真空器皿中,亦可用乾燥毒素製成液體毒素,即乾燥毒素以生理氯化鈉溶液溶解,與中性甘油(經116℃、10分鐘滅菌)等量混合,每1ml至少含50個試驗量。毒素應保存於2~8℃避光處。
9 附錄Ⅺ H 肉毒抗毒素效價測定法(小鼠試驗法)
本法系依據抗毒素能中和毒素的作用,將供試品與標準品做系列稀釋,分別與肉毒毒素結合後,注入小鼠體內,在規定時間內觀察小鼠存活和死亡情況,以測定供試品效價。
9.1 試劑
稀釋液 稱取磷酸二氫鉀0.7g、磷酸氫二鈉(Na2HPO4·12H2O)2.4g、氯化鈉6.8g,用注射用水溶解並稀釋至1000ml,加明膠2.0g,溶解後過濾。滅菌後pH值應爲6.2~6.8。
9.2 肉毒抗毒素標準品溶液的製備
將肉毒抗毒素標準品用生理氯化鈉溶液溶解後,與中性甘油(經116℃、10分鐘滅菌)等量混合,稀釋至一定濃度,於2~8℃避光處保存。使用前,將肉毒抗毒素標準品溶液用稀釋液稀釋至每1ml含效價如測定參數表所示。肉毒抗毒素標準品原倍溶液的1次吸取量應不低於0.5ml。
稀釋 | 混合 | 注射 | |||||||||
種類 | 毒素試 驗量 | /IU·ml-1 | 毒素試 驗量/ml | /ml | 試驗毒 素/ml | 稀釋液 /ml | /ml | /IU | 毒素試 驗量 | 動物 /只 | 途徑 |
A B C D E F | 1/5L+ 1/10L+ L+ L+ 1/50L+ 1/20L+ | 1.0 0.5 5.0 5.0 0.1 0.25 | 5 5 5 5 5 5 | 1.0 1.0 1.0 1.0 1.0 1.0 | 1.0 1.0 1.0 1.0 1.0 1.0 | 0.5 0.5 0.5 0.5 0.5 0.5 | 0.5 0.5 0.5 0.5 0.5 0.5 | 1/5 1/10 1 1 1/50 1/20 | 1 1 1 1 1 1 | 4 4 4 4 4 4 | 腹腔 腹腔 腹腔 腹腔 腹腔 腹腔 |
9.3 肉毒毒素溶液的製備
肉毒毒素由國家藥品檢定機構提供,亦可自備。試驗用的肉毒毒素須以國家藥品檢定機構分發的肉毒抗毒素標準品準確標定其試驗量(見測定參數表),並每3個月複檢1次。使用前,將肉毒毒素用稀釋液稀釋至每1ml含5個毒素試驗量。
9.4 供試品溶液的製備
供試品用稀釋液稀釋成數個稀釋度,使每1ml約含測定參數表所示單位。稀釋度之間隔約爲5%~10%。
9.5 測定法
精密量取肉毒抗毒素標準品溶液0.8ml、1.0ml、1.2ml分別加入小試管中,再依次分別補加稀釋液0.7ml、0.5ml、0.3ml。精密量取不同稀釋度的供試品溶液各1.0ml分別加入小試管中,每管補加稀釋液0.5ml。以上各管分別加入肉毒毒素稀釋液1.0ml,混合均勻,加塞,37℃結合45分鐘,按測定參數表所示劑量與途徑,立即注射體重14~16g小鼠,每稀釋度注射小鼠4只。
9.6 結果判定
注射後,每天上、下午各觀察試驗動物1次,並記錄發病及死亡情況,連續4天。以標準品組動物50%死亡終點比較供試品組動物的50%保護終點,推算供試品的效價。
有下列情況之一者應重試:
(1)標準品組動物無死亡或全死亡,或死亡極不規律而無法計算50%死亡終點;
(2)供試品組動物無死亡或全死亡,或死亡極不規律而無法計算50%保護終點;
(3)每稀釋度注射的動物中有2只以上屬非特異死亡。
9.7 【附註】
(1)自備毒素的製法(包括菌種、培養基、培養條件及乾燥方法等)應與國家藥品檢定機構分發者相同。
(2)使用乾燥毒素時,須精密稱定,每次稱量應不低於10mg,溶解後應1次用完。剩餘的乾燥毒素應封存於裝有乾燥劑的真空器皿中,亦可用乾燥毒素製成液體毒素,即乾燥毒素以生理氯化鈉溶液溶解,與中性甘油(經116℃、10分鐘滅菌)等量混合,每1ml至少含20個試驗量。毒素應保存於2~8℃避光處。
10 附錄Ⅺ I 抗蛇毒血清效價測定法(小鼠試驗法)
本法系依據抗蛇毒血清能中和蛇毒的作用,將供試品與標準品做系列稀釋,分別與定量蛇毒相混合,注射小鼠後,比較標準品組和供試品組的小鼠死亡時間和數量,計算出供試品的效價。
10.1 試劑
稀釋液 稱取氯化鈉8.5g、硼酸4.5g、四硼酸鈉(Na2B4O7·10H2O) 0.5g,用注射用水溶解並稀釋至1000ml,過濾,滅菌後pH值應爲7.0~7.2。
10.2 抗蛇毒血清標準品溶液的製備
將抗蛇毒血清標準品用稀釋液稀釋至每1ml含5U(抗銀環蛇、抗蝮蛇毒血清)、5IU(抗眼鏡蛇毒血清)或10U(抗五步蛇毒血清),即與5個相應蛇毒試驗量混合後每0.4ml注射量分別含相應抗蛇毒血清效價1U或2U。
10.3 蛇毒溶液的製備
蛇毒須以國家藥品檢定機構分發的抗蛇毒血清標準品準確標定其試驗量(蝮蛇、眼鏡蛇及銀環蛇1個L+,五步蛇2個L+),將蛇毒稀釋至其5個試驗量不高於0.8ml。即在與抗蛇毒血清混合後,補加稀釋液至2ml時,每0.4ml注射量中含1個試驗量。
10.4 供試品溶液的製備
將供試品稀釋成數個稀釋度,使每1ml含抗蝮蛇、抗眼鏡蛇或抗銀環蛇毒血清效價約5U;抗五步蛇毒血清效價約10U。各稀釋度間隔5%~10%。
10.5 測定法
量取不同稀釋度供試品溶液各1.0ml、抗蛇毒血清標準品溶液1ml作爲對照①、抗蛇毒血清標準品溶液1.2ml作爲對照②,將上述抗蛇毒血清分別置小試管中,每管加入5個試驗量與供試品溶液相應的蛇毒溶液,補加稀釋液至2ml(即供試品每0.4ml注射量中含1個試驗量或2個試驗量),混合均勻,加塞,置37℃結合45分鐘後立即注射小鼠。
將每個稀釋度的供試品溶液、對照①及對照②各注射體重18~20g小鼠4只,每隻腹腔注射0.4ml。
10.6 結果判定
每日觀察1次試驗小鼠,觀察48~72小時,並記錄發病及死亡情況。對照①小鼠死亡不低於50%,對照②小鼠應比對照①死亡晚、死亡只數少或不死亡。供試品溶液之效價爲與對照①小鼠死亡情況(時間、數量)相同之最高稀釋度。
試驗小鼠死亡情況發生倒置或對照不成立,應重試。
10.7 【附註】
(1)注射動物要做到量準、部位準,同時要防止注射液流出。
(2)使用乾燥毒素時,須精密稱定,每次稱量應不低於5mg,溶解後應在3天內(保存於2~8℃)用完。乾燥毒素應封存於裝有乾燥劑的真空器皿中,亦可將凍幹蛇毒配成液體蛇毒,即將蛇毒復溶後與中性甘油(116℃、10分鐘滅菌)等量混合。每1ml至少含50個試驗量,保存於2~8℃避光處。
11 附錄Ⅺ J 狂犬病免疫球蛋白效價測定法
11.1 第一法 小鼠中和試驗法(仲裁法)
本法系依據供試品中狂犬病免疫球蛋白能中和狂犬病病毒的作用,將供試品和標準品做系列稀釋,分別與狂犬病病毒懸液混合,小鼠腦內注射,在規定時間內觀察小鼠存活和死亡情況,以測定供試品效價。
11.1.1 試劑
(1)磷酸鹽緩衝液(PBS) 稱取磷酸二氫鉀0.24g、磷酸氫二鈉(Na2HPO4·12H2O) 1.44g、氯化鈉8.0g,加水溶解並稀釋至1000ml,用氫氧化鈉調pH值至7.2~8.0。
(2)2%新生牛血清磷酸鹽緩衝液 量取PBS 98ml,加入2ml滅能新生牛血清。臨用前配製。
(3) 20%新生牛血清磷酸鹽緩衝液 量取PBS 80ml,加入20ml滅能新生牛血清。臨用前配製。
11.1.2 中和用病毒懸液的製備
(1)病毒懸液的製備 取CVS毒種(一般爲凍幹毒種)製成10-2懸液,製法見本法(2)項,腦內接種體重10~12g小鼠每隻0.03ml,待發病後取鼠腦再製成10-2懸液,接種於小鼠腦內進行傳代,一般傳2~3代。選用第5天發病並麻痹的鼠腦以脫脂牛乳研磨稀釋成20%的腦懸液,按0.5ml分裝安瓿,凍幹後真空封口,製成凍幹中和用病毒,-30℃凍存待用;或用第5天發病並麻痹的鼠腦用20%新生牛血清磷酸鹽緩衝液研磨稀釋成10-1懸液,以每分鐘2000轉離心20分鐘,取上清液混勻後分裝小管,-70℃凍存待用。
①凍幹病毒的預測 取含20%腦懸液的凍幹病毒,啓開後加入2%新生牛血清磷酸鹽緩衝液1.0ml,吹打均勻後加入4.0ml 2%新生牛血清磷酸鹽緩衝液與病毒液充分混勻,以每分鐘1500轉離心10分鐘,取上清液與等量的2%新生牛血清磷酸鹽緩衝液混合即爲10-2懸液,然後再稀釋至10-3、10-4、10-5、10-6,從10-6~10-2的稀釋液中各取0.5ml置5個小管內,每管再加入2%新生牛血清磷酸鹽緩衝液0.5ml,置37℃水浴1小時。用體重10~12g小鼠30只,分成5組,每組6只,用經37℃作用的10-6~10-2病毒懸液接種小鼠,每個稀釋度接種6只小鼠,每隻小鼠腦內接種0.03ml,每天觀察小鼠發病死亡情況,觀察14天,接種後4天內死亡的小鼠按非特異性死亡計。以接種5天后的發病死亡小鼠統計LD50。
②-70℃凍存病毒的預測 取含10%腦懸液的冰凍病毒,融化後即爲10-1懸液,然後再稀釋至10-2~10-7。從10-7~10-3各取0.5ml加至5個小管內,每管再加入2%新生牛血清磷酸鹽緩衝液0.5ml,置37℃水浴1小時。用體重10~12g小鼠30只,分成5組,每組6只,用經37℃作用的10-7~10-3病毒懸液接種小鼠,每個稀釋度接種小鼠6只,每隻小鼠腦內接種0.03ml,每天觀察小鼠發病死亡情況,觀察14天。接種後4天內死亡的小鼠按非特異性死亡計。以接種5天后的發病死亡小鼠統計LD50。
(3)中和用病毒懸液的製備 按病毒懸液預測的100LD50的病毒稀釋度作爲中和用病毒懸液稀釋倍數,用於小鼠中和試驗。要求中和用病毒懸液經37℃水浴作用1小時的病毒量在32~320LD50之間。
狂犬病免疫球蛋白標準品溶液的製備 由國家藥品檢定機構提供,或用經國家藥品檢定機構認可的各生產單位工作用標準品。配製方法按使用說明書進行。
11.1.3 供試品溶液的製備
用2%新生牛血清磷酸鹽緩衝液將供試品做2倍稀釋,一般可採用1: 800、1:1600、…、1:102400,但可根據供試品實際效價適當降低或提高最低稀釋倍數,如採用上述8個稀釋倍數,則按稀釋液2.7ml加入供試品0.3ml作爲1:10供試品溶液,然後再用稀釋液3.5ml加入混勻的1:10的供試品溶液0.5ml作爲1:80供試品溶液,再按稀釋液2.7ml加入1:80的供試品溶液0.3ml作爲1:800供試品溶液(1)。再按0.5ml加0.5ml做倍比稀釋製備供試品溶液(2)~(8),它們的稀釋倍數依次爲1:1600、1:3200、1:6400、1:12800、1:25600、1:51200和1:102400.
11.1.4 測定法
取8個稀釋度的供試品溶液(1)~(8)各0.5ml置8支小試管中,另取8個稀釋度的標準品溶液各0.5ml置8支小試管中,共16支小試管,分別加入中和用病毒懸液0.5ml,置37℃水浴1小時,供注射小鼠用。另用相同體重的小鼠測定中和用病毒懸液的實際LD50,其方法可將中和用病毒懸液作爲原倍再稀釋100、10-1、10-2、10-3共4個稀釋度,以上4個稀釋度各加入0.5ml於小管內,每管再加入2%新生牛血清磷酸鹽緩衝液0.5ml,同樣置37℃水浴1小時作爲中和病毒對照。將已中和的供試品和標準品的不同稀釋度的懸液以及病毒對照分別接種小鼠,供試品和標準品按從濃到稀的稀釋度接種小鼠,而病毒對照則按從稀到濃的稀釋度接種小鼠。小鼠體重10~12g,每隻小鼠腦內接種0.03ml。每稀釋度注射6只小鼠。
每天記錄小鼠的發病死亡情況,共觀察14天,接種後4天內死亡的小鼠作爲非特異性死亡計。

式中 B1爲供試品ED50的倒數;
D爲標準品的國際單位,IU/ml。
11.2 第二法 快速熒光竈抑制試驗法
本法系依據供試品中狂犬病免疫球蛋白能中和狂犬病病毒的作用,將供試品和標準品做系列稀釋,分別與狂犬病病毒懸液混合,感染敏感細胞,在規定的時間內用熒光抗體染色並觀察熒光竈減少的情況,以測定供試品效價。
11.2.1 試劑
(1)含5%新生牛血清的DMEM細胞培養基取含5%新生牛血清的DMEM細胞培養基,加入抗生素,使其終濃度爲100U/ml抗生素,並加入谷氨醯胺,使其終濃度爲0.03%,臨用前配製並按DMEM介紹要求加入適量NaHCO3調pH值至7.6。
(2)含10%新生牛血清的DMEM細胞培養基 取含10%新生牛血清的DMEM細胞培養基,加入抗生素,使其終濃度爲100U/ml抗生素,並加入谷氨醯胺,使其終濃度爲0.03%,臨用前配製並按DMEM介紹要求加入適量NaHCO3調pH值至7.6。
(3)磷酸鹽緩衝液(PBS) 稱取磷酸二氫鉀0.24g、磷酸氫二鈉(Na2HPO4·12H2O)1.44g、氯化鈉8g,加水溶解並稀釋至1000ml,用氫氧化鈉調pH值至7.2。臨用前配製。
(4)80%冷丙酮 量取80ml丙酮,加入0.1mol/LPBS (pH7.6)20ml,混勻後密封,於4℃保存。
(5)80%甘油 量取80ml甘油,加入20ml水中,混勻,加蓋後於4℃保存。
(6)0.25%胰蛋白酶-EDTA。
(7) FITC標記的狂犬病病毒核蛋白抗體 按使用說明書要求稀釋到工作濃度。
11.2.2 中和用病毒的製備
(1)病毒懸液的製備 取CVS-11毒種(一般爲凍幹毒種)做適當稀釋,以0.1MOI的感染量接種生長良好的BSR細胞,於37℃、5%二氧化碳條件下培養1天后轉入34℃繼續培養,2天后收集培養上清,於4℃以每分鐘4000轉離心10分鐘去除細胞碎片,取上清液加入10%新生牛血清,混勻後分裝小管,-70℃以下凍存備用。病毒液的預滴定:取凍存的病毒懸液1支,經流水速融後,在24孔培養板上從1:5開始做5倍系列稀釋,取100μl病毒液加入400μl含10%滅能新生牛血清的DMEM培養液中,充分混勻後,每個稀釋度取50μl轉移至96孔培養板,每個稀釋度平行做2份,每孔再加入5×106/ml的BSR細胞懸液50μl,於37℃、5%二氧化碳條件下培養24小時。培養結束後棄上清,PBS洗1遍,再加入80%冷丙酮,每孔50μl,4℃固定30分鐘,或-30℃固定10分鐘,棄丙酮,待揮發乾燥後每孔加入50μl工作濃度的FITC標記的狂犬病病毒核蛋白抗體染色,於37℃孵育30分鐘,用PBS洗3遍,甩幹,每孔加80%甘油50μl,於熒光顯微鏡下觀察;計數每孔中的熒光竈數,取每孔熒光竈數在30以下的孔,記錄相鄰4孔熒光竈數,取其平均值,計算如下:
病毒滴度(FFU/ml)=(最高稀釋倍數孔熒光竈平均值×5+相鄰孔稀釋倍數較低的熒光竈平均值)/2×稀釋倍數較低孔病毒稀釋倍數×20
(2)中和用病毒液的製備 取病毒懸液1支,按病毒液的預滴定同法操作。在熒光顯微鏡下計數每孔中的熒光竈比例,以80%~95%的細胞被病毒感染的病毒稀釋度爲中和試驗用病毒稀釋度。
取凍存的病毒懸液1支,經流水融化後,用含5%滅能新生牛血清的DMEM培養液將病毒稀釋至中和試驗用病毒稀釋度,置冰浴備用。
11.2.3 狂犬病免疫球蛋白標準品溶液的製備
狂犬病免疫球蛋白標準品由國家藥品檢定機構提供,或用經國家藥品檢定機構標定的工作用標準品。配製方法按使用說明書進行。用含10%滅能新生牛血清的DMEM培養液將狂犬病免疫球蛋白標準品做3倍系列稀釋,即在96孔培養板中每孔預先加入100μl培養液,取50μl供試品加入其中,成爲1:3稀釋度,充分混合後,吸取50μl加入下一孔100μl培養液中,成爲1:9稀釋度,如此係列稀釋若干孔至適宜稀釋度。
11.2.4 供試品溶液的製備
供試品(血清樣品應預先經56℃、30分鐘滅能)用含10%[1]滅能新生牛血清的DMEM培養液做3倍系列稀釋,即在96孔培養板中每孔預先加,入100μl培養液,取50μl供試品加入其中,即爲1:3稀釋度,充分混合後,吸取50μl加入下一孔100μl培養液中,成爲1:9稀釋度,如此係列稀釋若干孔至適宜稀釋度,最後一孔中50μl棄去[1]。
11.2.5 測定法
將稀釋後的標準品及供試品各孔中加人中和用病毒,50μl/孔[1],同時設正常細胞對照孔[1](只加100μl DMEM於孔中),以及中和用病毒對照孔(含5%滅能新生牛血清的DMEM 100μl[1],加入中和用病毒50μl),混勻後置37℃中和1小時,每孔加入1×106個/ml的BSR細胞懸液50μl,於37℃、5%二氧化碳條件下培養24小時。待培養結束吸乾培養液,每孔中加入PBS 100μl清洗並吸乾後,每孔加入預冷至4℃的[1]80%冷丙酮50μl,4℃固定30分鐘,或-30℃固定10分鐘,棄丙酮,待揮發乾燥後加入工作濃度的熒光標記狂犬病病毒核蛋白抗體,50μl/孔,37℃孵育30分鐘,棄去液體,用PBS洗板2~3次,甩幹,每孔加入80%甘油50μl,熒光顯微鏡下觀察。計算公式如下:
n1爲標準品稀釋倍數。
n2爲供試品稀釋倍數。
供試品效價(IU/ml) =10(J-K)×L
K爲供試品lgED50;
11.3 【附註】
(1)中和用病毒滴度不得小於106FFU/ml。
(2)病毒稀釋時,應儘可能在冰浴中進行。
12 附錄Ⅺ K IgG含量測定法(紫外-可見分光光度法)
本法系依據免疫球蛋白G (IgG)與相應的抗體特異性結合後,在適宜的電解質、溫度、pH條件下,產生凝集反應,形成抗原抗體複合物,根據供試品的吸光度求出供試品中IgG的含量。
12.1 試劑
(1)緩衝液 稱取三羥甲基氨基甲烷(Tris)12.42g、氯化鈉9g、聚乙二醇6000 50g、牛血清白蛋白(BSA) 1g、疊氮鈉(NaN3) 1g,加水溶解,用1.0mol/L鹽酸調pH值至7.4,加水稀釋至1000ml。
(2)抗人IgG血清 按介紹要求將凍幹抗人IgG血清復溶,按標示效價取一定量抗人IgG血清,加緩衝液稀釋至抗體最終效價爲1:4(例如抗人IgG血清效價爲1:100,量取原液2ml加抗體緩衝液48ml),充分混勻,0.45μm膜過濾。4℃保存備用。
12.2 IgG標準品溶液的製備
用生理氯化鈉溶液將IgG標準品在每1ml含0.2~6.0mg範圍內做適當的系列稀釋(通常做5個稀釋度)。
12.3 供試品溶液的製備
用生理氯化鈉溶液將供試品稀釋成高、中、低3個稀釋度,其IgG含量均應在標準曲線範圍內。
12.4 測定法
取供試品溶液10μl,加入已預熱至37℃的抗體液1ml,混勻,每個稀釋度做2管,置37℃水浴中保溫1小時,充分混勻,照紫外-可見分光光度法(2010年版藥典三部附錄Ⅱ A),在波長340nm處分別測定吸光度。
用IgG標準品溶液10μl替代供試品溶液,同法操作。計算標準品和供試品不同稀釋度溶液的吸光度的均值。以標準品溶液的IgG含量的對數對其相應的吸光度的對數作直線迴歸,求得直線迴歸方程,相關係數應不低於0.99,然後將供試品溶液吸光度的對數值代入直線迴歸方程,求得值的反對數,再乘以稀釋倍數,求取每1ml供試品溶液IgG含量,再由供試品各稀釋度IgG含量求平均值,即爲供試品IgG含量(g/L)。
12.5 【附註】
(2)設置紫外分光光度計狹縫寬度(Slit Width)爲2nm。
13 附錄Ⅺ L 猴體神經毒力試驗
應使用體重1.5kg以上的健康獼猴,獼猴血清經1:4稀釋後應證明不含同型別病毒中和抗體。試驗用獼猴必須經選擇和檢疫,並未做過其他試驗,其隔離檢疫應不少於6周,應無結核、B病毒感染及其他急性傳染病,血清中無泡沫病毒。凡有嚴重化膿竈、贅生物以及明顯的肝腎病理改變者不得用於試驗,可採用脊髓注射方法或腦內注射方法。
13.1 脊髓法
13.1.1 (1)獼猴的數量
猴體試驗必須設立參考品。評價Ⅰ、Ⅱ型供試品及其參考品最少應各使用11只有效獼猴,評價Ⅲ型供試品應至少使用18只有效獼猴。獼猴的大小和性別應隨機分配到各試驗組。同型參考品可用於測試1批以上疫苗。
有效獼猴係指脊髓灰質炎病毒引起中樞神經系統的特異性神經元損傷的獼猴。
供試品組有效獼猴不足時,允許補足,但參考品組應同時補充相同數量的獼猴。如需補足參考品組有效獼猴,則供試品組也須同時補充相同數量獼猴。如試驗需要2個工作日,則每1個工作日用供試品和同型參考品接種的獼猴只數應相等。爲了保證有效獼猴只數,通常要相應地增加接種獼猴只數。
13.1.2 (2)供試品和參考品的病毒滴度
供試品和參考品的病毒含量應調整到儘可能接近,每隻獼猴於腰髓第一、二椎間隙注射0.1ml(病毒含量6.5~7.5lgCCID50/ml),僅用1個病毒濃度接種動物。
13.1.3 (3)檢查法
金部獼猴應觀察17~22天。在接種24小時後死亡獼猴應做屍體解剖,檢查是否系因脊髓灰質炎引起的死亡。因其他原因死亡的獼猴在判定時可以剔除。在觀察期內存活的獼猴數不低於80%時,試驗成立。呈瀕死狀態或嚴重麻痹的獼猴應處死進行屍檢。
每隻獼猴取中樞神經系統切片進行組織學檢查。切片厚度爲10~15μm,沒食子藍染色檢查切片數如下:腰膨大12個切面;
中腦1個切面;
1級 僅有細胞浸潤(這不足以認爲是有效獼猴);2級 細胞浸潤伴有少量的神經元損害;
切片中有神經元損害,但未見針跡者應視爲有效獼猴。切片中由外傷引起的損害,而又無特異的病理改變則不視爲有效獼猴。
嚴重程度的分值是由腰髓,頸髓和腦組織切片的整個切片的計分累計而成的。每隻有效獼猴的病變分值(LS)爲:

再計算每組有效獼猴的平均分值。
參考品的平均病變分值在上限與下限之間時,才能根據C1、C2、C3值判定疫苗合格與否。判定標準如下:疫苗的平均病變分值(  test)與參考品的平均病變分值(
test)與參考品的平均病變分值(  ref)相比較
ref)相比較
合格  test-
test-  ref
ref
不合格  test-
test-  ref>C2
ref>C2
重試Ⅰ  1<
1<  test-
test-  ref
ref
重試Ⅱ 同一次試驗中,疫苗組平均分值與參考組平均分值之差小於C1時,而疫苗組中如單隻獼猴最高分值等於或高於2.5,並大於參考組單隻獼猴最高分值的2倍時,本批疫苗應重試。
重試合格
(  (test1+ttest2)-
(test1+ttest2)-  (refl+ref2))/2
(refl+ref2))/2
重試不合格
(  (test1+test2)-
(test1+test2)-  (ref1+ref2)/2>C3
(ref1+ref2)/2>C3
13.2 腦內法
取健康獼猴20只。麻醉後在兩側視丘分別注入0.5ml供試品(應不低於7.0lgCCID50/ml)及10-1供試品各10只,觀察21天,到期存活動物數應不低於80%,有效獼猴數應不低於16只,試驗有效,否則應補足。注射後48小時內死亡或出現非特異性麻痹症狀者剔除不計,中途死亡及到期處死動物,做中樞神經系統病理組織學檢查,判定標準如下。
13.2.1 (1)合格標準
凡符合下列情況之一者判爲合格:
②有2只獼猴發生輕度及其以下病變;
③1只獼猴發生中度及其以下病變。
13.2.2 (2)不合格標準
凡符合下列情況之一者判爲不合格:
①1只獼猴有中度病變,同時1只獼猴有輕度以上病變者;
②1只獼猴有重度以上病變者。
13.2.3 (3)重試標準
14 參考資料
- ^ [1] 國家藥典委員會.中華人民共和國藥典:2010年版:第一增補本[M].北京:中國醫藥科技出版社,2010.