1 拼音
tǐ wài zhěn duàn shì jì fēn xī xìng néng píng gū (zhǔn què dù -fāng fǎ xué bǐ duì )jì shù shěn chá zhǐ dǎo yuán zé
《體外診斷試劑分析性能評估(準確度-方法學比對)技術審查指導原則》由國家食品藥品監督管理局於2011年3月24日食藥監辦械函[2011]116號印發。
2 一、前言
準確度評估資料是評價擬上市產品有效性的重要依據,也是產品註冊所需的重要申報資料之一。定量檢測方法的方法學比對試驗是評估準確度的方法之一,可以與參考方法或臨牀公認質量較好的已上市產品進行比對。
本指導原則基於國家食品藥品監督管理局《體外診斷試劑註冊管理辦法(試行)》的有關要求,參考CLSI有關標準,對採用方法學比對進行準確度評估的實驗方法和數據處理方法進行了原則性要求。其目的是爲生產企業採用方法學比對進行準確度評估並準備準確度評估資料提供原則性指導,也爲註冊管理部門審覈該部分分析性能評估資料提供技術參考。
由於體外診斷試劑產品發展速度快、專業跨度大,國家食品藥品監督管理局將根據體外診斷試劑發展的需要,適時對本指導原則進行修訂。
3 二、適用範圍
本指導原則適用於首次申請註冊、申請許可事項變更的用於定量檢測的體外診斷產品。因體外診斷產品評價是將儀器、試劑、質控品、校準品等作爲一個系統進行評價,因此方法學比對的評價採用系統的概念進行描述。如特殊產品不適用於本指導原則,可進行詳細說明並採用適當的方法進行準確度評價。
4 三、基本要求
4.1 (一)方法學比對實驗的基本要求
2.編寫系統標準操作規程,其中包括校準程序和室內質控程序,採用合適的校準品、質控品並保持儀器處於正常狀態。
比對系統應該選擇正確性經過驗證的系統,根據實際條件,選擇的順序如下:參考方法、原裝系統、配套系統、經過驗證的非配套系統。
4.待評價系統的處理
進行方法學對比實驗前,應該對待評價系統進行初步評價,並且對待評價系統進行精密度及線性的評價(參考相關標準),只有在以上評價完成並且符合相關標準要求後,纔可進行方法學對比實驗。
4.2 (二)方法學比對實驗的評估及數據處理方法
1.實驗樣本的基本要求
(1)按照實驗對樣本的要求收集處理病人樣本,樣本貯存時間及條件由被測組分的穩定性而定,儘可能避免使用貯存的樣本。
(2)樣本應來自於不同患者,並且此患者所患疾病對於被測組分的影響應該是已知的,樣本不應含有干擾此方法的組分。
(3)樣本濃度應在方法的線性範圍內,並覆蓋醫學決定水平。通常基本從線性範圍的低限到線性範圍的高限(應至少有50%的樣本在參考範圍以外,但在線性範圍內)。分析樣本的濃度應儘可能在線性範圍內均勻分佈。商品質控物或者校準物可能存在基質效應,應避免使用。
2.實驗過程
(1)每天選擇8個臨牀患者樣本,按1到8的順序編號。用兩種方法同時進行實驗,按照1,2,3,4,5,6,7,8,8,7,6,5,4,3,2,1的樣本順序進行測定。
(2)以上實驗至少重複5天,即至少分析40個不同的臨牀患者樣本。每天實驗必須進行校準和室內質控,只有在室內質控合格的情況下,當天的實驗室數據纔有效。
3.數據處理及結果報告
(1)記錄測定結果(Xij和Yij),
i爲測定樣本的序號(1、2、3…40)
j爲同一樣本同一天測定的次序(1、2)
(2)計算每個樣本測定的均值(
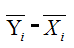
表1
注:i=1、2┄40。
(3)以
(4)以
(5)以
(6)檢查批內離羣點:計算樣本重複測定間差值(DXi 和DYi)的平均數,
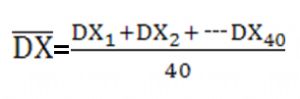

樣本重複測定間差值超出該平均數4倍時,則判斷爲離羣點,如離羣點超過1個時,整組數據應捨棄,尋找原因後重新進行評價。如離羣點爲1個,可以補充數據後重新進行統計。
(7)檢查批間離羣點:計算兩種方法測定結果間均值差值(│ - │)的平均數,如兩種方法測定結果間均值差值超出該平均數4倍時,則判斷該樣本爲離羣點,如離羣點超過1個時,整組數據應捨棄,尋找原因後重新進行評價。如離羣點爲1個,可以補充數據後重新進行統計。
(8)相關係數計算:利用所有樣本雙份測定值進行相關係數計算,如果 ≥0.975(或2≥0.95),則認爲選擇的數據範圍適合,數據滿足要求。該分析的誤差可以由數據範圍給以適當補償,並且可以採用簡單的線性回歸來評價斜率和截距。
如果r2<0.95,那麼必須通過分析另外一些樣品以擴大數據範圍,然後再檢查全部數據系列,如仍然r2<0.95,則應尋找待評價方法存在的缺陷,糾正後重新進行試驗。
對於某些免疫項目,可適當放寬標準,原則上r2≥0.90,則認爲數據範圍適合,數據滿足要求。
(9)迴歸計算:利用所有樣本雙份測定的有效數據,計算兩個方法間的線性迴歸方程:Y= bX+a。
