2 基本信息
《腎細胞癌診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
4.1 一、概述
腎細胞癌(Renal cell carcinoma,RCC)是起源於腎小管上皮的惡性腫瘤,佔腎臟惡性腫瘤的80%~90%。腎細胞癌的組織病理類型最常見的爲透明細胞癌,其次爲乳頭狀腎細胞癌及嫌色細胞癌,以及集合管癌等少見類型的腎細胞癌。隨着醫學影像學的發展,早期腎細胞癌的發現率逐漸增長,侷限性腎細胞癌經過保留腎單位的腎臟腫瘤切除術或者根治性腎切除術(radical nephrectomy,RN)可獲得滿意的療效。據統計,目前確診時即已屬晚期的患者已由數年前的30%下降至 17%,隨着靶向治療的持續發展及免疫治療的興起,晚期腎細胞癌的療效也逐步得到改善。二、流行病學及病因學
4.1.1 (一)流行病學。
在世界範圍內,腎細胞癌的發病率約佔成人惡性腫瘤的2%~3%,其分佈具有明顯的地域差異,北美、西歐等西方發達國家發病率最高,而非洲及亞洲等發展中國家發病率最低。根據 GLOBOCAN2020 全球癌症統計數據,2020年,全球腎細胞癌的發病率居惡性腫瘤第14 位,低於泌尿系統的前列腺癌及膀胱癌,死亡率居第15 位。腎細胞癌年齡標準化發病率在男性爲 6.1/10 萬,女性爲3.2/10 萬。年齡標準化死亡率在男性爲 4.6/10 萬,女性爲1.8/10 萬。據2018中國腫瘤登記年報的資料顯示,2015 年中國腎細胞癌新發病人數佔的惡性腫瘤第 17 位,死亡人數佔第18 位。中國腎細胞癌發病粗率爲 4.02/10 萬,年齡標準化發病率爲2.66/10萬;其中男性腎細胞癌發病粗率爲 5.10/10 萬,年齡標準化發病率爲 3.43/10 萬;女性腎細胞癌發病粗率爲2.92/10 萬,年齡標準化發病率爲 1.89/10 萬。
4.1.2 (二)病因學。
4.1.2.1 ⒈遺傳性因素
大部分腎細胞癌是散發性的,遺傳性腎細胞癌佔腎細胞癌總數的 2%~4%,多以常染色體顯性遺傳方式在家族中遺傳,由不同的遺傳基因變異造成,這些基因既包括抑癌基因又包括癌基因。已明確的遺傳性腎細胞癌包括希佩爾-林道(von Hippel-Lindau,VHL)病(雙側多發的腎透明細胞癌和腎囊腫)、MET 基因相關的遺傳性乳頭狀腎細胞癌、延胡索酸水化酶基因異常引起的遺傳性平滑肌瘤病和腎細胞癌、伯特-霍格-杜布(Birt-Hogg-Dube,BHD)綜合徵(多發性腎嫌色細胞癌、雜合性嫌色細胞和嗜酸細胞腎腫瘤、乳頭狀腎細胞癌)、HRPT2 基因相關的甲狀旁腺功能亢進-頜骨腫瘤綜合徵(混合型上皮和基質腫瘤、乳頭狀腎細胞癌)(表1)。
③腎細胞癌家族史(至少 1 個一級親屬,至少2 個二級親屬);
④腎細胞癌合併其他腫瘤病史(嗜鉻細胞瘤、胃腸道間質瘤、神經系統血管母細胞瘤、胰腺神經內分泌腫瘤等),合併其他病變如肺囊腫、自發性氣胸等;
⑥個人或家族有腎細胞癌相關綜合徵病史。對於這部分患者,可以建議本人及相關家屬進行基因突變檢測。
| 綜合徵縮寫 | 突變位點 | 病理類型 | 臨牀表現 |
| VHL | VHL | ccRCC | ccRCC,嗜鉻細胞瘤,胰腺腎臟囊腫,神經系統視網膜血管母細胞瘤,副神經節瘤,胰腺內分泌腫瘤,淋巴囊腫瘤,附睾腺瘤 |
| HPRC | MET | pRCCⅠ | pRCC |
| BHD | FLCN | 多種 RCC | 嫌色細胞癌,混合嗜酸細胞瘤,纖維毛囊瘤,皮贅,肺囊腫,氣胸HLRCC FH pRCC Ⅱ pRCC,皮膚子宮平滑肌瘤,子宮平滑肌肉瘤 |
| SDH RCC | SDHB,SDHD,SDHC | ccRCC, chromophobe RCC | ccRCC,嫌色細胞,嗜酸性,嗜鉻細胞瘤,副神經節瘤 |
| cowden syndrome | PTEN | ccRCC | ccRCC,乳腺癌,濾泡性甲狀腺癌,子宮內膜癌MITF 相關腫瘤 MITF RCC 黑色素瘤,PECOMA |
| HPT-JT | HRPT2 | 腎母細胞瘤 | 多種RCC,腎母細胞瘤,甲狀旁腺功能亢進,甲狀腺癌 |
| BAP1相關腫瘤 | BAP1 | ccRCC | ccRCC,葡萄膜黑色素瘤,黑色素瘤,間皮瘤 |
| 染色體易位[t(3;8),t(2;6)]相關腫瘤 | FHIT/FRA3B on chr3,RNF139 on chr8 | ccRCC | ccRCC,甲狀腺乳頭狀癌 |
注:
VHL,希佩爾-林道病;
BHD,伯特-霍格-杜布綜合徵;
4.1.2.2 2.吸菸
吸菸可以增加患腎細胞癌的危險,前瞻性研究認爲吸菸是中等度危險因素。既往有吸菸史的人患腎細胞癌的相對危險度爲 1.3,而正在吸菸的人患腎細胞癌的相對危險度爲1.6。
4.1.2.3 3.肥胖
肥胖程度一般用體重指數來表示,體重指數指數增加,則患腎細胞癌的危險性增加。肥胖增加腎細胞癌風險的具體
機制未明,可能和肥胖增加雄性激素及雌性激素釋放,或者與脂肪細胞釋放的一些細胞因子相關。
4.1.2.4 4.與終末期腎病長期透析相關的獲得性腎囊腫
與普通人相比有終末期腎病患者的腎細胞癌發病率更高。長期透析的患者容易患獲得性腎囊腫。在這些腎細胞癌患者中,腫瘤通常是雙側、多發的,組織學上呈現乳頭狀結構。
4.1.2.5 5.其他
有證據表明,飲酒、職業暴露於三氯乙烯、高雌激素的女性等都有可能增加患腎細胞癌的風險。尚需要進一步研究遺傳因素與環境暴露之間相互作用的潛在影響。
4.2 三、組織病理學
4.2.1 (一)大體病理。
絕大多數腎細胞癌發生於一側腎臟,雙側腎細胞癌(異時或同時)僅佔散發性腎細胞癌的2%~4%。腎腫瘤常爲單發腫瘤,其中 10%~20%爲多發病竈。多發病竈病例常見於遺傳性腎細胞癌以及乳頭狀腎細胞癌的患者。腫瘤瘤體大小差異較大,常有假包膜與周圍腎組織相隔。
4.2.2 (二)分類。
1981 年、1997 年、2004 年及2016 年WHO共推出過4個版本的腎臟腫瘤分類標準。目前臨牀上使用的是2016年WHO 第 4 版腎臟腫瘤分類標準(表2),其沿用了2004年版本的框架,僅對一些認識更加深入的腫瘤進行了分類命名上的調整:如將從未見覆發轉移報道的多房囊性腎細胞癌更新爲低度惡性潛能多房囊性腎細胞腫瘤,再如將Xp11.2易位/TFE3 融合基因相關性腎細胞癌歸入MiT 家族易位性腎細胞癌,後者還包括 TFEB 基因易位的腎細胞癌等。此外,也增加了部分新的病理亞型。如前所述,腎細胞癌依據與遺傳綜合徵關係可分成遺傳性腎細胞癌和散發性腎細胞癌。單純從病理形態不能區分遺傳性腎細胞癌和散發性腎細胞癌。
| 腎細胞癌 | Renal cell tumors |
| 透明細胞腎細胞癌 | Clear cell renal cell carcinoma |
| 低度惡性潛能多房囊性腎細胞腫瘤 | Multilocular cystic renal neoplasmof lowmalignant potential |
| 乳頭狀腎細胞癌 | Papillary renal cell carcinoma |
| 遺傳性平滑肌瘤病和腎細胞癌相關性腎細胞癌 | Hereditary leiomyomatosis and renal cell carcinoma(HLRCC)-associated renal cell carcinoma |
| 嫌色細胞腎細胞癌 | Chromophobe renal cell carcinoma |
| 集合管癌 | Collecting duct carcinoma |
| 腎髓質癌 | Renal medullary carcinoma |
| MiT 家族易位性腎細胞癌 | MiT Family translocation carcinomas |
| 琥珀酸脫氫酶缺陷型腎細胞癌 | Succinate dehydrogenase (SDH)-deficient renal carcinoma |
| 黏液小管狀和梭形細胞癌 | Mucinous tubular and spindle cell carcinoma |
| 管狀囊性腎細胞癌 | Tubulocystic renal cell carcinoma |
| 獲得性腎囊腫相關性腎細胞癌 | Acquired cystic disease associated renal cell carcinoma |
| 透明細胞乳頭狀腎細胞癌 | Clear cell papillary renal cell carcinoma |
| 未分類的腎細胞癌 | Renal cell carcinoma, unclassified |
| 乳頭狀腺瘤 | Papillary adenoma |
| 嗜酸細胞腺瘤 | Oncocytoma |
4.2.2.1 1.常見腎細胞癌病理類型特徵
4.2.2.1.1 (1)透明細胞腎細胞癌:
透明細胞腎細胞癌是最常見的腎細胞癌病理亞型,約佔腎細胞癌的60%~85%。
1)大體檢查:雙側腎臟發病率相等,少於5%的病例可呈多中心性發生或累及雙側腎臟。表現爲腎皮質內實性類圓形結節,與周圍腎組織界限清楚或不清,可見假包膜;腫瘤切面可呈現多彩狀或金黃色,常見壞死、出血、囊性變,切面偶見鈣化或骨化。
癌細胞胞質透明或嗜酸性,胞膜清楚;組織中可見小的薄壁血管構成的纖細血管網;腫瘤細胞呈巢狀和腺泡狀結構;呈肉瘤樣分化的腫瘤區域中可見到瘤巨細胞,呈橫紋肌分化的腫瘤細胞可見到寬的嗜酸性胞漿伴有偏位細胞核,可見突出核仁,提示預後不良;部分腫瘤中可見壞死、纖維黏液樣間質及鈣化、骨化。
Pax-8,CA9,MUC1,MUC3,CK8、CK18、vimentin、CD10 和EMA 陽性。免疫組織化學染色非診斷所必須,僅在疑難病例才使用。
4.2.2.1.2 (2)乳頭狀腎細胞癌:
乳頭狀腎細胞癌約佔腎細胞癌的 7%~14%,是僅次於透明細胞腎細胞癌第二常見的腎細胞癌。其發病年齡、男女發病率比例、症狀和體徵與腎透明細胞癌相似。
1)大體檢查:病變累及雙側腎臟和多竈性者較透明細胞癌多見;大體多呈灰粉色,出血、壞死、囊性變多見。
2)組織病理學:根據組織病理學改變將其分爲Ⅰ型和Ⅱ型 2 個亞型。腫瘤細胞由具有纖細血管軸心的乳頭狀或小管狀結構構成,乳頭核心可見泡沫狀巨噬細胞和膽固醇結晶;腫瘤細胞較小,胞質稀少(Ⅰ型)或腫瘤細胞胞質豐富嗜酸性,瘤細胞核分級高(Ⅱ型),可見壞死、肉瘤樣分化及橫紋肌樣分化區域。研究顯示,Ⅰ型乳頭狀腎細胞癌患者預後優於Ⅱ型患者。
3)常用的免疫組化抗體:與透明細胞腎細胞癌相似,現有的研究認爲,乳頭狀腎細胞癌CK7 呈陽性,P504S陽性率較高,且Ⅰ型較Ⅱ型陽性率爲高。免疫組織化學染色非診斷所必須,僅在疑難病例才使用。
4.2.2.2 (3)嫌色細胞癌:
嫌色細胞癌約佔腎細胞癌的4%~10%。從兒童到老人均可發病,平均發病年齡60 歲,男女發病率大致相等。與其他腎細胞癌亞型相比無特殊的臨牀症狀和體徵。影像學上特徵多顯示瘤體較大,腫瘤密度或信號均勻,無出血、壞死和鈣化。
1)大體檢查:腫瘤無包膜但邊界清楚,切面呈質地均一的褐色,可見有壞死,但出血竈少見。
2)組織病理學:腫瘤呈實性片狀結構,也可呈小的巢狀、微囊狀、梁狀及偶爾的乳頭狀結構。可出現竈狀鈣化及厚纖維間隔;與透明細胞癌不同,瘤體中的血管爲厚壁血管,而非薄壁血管;瘤細胞體積大,呈多角形,胞質透明略呈網狀,細胞膜非常清晰(嫌色細胞),亦可見嗜酸性胞質的瘤細胞,瘤細胞核的核周空暈是此型的特徵之一,並可見雙核細胞。近年來研究發現嫌色細胞癌存在嗜酸細胞型亞型,其組織學特徵包括:小細胞伴有纖細的嗜酸性顆粒狀胞漿;嗜酸性細胞位於細胞巢的中央,而胞漿蒼白的細胞位於細胞巢的周邊處;細胞核不規則皺縮,染色質凝聚呈塊狀,可見雙核細胞和核周空暈;也可見圓形的細胞。
3)常用的免疫組化抗體:CK、CK7、EMA、lectins和parvalbumin 陽性,腎細胞癌抗原弱陽性,vimentin 及CD10陰性。免疫組織化學染色非診斷所必須,僅在疑難病例才使用。
4.2.2.2.1 (4)低度惡性潛能多房囊性腎腫瘤:
在2016 年之前的版本,這一腫瘤被稱爲多房囊性腎細胞癌。腫瘤由多房性囊腫組成,囊壁含單層或簇狀分佈的透明細胞,無膨脹性生長方式;形態與透明細胞癌(G1/2)不能區分,無壞死、脈管侵犯及肉瘤樣分化。需與腎透明細胞癌囊性變、廣泛玻璃樣變、出血以及含鐵血黃素沉着相鑑別。免疫表型與透明細胞腎細胞癌相似。
4.2.2.2.2 (5)集合管癌和腎髓質癌:
腎集合管癌是指來源於貝利尼集合管的惡性上皮性腫瘤;腎髓質癌來源於近皮質區的集合管,患者幾乎均伴有鐮狀細胞性血液病。兩者從大體及組織學表現有一定相似性,一併描述。
1)大體檢查:兩者均發生於腎中央部分、髓質部位,切面實性,灰白色,邊界不清,可見壞死。
2)組織病理學:需要指出的是,貝利尼集合管癌常爲排除性診斷,腫瘤部位對於作出診斷很重要,組織學上可見不規則的小管狀結構,細胞高度異型;腎髓質癌鏡下腫瘤呈低分化、片狀分佈,瘤細胞排列呈腺樣囊性結構,瘤體內可見較多的中性粒細胞浸潤,同時可見鐮狀紅細胞。
3)常用的免疫組化抗體:兩者常見的免疫組化組合包括 PAX2、PAX8、OCT3/4、SMARCB1/INI1、P63。
4.2.2.3 2.少見腎細胞癌病理類型特徵
4.2.2.3.1 (1)MiT 家族轉位癌:
包括兩類腫瘤,分別與兩個轉錄因子(TFE3 和 TFEB)出現融合基因相關。Xp11 轉位造成TFE3 基因的融合;t(6;11)造成MALAT1-TFEB融合。這一腫瘤在兒童期多見,僅佔成人期腎細胞癌中的1.6%~4%。t(6;11)腎細胞癌較 Xp11 轉位腎細胞癌少見。大體不具有特徵性。鏡下,Xp11 易位性腎細胞癌表現爲由透明細胞形成的乳頭,伴有散在砂粒體樣鈣化;而t(6;11)易位性腎細胞癌表現爲大小兩種細胞組成的細胞巢,其內可見基底膜樣物質沉着。免疫組化表現爲:上皮標記物表達下降,如 CK、EMA;表達 PAX8 及其他腎小管標記物;Xp11腎細胞癌:部分表達黑色素標記物及TFE3;t(6;11)腎細胞癌恆定表達黑色素標記物,如 HMB45、Melan A以及CathepsinK、TFEB。FISH 檢測可發現 TFE3 或TFEB的融合基因。
4.2.2.3.2 (2)獲得性腎囊腫相關性腎細胞癌:
此類腫瘤常有終末期腎病以及獲得性腎囊腫病的病史,最常見於長期進行血液透析的患者。大體常爲雙側性、多竈性病變,邊界清楚,周圍可見多囊腎背景。組織學表現爲以微囊結構、豐富的腫瘤內嗜酸性草酸鹽結晶沉積特徵。免疫組化表現爲腎細胞癌、CD10 及 AMACR 陽性,CK7 陰性。
4.2.2.3.3 (3)透明細胞乳頭狀腎細胞癌:
此類腫瘤佔腎腫瘤的1%~4%,無性別傾向,呈散發或伴發於終末期腎病、VHL綜合徵。大體表現爲體積較小,邊界清楚有包膜的腫物,常可見囊性變。組織學表現爲乳頭狀結構,細胞大小較一致,胞漿透明,核遠離基底膜排列,可見胞突,G1 或G2細胞核分級,腫瘤壞死、腎外侵犯、脈管瘤栓罕見。免疫組化表現爲:CK7 瀰漫陽性,CAIX 呈杯口狀狀陽性,PAX2、PAX8及 CK34βE12 陽性,P504S 和CD10 陰性。需要指出的是,在形態不典型的病例:如果 P504S 或CD10 陽性,CK7瀰漫陽性減弱,診斷爲透明細胞癌更好。
4.2.2.3.4 (4)遺傳性平滑肌瘤病和腎細胞癌相關性腎細胞癌:
遺傳性平滑肌瘤病和腎細胞癌相關性腎細胞癌是一類伴有延胡索酸水合酶基因的胚系突變的腎細胞癌,伴發腎外平滑肌瘤病。腫瘤大體可呈囊性改變,伴有明顯的附壁結節。組織學形態與乳頭狀腎細胞癌或與集合管癌相似;細胞核可見核內包涵體,並可見核周空暈。免疫組化表現爲延胡索酸水合酶表達缺失。
4.2.2.3.5 (5)琥珀酸脫氫酶缺陷型腎細胞癌:
此類腫瘤罕見,多爲遺傳性腫瘤。大體多呈邊界清楚的實性腫物。腫瘤細胞排列呈實性、巢狀或小管狀結構;胞漿空泡狀嗜酸性至透明,核輪廓規則光滑,染色質細膩,核仁不明顯(類似與神經內分泌細胞);胞漿空泡狀;偶見高級別細胞核。免疫組化呈琥珀酸脫氫酶表達缺失,以琥珀酸脫氫酶B 表達缺失最爲常見。
4.2.2.3.6 (6)管狀囊性癌:
此類腫瘤罕見,常爲體檢偶發腫瘤。大體呈灰白海綿樣或瑞士奶酪樣外觀。鏡下呈小到中等大小的管狀伴有大的囊腔形成,內襯單層扁平、立方或柱狀上皮,可見鞋釘狀細胞;相當於 G3 的細胞核。免疫組化表達高分子量角蛋白。
4.2.2.3.7 (7)黏液小管狀和梭形細胞癌:
此類腫瘤不足腎臟腫的 1%。大體呈邊界清楚的實性腫物。組織學表現爲拉長或相互吻合的小管狀結構,部分區域可見梭形細胞;核呈低級別;間質呈嗜鹼性黏液樣。免疫組化呈CK7、PAX2 以及P504S陽性。
4.2.2.3.8 (8)腎細胞癌,未分類:
目前包括不具備現有腎細胞癌亞型特徵的癌,可以低級別或高級別。包括以下類型:含有 1 種以上腎細胞癌的病理特徵、伴有黏液分泌的腎細胞癌、伴有未分類上皮成分的腎細胞癌、低級別或高級別未分類的嗜酸性腫瘤以及肉瘤樣癌等。隨着對腎細胞癌認識的深入,這一分類所佔比例將越來越小。
4.2.3 (三)分級。
病理分級是一個重要的預後相關因素,只適用於透明細胞腎細胞癌和乳頭狀腎細胞癌。在以往的WHO分類版本中,最爲常用的是 1982 年的 Fuhrman 4 級分類。1998 年WHO推薦將 Fuhrman 分級中的Ⅰ、Ⅱ級合併爲一級即高分化、Ⅲ級爲中分化、Ⅳ級爲低分化或未分化。2016 版病理分級在原Fuhrman 四級分級系統上做了進一步調整,增加了客觀評價標準,形成 WHO/ISUP 病理分級系統(表3),使之在實踐中操作性更強,重複性更好。
表 3 2016 版腎細胞癌WHO/ISUP 核分級
| 標準分級 | 定義 |
| 1 級 | 400×鏡下核仁缺如或不明顯,呈嗜鹼性 |
| 2 級 | 400×鏡下核仁明顯,嗜酸性,可見但在 100×鏡下不突出 |
| 3 級 | 100×核仁明顯可見,嗜酸性 |
| 4 級 | 可見明顯的核多形性,多核瘤巨細胞和/或橫紋肌樣和/或肉瘤樣分化 |
4.2.4 (四)分期。
腎細胞癌分期採用最廣泛的是美國癌症分期聯合委員會(American Joint Committee on Cancer Staging,AJCC)制定的 TNM 分期系統,目前應用的是2017 年更新的第8版。詳見表 4 及表 5。
表 4 2017 年第 8 版 AJCC 腎細胞癌TNM 分期
| 分期 | 標準 |
| 原發腫瘤(T) | |
| TX | 原發腫瘤無法評估 |
| T0 | 無原發腫瘤的證據 |
| T1 | 腫瘤最大徑 ≤ 7cm,且侷限於腎內 |
| T1a | 腫瘤最大徑 ≤ 4cm,且侷限於腎內 |
| T1b | 4cm<腫瘤最大徑 ≤ 7cm,且侷限於腎內 |
| T2 | 腫瘤最大徑 >7cm,且侷限於腎內 |
| T2a | 7cm<腫瘤最大徑≤10cm,且侷限於腎內 |
| T2b | 腫瘤侷限於腎臟,最大徑>10cm,且侷限於腎內 |
| T3 | 腫瘤侵及主要靜脈或腎周圍組織,但未侵及同側腎上腺,未超過腎周圍筋膜 |
| T3a | 腫瘤侵及腎靜脈或其分支的腎段靜脈,或侵犯腎盂系統,或侵犯腎周脂肪和/或腎竇脂肪,但是未超過腎周圍筋膜T3b 腫瘤侵及膈下的腔靜脈 |
| T3c | 腫瘤侵及膈上的腔靜脈或侵及腔靜脈壁 |
| T4 | 腫瘤侵透腎周筋膜,包括侵及鄰近腫瘤的同側腎上腺 |
| NX | 區域淋巴結無法評估 |
| N0 | 區域淋巴結無轉移 |
| N1 | 區域淋巴結有轉移 |
| M0 | 無遠處轉移 |
| M1 | 有遠處轉移 |
表 5 腎細胞癌臨牀分期/預後分組
4.3 四、診斷
4.3.1 (一)臨牀表現。
腎細胞癌患者的臨牀表現複雜、多變,這些臨牀表現有些是腎腫瘤本身直接導致的,有些可能是由於癌細胞所分泌的激素或轉移竈所產生。由於健康體檢越來越普及,來醫院就診的多數腎細胞癌患者通常是由影像學檢查無意中被發現。
在臨牀中,早期腎細胞癌往往缺乏臨牀表現。當經典的腎細胞癌三聯徵(血尿、腰痛和腹部包塊)都出現時,多數已爲中晚期患者;當出現左側精索靜脈曲張時,提示可能合併左腎靜脈瘤栓;因此早期診斷腎細胞癌具有重要意義。副瘤綜合徵:臨牀表現不是由原發腫瘤或轉移竈所在部位直接引起,而是由於腫瘤分泌的產物間接引起的異常免疫反應或其他不明原因引起的機體內分泌、神經、消化、造血、骨關節、腎臟及皮膚等系統發生病變,並出現相應的臨牀表現,被稱爲副腫瘤綜合徵。腎細胞癌患者副瘤綜合徵發生率約 30%,表現爲高血壓、紅細胞沉降率增快、紅細胞增多症、肝功能異常、高鈣血癥、高血糖、神經肌肉病變、澱粉樣變性、溢乳症、凝血機制異常等。出現副腫瘤綜合徵的患者預後更差。
轉移性竈引起的症狀:部分腎細胞癌患者是以轉移竈的臨牀表現爲首發症狀就診,如骨痛、骨折、咳嗽、咯血等。
體格檢查發現包括頸部淋巴結腫大、繼發性精索靜脈曲張及雙下肢水腫等,後者提示腫瘤侵犯腎靜脈和下腔靜脈可能。在轉移性腎細胞癌患者中,常見的轉移臟器及轉移發生率依次爲:肺轉移(48.4%)、骨轉移(23.2%)、肝轉移(12.9%)、腎上腺轉移(5.2%)、皮膚轉移(1.9%)、腦轉移(1.3%)、其他部位等(7.1%)。晚期患者也可表現有消瘦、乏力、納差等惡液質症狀。
4.3.2 (二)實驗室檢查。
腎細胞癌實驗室常規檢查的目的是瞭解患者的一般狀況以及是否適於採取相應的治療措施,主要包括尿常規、血常規、紅細胞沉降率、血糖、血鈣、腎功能(血尿素氮、血肌酐和腎小球濾過率)、肝功能、乳酸脫氫酶、鹼性磷酸酶等項目。如需進行有創檢查或手術治療,則應進行必要的凝血功能檢測。以上項目的檢查結果在腎細胞癌患者中可表現爲血尿、紅細胞增多、貧血、紅細胞沉降率增快、高血糖、高血鈣、腎功能異常及肝功能異常等。對鄰近或累及腎盂的腎腫瘤患者還需做尿細胞學檢查。對孤立腎的腎腫瘤、雙腎腫瘤、腎功能指標異常和存在使腎功能受損的疾病(如糖尿病、慢性腎盂腎炎、多囊腎、對側腎結石等)患者需行核素腎圖檢查,瞭解腎功能情況,並對腎功能不全等級進行評定。目前,尚無公認的用於腎細胞癌早期輔助診斷的血清腫瘤標誌物。
4.3.3 (三)影像學檢查。
隨着影像學檢查的普及,目前超過50%的腎細胞癌是在對腹部非特異性症狀或其他器官疾病的檢查中意外發現的。影像學檢查在腎細胞癌的診治過程的不同階段均有重要的作用:對於原發腫瘤在於病竈的發現、定位、定性及分期;在術中可輔助定位;在術後及非手術治療過程中是隨診的重要手段。
4.3.3.1 ⒈胸部 X 線檢查
腎細胞癌患者應常規行胸部正側位X 線片,對胸部X線片有可疑結節或臨牀分期≥Ⅲ期的患者,需做胸部CT。
4.3.3.2 ⒉超聲檢查
腹部超聲檢查是發現腎腫瘤最簡便和常用的方法。腎超聲造影檢查有助於鑑別腎腫瘤良惡性,適用於慢性腎功能衰竭或碘過敏而不適宜行增強 CT 掃描的腎腫瘤患者以及複雜性腎囊腫患者的鑑別診斷。
4.3.3.2.1 (1)腎細胞癌原發竈的診斷:
1)灰階與多普勒超聲:
超聲檢查經濟、簡便、無輻射,普及率高,爲臨牀疑診腎臟腫瘤的首選檢查方法。臨牀上無症狀腎細胞癌多數爲超聲檢查時發現。灰階超聲能夠顯示腫瘤大小、位置、與周圍組織的關係。彩色多普勒血流成像(color Doppler flow imaging,CDFI)能提供腫瘤的血供狀態,亦能對靜脈瘤栓做出初步評價。灰階超聲及CDFI檢查對囊實性腎腫瘤的鑑別有較高的敏感性。
2)超聲造影:
對於實性腎腫瘤,增強影像是鑑別良、惡性病變最重要的手段之一。實時灰階超聲造影技術(Contrast-enhanced ultrasound,CEUS)可提高血流檢查的敏感性和準確性,對腫物早期動脈灌注和微循環狀態的提供更多的信息,對於檢出及顯示腎細胞癌特徵具有較高敏感性和特異性。CEUS 診斷複雜腎囊腫也具有很高的敏感性和特異性。
4.3.3.2.2 (2)腎細胞癌術前分期:
超聲檢查範圍較侷限,且易受成像分辨率、患者自身條件及操作者經驗等影響,對腫瘤分期的準確性不如 CT。
4.3.3.2.3 (3)腎細胞癌術中診斷:
超聲由於無輻射及靈活便捷特點,除常規用於引導腫瘤穿刺活檢,還經常用於術中探查以確定手術範圍。術中檢查能正確顯示腎臟腫瘤,並對腫瘤與腎盂的關係及腎靜脈、下腔靜脈、右心房內瘤栓的範圍作出清洗的判斷。
4.3.3.3 3.CT 檢查
腹部 CT 檢查是腎細胞癌術前診斷及術後隨訪的最常用檢查方法。完整 CT 檢查應包括平掃和多期增強掃描。CT掃描可對大多數腎腫瘤進行定性診斷,具有較高的診斷敏感性和特異性。在 CT 掃描上腎透明細胞癌多具有較典型的對比劑“快進快出”表現:平掃多呈不均勻等/低密度的類圓形腫塊,增強後皮髓質期呈中-高度強化,腎實質期腫瘤密度低於腎實質呈低密度腫塊。腫瘤內壞死、出血較常見。但需注意的是,CT 檢查對部分少見類型腎細胞癌與良性腫瘤如嗜酸細胞腺瘤和乏脂型血管平滑肌脂肪瘤的鑑別仍有一定的困難。
除定性診斷外,CT 檢查還能爲術前患者提供更多的診斷信息,包括:腫瘤的侵犯範圍,包括靜脈系統是否受侵(T分期),區域淋巴結是否轉移(N 分期),掃描範圍鄰近器官有無轉移(M 分期),有無變異血管(CTA)及雙腎形態及功能的粗略評估等。
腎囊性腫物的 Bosniak 分類:腎臟囊性腫物爲一組以囊性爲主要表現的疾病,可爲先天性、感染性、繼發性或腫瘤性(良性及惡性)疾病。影像學表現可從單純囊腫、略複雜囊性病變至複雜囊實性腫物。Bosniak 以CT 表現爲基礎,將腎囊性腫物分爲 4 類,並根據不同級別提供臨牀處理意見(詳見表 6)。目前 Bosniak 分類中的Ⅰ、Ⅱ、Ⅳ類的診斷標準較爲明確和處理意見亦比較適合,但部分ⅡF 和Ⅲ類患者診斷敏感性和特異性仍比較低,仍需進一步研究補充。MRI或CEUS可能對這部分病變的診斷有所幫助。
表 6 腎囊性腫物的 Bosniak 分類及處理
| Bosniak 分類 | CT 特徵 | 處理 |
| Ⅰ類 | ①單純性囊腫,壁薄而纖細,無分隔、鈣化或實性成分; ②均勻水樣密度竈(CT 值 0~20HU); ③邊界清晰,邊緣光滑銳利; ④增強掃描無強化 | 良性 |
| Ⅱ類 | ①良性囊腫可伴有纖細分隔; ②囊壁或分隔可有細小鈣化; ③<3 cm 的均勻高密度囊腫; ④邊界銳利無強化 | 良性 |
| ⅡF 類 | ①纖細分隔稍增多,囊壁或分隔輕微均勻增厚、強化; ④直徑≥3cm 的完全位於腎實質內的高密度囊腫。 通常邊界清楚 | 隨診至5 年部分爲惡性 |
| Ⅲ類 | ②增強掃描可見強化 | 手術或積極隨訪,超過50%爲惡性 |
| Ⅳ類 | 具有典型的惡性徵象:有強化的軟組織成分 | 手術 大部分爲惡性 |
4.3.3.4 4.MRI 檢查
腹部 MRI 檢查是腎細胞癌術前診斷及術後隨訪的較常用檢查方法,可用於對 CT 對比劑過敏、孕婦或其他不適宜進行 CT 檢查的患者。MRI 對腎細胞癌診斷的敏感性和特異性等於或略高於 CT。MRI 對腎靜脈和下腔靜脈瘤栓的顯示診斷較CT 更爲準確,對腎臟囊性病變內結構的顯示也較CT更爲清晰。對於腎細胞癌與出血性腎囊腫的鑑別診斷也比CT更具優勢,因此,對於上述病變 MRI 可能是優於CT 的更好選擇。
4.3.3.5 5.正電子發射體層成像
目前,正電子發射計算機體層成像(positron emissiontomography-computed tomography,PET-CT)檢查臨牀應用最廣泛的顯像劑是氟-18- 氟代脫氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG),靜脈注射後約50%未經代謝直接由腎臟排泄,會影響腎臟病變的顯示;另一方面,Ⅰ~Ⅱ級腎透明細胞癌的細胞膜GLUT-1 表達較低,且腎細胞癌氟代脫氧葡萄糖-6-磷酸分解酶過高,導致腎細胞癌原發竈僅半數左右呈氟代脫氧葡萄糖代謝增高,另半數可與正常腎實質攝取無差異;因此18F-FDG PET-CT 顯像對腎細胞癌原發竈的診斷價值有限,不推薦常規使用。其他新型的顯像劑研究較多的是氟-18 或碳-11 標記乙酸鹽,對分化較好、惡性程度較低的腎細胞癌有着良好的顯像作用,可彌補單一18F-FDG 顯像的不足,但目前還處於研究階段,沒有做爲常規檢查。但是,多項研究也表明PET-CT 顯像對腎細胞癌的淋巴結轉移和遠處轉移要優於傳統影像檢查方法,尤其在判斷腎細胞癌骨轉移或骨骼肌轉移方面更具優勢,而且能夠通過葡萄糖代謝變化早期監測療效、預測患者的預後情況。
4.3.3.6 6.核素骨顯像
腎細胞癌骨轉移好發於中軸骨和長骨骨端,可單發或多發,多表現爲膨脹性、溶骨性骨質破壞,早期侵犯骨髓組織,隨着病程進展,破壞骨小梁、骨皮質,並在周圍形成軟組織腫塊。核素骨顯像是腎細胞癌骨轉移的首選篩查方法,但靈敏度僅爲 50%左右。患者有骨痛等骨相關症狀或血清鹼性磷酸酶升高或臨牀分期≥Ⅲ期的腎細胞癌患者,應行骨掃描檢查明確是否有骨轉移。全身骨顯像發現骨轉移病變可比X線片早 3-6 個月,當全身骨顯像示可疑骨轉移時,應對可疑部位進行局部斷層融合顯像或進行MRI、CT 等檢查驗證。MRI對骨髓中腫瘤組織及其周圍水腫非常敏感,能發現尚未引起明顯骨質破壞的轉移竈和周圍軟組織應,懷疑脊椎轉移時首選 MRI。
4.3.3.7 7.腎動態顯像
核素腎動態顯像能準確評價腎細胞癌患者術前雙腎和分腎功能,有助於指導手術方案的決策。
4.3.3.8 8.腎腫瘤穿刺活檢
經皮腎穿刺活檢包括空芯針活檢和細針吸取(fine-needle aspiration,FNA),能爲影像學不能診斷的腎腫瘤提供病理組織學依據。空芯針活檢較FNA 對診斷惡性腫瘤有更高的準確性。具有實性成分的腎腫瘤首選空芯針活檢。同軸技術可以通過同軸套管進行多次活檢取材,避免潛在的腫瘤針道種植轉移風險。取材應避開壞死區,至少獲得兩個質量良好的組織標本。囊性腎腫瘤的空芯針活檢診斷率和準確性較低,不推薦使用。穿刺風險及潛在擴散風險,儘管較低卻不可忽視。經皮腎穿刺活檢不適用於危重患者。對於擬手術患者,由於腹部增強影像診斷準確率很高,亦不推薦穿刺活檢。不宜手術治療的(年邁體弱、或有手術禁忌)腎細胞癌患者,或不能手術治療的晚期腎細胞癌患者,全身系統治療前行腎腫瘤穿刺活檢明確病理診斷(包括病理類型),有助於選擇治療用藥。選擇消融治療的腎細胞癌患者,應行腎腫瘤穿刺活檢獲取病理診斷。因此在實際工作中,仍需綜合考慮穿刺風險、操作者技術水平以及是否可能影響到當前的治療方案做綜合決定。
4.4 五、晚期/轉移性腎細胞癌的預後評估
晚期腎細胞癌的預後風險模型有助於患者危險分層和治療選擇,目前常用的包括紀念Sloan Kettering癌症中心(Memorial Sloan Kettering Cancer Center,MSKCC)標準和國際轉移性腎細胞癌數據庫聯盟(InternationalMetastatic Renal Cell Carcinoma Database Consortium,IMDC)標準(表 7)。MSKCC 評分建立在細胞因子時代,包括體力狀態、乳酸脫氫酶、血紅蛋白、血鈣和自診斷到全身治療時間 5 個危險因素,分爲低危、中危和高危,相對應的中位總生存時間爲 30 個月、14 個月和5 個月。靶向治療時代應用的 IMDC 評分,建立於 MSKCC 標準之上,包括MSKCC預後因素中 4 個(除外乳酸脫氫酶),又納入血小板和中性粒細胞計數,低危、中危和高危患者中位總生存時間分別爲35.3 個月、16.6 個月和 5.4 個月。
| 危險因素 | MSKCC 標準 | IMDC 標準 |
| 1 | 診斷到治療的間隔時間<1 年 | 診斷到治療的間隔時間<1 年 |
| 2 | 卡諾夫斯凱計分<80% | 卡諾夫斯凱計分<80% |
| 3 | 血清鈣>正常指標上限 | 血清鈣>正常指標上限 |
| 4 | 血紅蛋白<正常指標下限 | 血紅蛋白<正常指標下限 |
| 5 | 乳酸脫氫酶>正常指標上限1.5 倍 | 中性粒細胞>正常指標上限 |
| 6 | 血小板水平>正常指標上限 | |
| 危險分組 | ||
| 低危組 | 0 個危險因素 | 0 個危險因素 |
| 中危組 | 1~2 個危險因素 | 1~2 個危險因素 |
| 高危組 | 3~5 個危險因素 | 3~6 個危險因素 |
4.5 六、治療
腎細胞癌患者通過影像學檢查的結果確定腫瘤的臨牀分期,利用輔助檢查評估患者對治療的耐受能力,根據臨牀分期並結合患者的耐受力,選擇恰當的治療方式。對手術的患者依據病理學檢查的結果確定病理分期,根據病理分期選擇術後治療及隨診方案。
4.5.1 (一)手術治療。
對於侷限性和局部進展性腎細胞癌患者而言,外科手術仍然是首選的可能使患者獲得治癒的治療方式。對於選擇性的晚期腎細胞癌患者,如果患者能夠耐受手術治療,在全身系統治療的基礎上施行減瘤性腎切除術以及孤立性轉移竈切除術也可能改善患者的生存。
4.5.1.1 1.RN
1963 年 Robson 等建立了RN 的基本原則,並確立了RN作爲侷限性腎細胞癌外科治療的金標準。經典的RN切除範圍包括患腎、腎周筋膜、腎周脂肪、同側腎上腺、從膈肌腳到腹主動脈分叉處淋巴結以及髂血管分叉以上輸尿管。當前觀念已發生變化,不推薦術中常規行腎上腺切除和區域淋巴結清掃。
4.5.1.2 2.保留腎單位手術
RN 後患者僅剩一側腎臟,可能會導致腎功能下降,增加慢性腎功能不全和透析的風險。慢性腎功能不全會增加患者發生心血管事件的風險,提高總體死亡率。對於侷限性腎細胞癌患者,如技術上可行,臨牀分期爲T1a 的腎細胞癌患者,推薦行保留腎單位手術(nephron sparing surgery,NSS)。對於 T1b、T2 期甚至部分 T3 期腫瘤,也可考慮行NSS。手術中需要切除的腫瘤周圍正常腎實質的厚度並非一個關鍵性的問題,只要保證最終手術標本切緣陰性。儘管腎部分切除術後會增加腫瘤局部復發的風險,但患者腫瘤特異性死亡率與 RN 相似。對於腎部分切除術的可行性,腫瘤的位置(外生型還是內生型)比腫瘤大小更爲重要。腫瘤過大或位置過深,會增加腎臟手術時的熱缺血時間,而且術後出血和尿漏的併發症風險也隨之上升。因此,NSS 適應證也在一定程度上取決於外科醫師的經驗和手術技巧。
4.5.1.3 3.手術相關問題
4.5.1.3.1 (1)開放手術 /腹腔鏡手術/機器人輔助技術:
與傳統的開放性手術相比,腹腔鏡手術的優點是手術切口小、損傷小、出血少、術後恢復快、合併症少、住院時間短,近期腫瘤控制率與開放手術無明顯差異。缺點是器械昂貴、技術較複雜、熟練掌握的學習曲線較長、初學階段手術時間較長。隨着技術的熟練,手術時間會明顯縮短,切除的徹底程度則可達到與開放手術完全相同。達芬奇機器人的問世,使得腹腔鏡腎部分切除術的幾個手術關鍵步驟變得更容易掌握,學習曲線更快。目前,在技術條件允許的情況下,開放手術、腹腔鏡手術或機器人輔助技術均可應用於腎細胞癌患者的外科手術治療,怎樣選擇很大程度上取決於腎腫瘤的大小和位置,以及外科醫生的經驗程度。
4.5.1.3.2 (2)同側腎上腺切除:
經典的RN 的範圍包括同側腎上腺。但是鑑於較小的腎細胞癌累及同側腎上腺的風險很低,因此,在 CT 掃描未見腎上腺異常的前提下,術中應考慮保留同側腎上腺。如手術中發現同側腎上腺異常,應當予以切除。
4.5.1.3.3 (3)區域淋巴結清掃:
在行RN 時是否需要行腹膜後區域淋巴結清掃術也存在爭議。當前尚無證據表明淋巴結清掃能夠使患者獲益。歐洲癌症研究與治療組織(Europeanorganization for research and treatment of cancer,EORTC)20 年隨機對照Ⅲ期臨牀研究結果顯示,對於可切除的侷限腎細胞癌(N0M0)行淋巴結清掃與不行淋巴結清掃,2 組無疾病進展生存、疾病進展時間和總生存率差異無統計學意義。因此,腎細胞癌患者在行RN 時,一般不常規進行區域或廣泛淋巴結清掃。若術前影像學檢查顯示區域淋巴結腫大或術中觸及腫大淋巴結,可行區域淋巴結清掃術或切除以明確病理分期。
4.5.1.3.4 (4)腫瘤切緣陽性的處理:
腎部分切除術患者最擔心的是腫瘤復發的問題。腎部分切除術後同側腎臟腫瘤複發率在 1%∼ 6%,多由於原發腎細胞癌的多竈性或切緣陽性所致。對於腎部分切除術的手術切緣陽性是否會增加患者腫瘤復發的風險以及對預後的影響仍存有爭議。研究表明即使腎部分切除術切緣陽性,中期隨訪結果顯示也未見患者腫瘤復發增加。甚至一些研究表明術後立即或後來對患者行補救性腎切除術時,絕大多數都未發現腫瘤殘留的跡象。文獻報告3%∼ 8%的 NSS 會出現術後病理切緣陽性,但只有那些病理分級較高(Ⅲ~Ⅳ級)的患者術後復發風險增高。
4.5.1.3.5 (5)靜脈瘤栓的處理
腎細胞癌患者中約有 10%伴隨腎靜脈或下腔靜脈瘤栓,腎細胞癌靜脈瘤栓的分級法常採用美國梅奧醫學中心的五級分類法(表 8)。由於靜脈瘤栓的外科手術治療伴隨較大的風險及併發症,因此術前需要進行全面準備的評估,制定詳細的治療方案,並且需要有經驗的團隊進行手術。
評估:術前進行增強 MRI 或CT 掃描及血管成像,瞭解靜脈瘤栓的範圍及程度、有無靜脈管壁侵犯等,以制定進一步手術治療方案。
手術:伴有靜脈瘤栓的局部晚期腎細胞癌的手術方式根據靜脈瘤栓的程度不同,手術細節有所區別。手術第一步爲分離血管。在主動脈根部結紮腫瘤側腎動脈,然後控制靜脈及取出瘤栓。爲了更好的控制出血及腫瘤暴露,可以將下腔靜脈的分支血管(腰靜脈、小分支肝靜脈等)進行結紮。爲了保證靜脈迴流的通暢,切忌將所有的分支血管全部結紮。術中儘量少觸碰腎臟及腫瘤,以減少瘤栓脫落風險。侷限於腎靜脈的瘤栓或瘤栓剛進入到下腔靜脈的腎細胞癌的手術與常規的根治性腎切除手術類似。當瘤栓處於腎靜脈開口與肝靜脈之間時,手術時在瘤栓上方和下方分別阻斷下腔靜脈,同時需要阻斷對側腎靜脈。通常情況下,不需要採用血液分流技術。在下腔靜脈前方切開血管,將腎臟及腫瘤、同側腎靜脈和靜脈瘤栓一併切除。仔細檢查及沖洗下腔靜脈內壁,以避免腫瘤殘留。當瘤栓處於肝靜脈與膈肌之間時,需要採用血液分流技術,根據術中所需要阻斷下腔靜脈的程度及引起的血流動力學改變的狀況,決定採用何種分流技術。預後:靜脈瘤栓的程度與生存預後的關係目前尚無明確定論。一項納入 422 例病例的回顧性研究結果顯示,伴有下腔靜脈瘤栓患者的生存預後差於瘤栓侷限於腎靜脈的患者。另一項研究顯示,瘤栓侵犯腎靜脈管壁的預後差於無管壁侵犯的患者。Blute 等報道,沒有遠處轉移及淋巴結轉移的靜脈瘤栓腎細胞癌患者,未進行術後輔助治療的情況下,中位生存時間爲 3.1 年,5 年生存率爲59%。
| 分級 | 標準及內容 |
| 0級 | 瘤栓侷限在腎靜脈內 |
| Ⅰ級 | 瘤栓侵入下腔靜脈內,瘤栓頂端距腎靜脈開口處≤2cm |
| Ⅱ級 | 瘤栓侵入肝靜脈水平以下的下腔靜脈內,瘤栓頂端距腎靜脈開口處>2cm |
| Ⅲ級 | 瘤栓生長達肝內下腔靜脈水平,膈肌以下 |
| Ⅳ級 | 瘤栓侵入膈肌以上下腔靜脈內 |
4.5.1.3.6 (6)T4 期腎細胞癌的處理:
腎細胞癌侵犯至腎筋膜外並累及周圍臟器時,爲 T4 期腫瘤。可累及升結腸、十二指腸、降結腸、胰腺、膈肌、肝臟、脾臟、腎上腺、輸尿管等。早年研究表明,T4 期腫瘤手術效果差,不建議行手術治療。但後續一些研究表明,T4 期腎細胞癌手術可以使患者獲益。MDACC 研究報道,30 例術前臨牀分期爲T4NxM0 患者接受手術治療,術中切除腫瘤及受侵犯的鄰近臟器,切緣均爲陰性。60%患者的分期出現降期現象,其中2 例患者病理分期爲T2期。多因素迴歸分析結果顯示,pT4 及淋巴結轉移爲生存預後的獨立預測因素。淋巴結陰性患者的3 年總生存率爲66%,而淋巴結轉移患者的 3 年總生存率爲12%。此項研究表明術前及術中的分期並不完全準確,相當一部分患者會存在分期高估現象。因此,對於臨牀局部分期爲T4 且沒有遠處轉移的患者,如果身體狀況允許,圍手術期風險可控的情況下,可考慮進行手術治療。MSKCC 的研究報道,在病理分期爲T3或T4 期聯合鄰近臟器切除的腎細胞癌患者中,約1/4 患者存在淋巴結轉移,絕大多數患者切緣陰性(36%切緣陽性)。切緣陽性患者的生存時間明顯縮短。全組患者的中位生存時間爲11.7 個月。Capitanio 回顧性分析SEER 數據庫中臨牀分期爲T4N0~2M0 的腎細胞癌,246 例接受手術,64 例未接受手術。手術組的患者中位生存時間爲48 個月,而未手術組患者的中位生存時間爲 6 個月。手術組中125 例病理分期T4N0的患者,10 年腫瘤特異性死亡率爲 40%。然而在淋巴結轉移的患者中,並未見到明顯獲益。在處理臨牀T4 期腎細胞癌患者時,由於涉及鄰近臟器的切除與重建,因此多學科協作治療十分重要。綜上所述,對於臨牀 T4N0M0 的腎細胞癌患者,如果條件允許,積極手術可能會給患者帶來明顯獲益。
4.5.2 (二)介入治療。
4.5.2.1 1.栓塞治療
4.5.2.1.1 (1)腎動脈栓塞:
腎動脈栓塞術可用於腎腫瘤的姑息性治療,以緩解臨牀症狀、提高生存質量。
1)適應證:
②腎腫瘤相關出血性事件,如腎腫瘤破裂或腎部分切除術後出血、血尿等;
③部分巨大、富血供腎臟腫瘤的外科術前栓塞:由於其對延長患者生存時間、減少術中出血及降低術後併發症等方面獲益尚不明確,因此不推薦常規使用。
2)禁忌證:
②嚴重感染;
③外周血白細胞和血小板顯著減少(非絕對禁忌,如脾功能亢進者):白細胞<3.0×109/L,血小板<50×109/L;
④嚴重腎功能障礙。
3)操作程序要點:
①腎動脈造影,通常採用Seldinger方法,經皮穿刺股動脈或橈動脈插管,導管置於腎動脈行數字減影血管造影(digital subtraction angiography,DSA),必要時可行腎上腺動脈造影,尋找側支供血。
②仔細分析造影表現,明確腫瘤的部位、大小、數目以及供血動脈。
③對腫瘤供血動脈進行栓塞。對於腎部分切除術後的出血,應儘量超選擇至相關血管進行栓塞,注意保留正常腎單位。
4)術後併發症:
栓塞後綜合徵,是腎動脈栓塞術後最常見不良反應,主要表現爲發熱、疼痛、噁心和嘔吐等。發生原因是腎動脈被栓塞後引起局部組織缺血、壞死,經對症治療後大多數患者多可完全恢復。
4.5.2.1.2 (2)肺轉移竈栓塞:
肺是腎腫瘤最常見的轉移部位,部分腎腫瘤患者以咯血爲首發症狀。支氣管動脈栓塞術可用於治療肺轉移竈,防治肺轉移竈相關併發症,提高生存質量。
1)適應證:
2)禁忌證:
②嚴重感染;
③外周血白細胞和血小板顯著減少(非絕對禁忌,如脾功能亢進者):白細胞<3.0×109/L,血小板<50×109/L;
④嚴重腎功能障礙。
3)操作程序要點:
①支氣管動脈造影,通常採用Seldinger 方法,經皮穿刺股動脈或橈動脈插管,導管置於支氣管動脈行 DSA,貼臨或位於胸膜者必要時可行肋間動脈等造影,尋找側支供血。
②仔細分析造影表現,明確腫瘤的部位、大小、數目以及供血動脈。
4)術後併發症:
栓塞後綜合徵,是支氣管動脈栓塞術後最常見不良反應,主要表現爲發熱、疼痛、咳嗽、咯血等。發生原因是栓塞後引起局部組織缺血、壞死,經對症治療後大多數患者可以完全恢復。
4.5.2.1.3 (3)肝轉移竈栓塞:
肝臟也是腎腫瘤的常見轉移部位之一。選擇性肝動脈栓塞術可用於治療肝轉移竈,防止肝功能惡化,提高生存質量。
1)禁忌證:
②嚴重感染;
③外周血白細胞和血小板顯著減少(非絕對禁忌,如脾功能亢進者):白細胞<3.0×109/L,血小板<50×109/L;
④嚴重腎功能障礙;
⑤嚴重肝功能障礙(Child-Pugh C級),包括黃疸、肝性腦病、難治性腹水或肝腎綜合徵。
2)操作程序要點:
①肝動脈造影,通常採用Seldinger方法,經皮穿刺股動脈插管,導管置於腹腔幹或肝總動脈行DSA,造影圖像採集應包括動脈期、實質期及靜脈期;應做腸繫膜上動脈造影、注意尋找側支供血。
②仔細分析造影表現,明確腫瘤的部位、大小、數目以及供血動脈。
3)術後併發症:
栓塞後綜合徵,是肝動脈栓塞術後最常見不良反應,主要表現爲發熱、疼痛、噁心、嘔吐、一過性肝功能異常等。發生原因是肝動脈被栓塞後引起局部組織缺血、壞死,經對症治療後大多數患者可以完全恢復。
4.5.2.2 2.消融治療
近年來廣泛應用的消融治療,使一些不接受或不耐受手術切除的腎細胞癌患者亦可獲得根治的機會。消融治療是藉助醫學影像技術的引導對腫瘤靶向定位,局部採用物理或化學的方法直接殺滅腫瘤組織的一類治療手段。腎腫瘤及寡轉移竈的消融手段主要包括射頻消融和冷凍消融。消融治療最常用超聲引導,具有方便、實時、高效的特點。CT 及 MRI 結合多模態影像系統可用於觀察超聲無法探及的病竈。CT及MRI引導技術還可應用於肺、肝臟、腎上腺、骨等轉移竈的消融等。
4.5.2.2.1 (1)射頻消融:
射頻消融的路徑通常分爲經皮消融和經腹腔鏡消融,在 T1a 期腎腫瘤患者中,二者術後併發症發生率、複發率及腫瘤特異性生存率沒有差異。有研究顯示,在 T1a 期腎腫瘤患者中,射頻消融與部分腎切除術相比較,二者總生存率及腫瘤特異性生存率均沒有差異,射頻消融的併發症發生率及輸血率均低於部分腎切除術,射頻消融的局部複發率高於部分腎切除術但二者遠處轉移率沒有差異。
4.5.2.2.2 (2)冷凍消融:
冷凍消融的路徑通常分爲經皮消融和經腹腔鏡消融,二者總生存率、腫瘤特異性生存率、無復發生存率及併發症發生率沒有差異。冷凍消融與部分腎切除術相比較,部分研究顯示二者總生存率、腫瘤特異性生存率、無復發生存率、無病生存率、局部複發率及遠處轉移率沒有差異,部分研究顯示在以上指標中部分腎切除術優於冷凍消融。
消融治療適應證:
①T1a 期中,高齡或伴有合併症者;
②復發或Ⅳ期中不可切除者,在系統治療基礎上可聯合寡轉移竈消融術;
③不接受或不耐受外科手術者;
④需儘可能保留腎單位者;
⑤腎功能不全者;
消融治療禁忌證:
②嚴重感染;③外周血白細胞和血小板顯著減少(非絕對禁忌,如脾功能亢進者):白細胞<3.0×109/L,血小板<50×109/L。
操作程序要點:
①消融前需穿刺活檢,爲後續治療及隨訪提供支撐;
②治療前應該全面而充分地評估腫瘤的大小、位置、數目等;要注意腫瘤與鄰近器官的關係,制定合理的穿刺路徑及消融範圍,在保證安全的前提下,達到足夠的安全範圍;
③根據腫瘤的大小、位置,選擇適合的影像引導技術(超聲或 CT)和消融手段(射頻或冷凍);
④消融範圍應包括 5mm 的癌旁組織,以獲得“安全邊緣”,徹底殺滅腫瘤,對於邊界不清晰、形狀不規則的浸潤型癌或轉移癌竈,在鄰近組織及結構條件許可的情況下,建議適當擴大消融範圍。
術後併發症:發熱、疼痛、出血、感染等,大部分爲輕度。經對症治療後大多數患者可以完全恢復。
4.5.2.2.3 (3)其他技術:
其他腎臟腫瘤消融治療方法主要包括:微波消融、高強度超聲聚焦消融、不可逆電穿孔及高低溫複合式消融等。以上方法在腎細胞癌的消融治療中也得到了逐步應用。
4.5.3 (三)主動監測。
主動監測(Active surveillance,AS)是指通過定期進行腹部影像學檢查,監測腎腫瘤的大小變化,在隨診期間一旦出現腫瘤進展則接受延遲的干預治療。等待觀察與主動監測不同,是指患者具有較嚴重的合併症,不適合主動治療,等待觀察直到出現相關症狀再對症處理,不需要定期影像學檢查。
一項針對小腎腫瘤(small renal masses,SRMs,腫瘤最大徑≤4cm)的多中心前瞻性註冊研究DISSRM(DelayedIntervention and Surveillance for Small Renal Masses)顯示主動監測與主動治療相比,小腎腫瘤患者的2 年總生存率相似,分別爲 98%和 96%;5 年總生存率主動監測組略低,分別爲 92%和 75%(P=0.06);7 年總生存率主動監測組較差,分別爲 91.7%和 65.9%(P=0.01)。但在腫瘤特異性生存率方面,主動監測與主動治療相比在5 年(99%對100%,P=0.3)及 7 年(99%對 100%,P=0.5)均沒有差異。AS 組患者的年齡更大,ECOG 評分更差,合併症更嚴重,腫瘤更小,多發及雙腎腫瘤比例更高。
對於大多數 SRMs 中的高齡及合併症多的患者來說,手術麻醉及其他合併症所帶來的風險,往往高於腫瘤本身。前瞻性研究顯示: AS 組 SRMs 患者的5 年總生存率53%∼90%,5 年腫瘤特異性死亡率 0.2%∼ 1.9%,5 年無進展生存率97%∼ 99%。AS 是老年或體弱 SRMs 患者的可行選擇。美國泌尿外科學會在 2009 年發佈的關於T1 期腎腫瘤診療指南中便提出 AS 可作爲存在高危手術因素及合併症者的治療方案。2017 年美國臨牀腫瘤學會推薦AS 可作爲存在高危因素及預期壽命不佳 SRMs 患者的首選治療方案,並明確了其適用範圍,絕對適應證:存在較高手術麻醉風險或預期壽命<5年;相對適應證:如治療可致終末期腎病風險,SRM<1cm或預期壽命<10 年。但對於年輕無合併其他疾病SRMs 的患者不主張行長期 AS。
4.5.4 (四)藥物治療。
自 2005 年索拉非尼被批准用於轉移性腎細胞癌的治療以來,轉移性腎細胞癌的治療進入了靶向治療時代。至今美國食品藥品管理局已先後批准了十餘種藥物及方案用於轉移性腎細胞癌的治療。這些藥物從作用機制方面主要分爲:①抗血管內皮生長因子或血管內皮生長因子受體(vascular endothelial growth factor/vascular endothelialgrowthfactor receptor,VEGF/VEGFR)途徑,主要包括舒尼替尼、培唑帕尼、索拉非尼、阿昔替尼、卡博替尼、侖伐替尼、貝伐珠單抗等;②抑制哺乳動物雷帕黴素靶蛋白(mammaliantarget of rapamycin,mTOR)途徑:包括依維莫司和替西羅莫司;③免疫檢查點抑制劑:包括納武利尤單抗、帕博麗珠單抗及伊匹木單抗;④其他:包括細胞因子[白介素-2和α干擾素(interferon-α,IFN-α)]及化療(吉西他濱和多柔比星)。化療主要作爲具有肉瘤樣分化的轉移性腎細胞癌患者的治療。
聯合用藥方案主要包括帕博利珠單抗聯合阿昔替尼、帕博利珠單抗聯合侖伐替尼、納武利尤單抗聯合卡博替尼、納武利尤單抗聯合伊匹木單抗(適用於中-高風險晚期透明細胞爲主型腎細胞癌)、阿維魯單抗聯合阿昔替尼、侖伐替尼聯合依維莫司(適用於晚期透明細胞爲主型腎細胞癌的二線治療)、貝伐珠單抗+厄洛替尼(適用於部分進展性乳頭狀腎細胞癌,包括遺傳性平滑肌瘤病和腎細胞癌患者)、貝伐珠單抗+依維莫司(適用於部分進展性乳頭狀腎細胞癌,包括遺傳性平滑肌瘤病和腎細胞癌患者)等。目前國內已批准用於晚期腎細胞癌治療的藥物包括培唑帕尼、舒尼替尼、阿昔替尼、索拉非尼、依維莫司、白介素-2、IFN-α等。
推薦對骨轉移和肌酐清除率≥30ml/min 的患者使用雙膦酸鹽或 RANK 配體抑制劑。
4.5.5 (五)中醫中藥治療。
中醫藥有助於促進腎細胞癌術後機體功能恢復,減少免疫治療及靶向藥物治療的毒副反應,緩解患者症狀,改善患者生活質量,可能延長生存時間,可以作爲腎細胞癌治療的手段之一,可單獨應用或與其他抗腫瘤藥物聯合應用。我國藥監部門曾經批准的治療腎細胞癌的現代中藥製劑不多,治療適應證多針對多種腫瘤,其中也包括治療腎細胞癌,但是這些藥物已上市多年,早期的實驗和臨牀研究比較薄弱,尚缺乏高級別的循證醫學證據加以充分支持,需要積極進行深入研究。
除了這些上市的中成藥外,遵從中醫辯證論治原則採用中藥複方治療是中醫最常用的方法之一,可根據患者個體差異,開展個體化治療,具有一定優勢;在減輕腫瘤相關併發症,改善患者生活質量,延長患者生存方面有一定的療效。
4.5.6 (六)放療。
腎細胞癌是一種對常規放療不敏感的腫瘤,以往針對高危腎細胞癌術後放療的臨牀研究顯示輔助放療沒有生存獲益,因此不建議根治術後做輔助性放療。放療主要用於腎細胞癌的姑息治療,如對局部瘤牀復發、區域或遠處淋巴結轉移、骨骼、腦或肺轉移患者做姑息放療,達到緩解疼痛、改善生存質量的目的。近 10 多年來放療技術迅速發展,在一些回顧性和臨牀Ⅰ 期 或 Ⅱ 期 的 研 究 中 ,應用立體定向放射治療(Stereotactic body radiation therapy,SBRT,即單次大劑量照射 1 次或數次的分割照射模式)技術逐漸用於治療腎細胞癌。回顧性分析顯示:SBRT 可以取得優於常規放療的治療效果。在一些回顧性和臨牀Ⅰ期或Ⅱ期的研究中,SBRT取得了很好的近期局控率,並具有良好的治療安全性。近兩年,有幾項 SBRT 聯合免疫檢查點抑制劑治療晚期腎細胞癌的研究顯示了較高的有效率及局部控制率,但報道的病例數均較少,且缺乏長期隨訪的結果。目前尚無隨機分組研究證明 SBRT 療效優於常規分割放療或其他局部治療手段。所以SBRT 只能在有精準放療技術支持的和具備豐富放療經驗的醫生及物理師的醫療中心,作爲可供選擇的一種腎細胞癌姑息治療的手段,或開展相關的臨牀研究。
4.5.7 (七)靶向藥物常見不良反應及處理。
4.5.7.1 1.高血壓
是靶向藥物治療最常見的毒性反應之一,爲VEGR/VEGFR抑制劑類藥物共同的不良反應(表9)。文獻報道VEGFR酪氨酸激酶抑制劑類藥物治療相關高血壓的發生率爲24%~40%,其中 8%~16%的患者爲Ⅲ級以上高血壓。國內報道的發生率與國外類似,所有級別高血壓的發生率爲15%~37%。開始靶向治療前應評估基線血壓,對於原有高血壓的患治療期間目標血壓應控制在 140/90mmHg 以下。當高血壓達到Ⅱ級以上或 I 級伴有症狀時,必須用藥物控制。降壓藥物最好選擇血管緊張素轉換酶抑制劑。避免應用抑制CYP3A4 的鈣離子拮抗劑,以免產生藥物間相互作用,如果需要與影響CYP3A4的藥物同時給藥,則應考慮調整藥物劑量。在治療間隔期,要暫停或降低降壓藥劑量並嚴密監測血壓。
| 嚴重程度分級 | 臨牀特徵 |
| Ⅰ級 | 高血壓前期(收縮壓 120~139mmHg,或舒張壓80~89mmHg。 |
| Ⅱ級 | 第一階段高血壓(收縮壓 140~159mmHg,或舒張壓90~99mmHg);需要醫學干預;復發或持續性(>24 小時)高血壓,伴有症狀的舒張壓升高>20mmHg,或血壓>140/90mmHg(既往血壓正常者);需要單藥治療。 |
| Ⅲ級 | 第二階段高血壓(收縮壓≥160mmHg,舒張壓≥100mmHg),需要醫學干預,需要多種藥物治療。 |
| Ⅳ級 | 危及生命(如高血壓危象),需緊急治療。 |
| Ⅴ級 | 死亡。 |
注:分級標準採用美國國家癌症研究院不良事件通用術語標準(NCI-CTCAE 4.0);1mmHg=0.133kPa 。
4.5.7.2 2.血液學毒性
晚期腎細胞癌靶向治療常見的血液學毒性爲中性粒細胞減少、血小板減少和貧血(表10)。舒尼替尼引起的血液學毒性的發生率較高,也是導致中國患者減量或停藥的主要原因。治療前和治療期間需定期監測血常規,注意感染症狀。
若中性粒細胞減少≥Ⅰ級,應給予升白細胞藥物直至升至正常水平爲止。對於血小板減少,可採取常規升血小板治療。患者出現頭暈、視物模糊、氣促或其他貧血症狀時應予以重視,必要時給予維生素 B12 和鐵劑。出現Ⅰ級以上血液學毒性時需減少靶向藥物劑量。Ⅲ/Ⅳ級血液學毒性應停藥,直至血液學毒性降低至基線水平後再重新開始治療。若患者在常規治療期間Ⅲ/Ⅳ級血液學毒性迅速恢復,則無需調整劑量,但需密切監測,同時可考慮調整給藥方案。
| 嚴重程度分級 | 中性粒細胞計數減少 | 血小板計數減少 | 貧血 |
| Ⅰ級 | 1.5×109/L 至正常值下限 | 75×109/L 至正常值下限 | 血紅蛋白100g/L至正常值下限 |
| Ⅱ級 | 1.0×109~1.5×109/L | 50×109~75×109/L | 血紅蛋白80至100g/L |
| Ⅲ級 | 0.5×109~1.0×109/L | 25×109~50×109/L | 血紅蛋白<80g/L |
| Ⅳ級 | <0.5×109/L | <25×109/L | 危及生命,需要緊急治療 |
| Ⅴ級 | - | - | 死亡 |
4.5.7.3 3.手足綜合徵與皮膚毒性
手足綜合徵(hand-foot syndrome,HFS)通常表現爲雙側掌蹠皮疹,伴疼痛和感覺遲鈍,受機械牽拉的部位易出現過度角化、紅斑和脫屑(表11)。
文獻報道索拉非尼引起的 HFS 發生率較高,所有分級HFS 的發生率爲51.0%,≥Ⅲ級的 HFS 發生率爲 16.1%。中國患者的手足皮膚反應更爲常見,文獻報道所有級別 HFS 發生率爲55%~68%。皮膚毒性的臨牀表現爲幹皮、皮疹、瘙癢、水皰、蛻皮、皮膚角質局部增厚,或脂溢性皮炎伴皮膚松垂。通常出現於治療開始後3~8 周。在靶向治療中,所有分級皮疹的發生率爲13%~37%,Ⅲ級以上症狀爲 0.1%~4.0%治療前檢查手掌和足底,排除原有的皮膚角化區域。症狀出現時應立即干預,可採用含有10%尿素組分的油膏或乳液;如果出現過度角化,則使用含有35%~40%尿素的油膏進行去角質治療。出現Ⅱ級以上的症狀可使用含 0.05%氯倍他索軟膏;若伴有疼痛,可使用局部鎮痛藥如 2%利多卡因。若出現嚴重症狀,建議請皮膚科會診。當發生Ⅱ級以上的 HFS 時,可以考慮中斷給藥,直至症狀嚴重程度緩解至低於Ⅰ級,減量或以相同的劑量重新開始治療。
| 嚴重程度分級 | 手足綜合徵 | 皮疹 |
| Ⅰ級 | 無痛性輕微皮膚改變或皮膚炎症(如紅斑、水腫、角化過度) | 斑疹、丘疹或紅斑,不伴有其他症狀 |
| Ⅱ級 | 痛性皮膚改變(如剝落、水皰、出血、水腫、角化過度),影響日常生活活動 | 斑疹、丘疹或紅斑,不伴有其他症狀,局部脫屑及皮損,累及<50%體表面積 |
| Ⅲ級 | 重度皮膚改變(剝落、水皰、出血、水腫、角化過度)伴疼痛、影響個人日常生活活動。 | 全身性的紅皮疹、斑疹、丘疹或皰疹、脫屑及皮損,累及>50%體表面積 |
| Ⅳ級 | - | 全身性的剝脫性、潰瘍性或水皰性皮炎 |
| Ⅴ級 | - | 死亡 |
注:手足綜合徵分級標準採用美國國家癌症研究院不良事件通用術語標準(NCI-CTCAE 4.0),皮疹分級標準採用 NCI-CTCAE 3.0。
4.5.7.4 4.胃腸道不良反應
常見腹瀉、噁心和嘔吐(表12),輕度腹瀉可以補充電解質,發生重度腹瀉應靜脈輸液和補充電解質,同時可用洛哌丁胺、地芬諾酯等藥物。服用質子泵抑制劑或H2受體拮抗劑可能有利於預防和噁心症狀相似的消化不良,但患者在使用阿昔替尼時應避免服用。止吐治療建議使用多巴胺拮抗劑,如甲氧氯普胺或阿立必利。胃腸道不良反應與飲食習慣有關,建議患者少量多餐,保證足夠量的液體攝入,清淡飲食,忌辛辣,避免使用瀉藥,避免使用高滲食物添加劑。對於Ⅰ級和Ⅱ級胃腸道不良反應通常無需調整靶向藥物劑量;在出現Ⅲ級和Ⅳ級不良反應時,應減量或停藥。表 12 腎細胞癌靶向治療的胃腸道不良反應分級嚴重程度分級 腹瀉 噁心嘔吐Ⅰ級 大便次數比基線增加<4 次/天,與基線相比,造瘻口排除物輕度增加。
食慾下降、飲食習慣無改變。24 小時內發作1~2 次,間隔5min。Ⅱ級 大便次數比基線增加 4~6次/天,靜脈補液小於 24小時,與基線相比,造瘻口排除物中度增加。
經口攝食減少,體重無明顯下降、脫水或營養不良。24 小時內發作3~5 次,間隔5分鐘。Ⅲ級 大便次數比基線增加 7 次/天,大便失禁,需要住院治療。與基線相比,造瘻口排除物重度增加,影響患者個人日常生活活動。
經口攝入能夠量和水分不足,需要鼻飼、全腸外營養或者入院。24 小時內發作>6 次,間隔5分鐘,需要鼻飼、全腸外營養或者入院。Ⅳ級 危及生命,需要緊急治療。 - 危及生命,需要緊急治療。Ⅴ級 死亡 - 死亡注:分級標準採用美國國家癌症研究院不良事件通用術語標準(NCI-CTCAE 4.0)。
4.5.7.5 5.甲狀腺功能減退
使用 VEGFR 抑制劑治療的晚期腎細胞癌患者中有12%~19%出現不同程度的甲狀腺功能減退(表13),且發生率隨治療時間的延長而逐漸增加。國內研究結果顯示甲狀腺功能減退的發生率略高於西方人羣,爲14.0%~24.9%。部分患者可能發生暫時性的甲狀腺功能亢進,一般無需干預,在隨後的治療中大部分會發展爲甲狀腺功能減退。腎細胞癌靶向治療的甲狀腺功能減退分級見表 5。在治療初始時對患者進行甲狀腺功能檢查,並且在靶向治療期間密切監測甲狀腺素及促甲狀腺激素(thyroid stimudating hormone,TSH)。不伴症狀的 TSH 輕度升高,只需繼續監測即可。TSH>10 mU/L或者出現甲狀腺功能減退臨牀症狀的患者,需用甲狀腺激素替代治療。大多數情況下,甲狀腺激素替代治療可有效控制症狀,不需要暫停靶向藥物治療或調整劑量。
表 13 腎細胞癌靶向治療的甲狀腺功能減退分級嚴重程度分級 臨牀特徵
Ⅲ級 嚴重;影響日常生活活動;需住院治療。
Ⅳ級 危及生命,需緊急治療。
Ⅴ級 死亡
注:分級標準採用美國國家癌症研究院不良事件通用術語標準(NCI-CTCAE 4.0)。
4.5.7.6 6.肝臟毒性
在使用培唑帕尼治療時,應密切監測肝功能。對於肝功能損害患者,建議應用保肝藥物,對於有可能出現肝臟損害的患者,在開始靶向治療前要針對原發肝臟疾病積極治療(例如乙型肝炎、肝硬化等)。在治療期間,若發生谷丙轉氨酶上升至 8 倍正常值上限以上時,應及時停藥,待恢復至基線水平再恢復治療;恢復治療後若再次發生谷丙轉氨酶上升至 3 倍正常值上限以上的情況,應永久停藥;若併發谷丙轉氨酶上升至 3 倍正常值上限以上和膽紅素上升至2倍正常值上限以上時,應永久停藥。
4.5.7.7 7.間質性肺病
間質性肺病(interstitial lung disease,ILD)是一組主要累及肺間質、肺泡或細支氣管的肺部瀰漫性疾病,在二線藥物 mTOR 抑制劑治療中發生率較高,爲19.8%。使用mTOR 抑制劑治療期間尤其要注意合併ILD 和感染的情況,應慎用於雙肺多發性轉移、肺功能較差、阻塞性肺炎或其他活動性感染患者。開始治療前,在有呼吸道症狀的晚期腎細胞癌患者中應進行評估,並定期監測肺部影像檢查及肺功能。較輕的 ILD 無需採取措施,密切監測即可。嚴重ILD,應停止靶向藥物治療,並用激素(如甲潑尼龍)衝擊治療。
4.5.7.8 8.心臟毒性
VEGFR 抑制劑引起的心臟不良事件發生率爲2%~10%,表 現 爲 左 心 室 射 血 分 數 (1eft ventricular ejectionfraction,LVEF)下降、心肌缺血等。對於無心臟危險因素的患者,應考慮進行基線 LVEF 檢測。有心臟危險因素或近期發生過心血管不良事件的患者,應密切監測生命體徵和LVEF。若發生充血性心力衰竭,應暫停靶向治療;若未發生症狀明顯的充血性心力衰竭,但LVEF<50%,或較基線LVEF值下降 20%,應減少靶向藥物劑量或暫停治療。既往有長Q-T間期病史、服用抗心律失常藥物、心動過緩、電解質異常等患者,應定期進行心電圖檢查和血鉀、血鎂檢測。
4.5.8 (八)侷限性腎細胞癌的治療。
侷限性腎細胞癌是指腫瘤侷限於腎臟被膜內,包括TNM分期爲 T1~2N0M0 期,臨牀分期爲Ⅰ、Ⅱ期的腎細胞癌。隨着影像學技術的提高和健康體檢的普及,侷限性腎細胞癌所佔的比例已經超過50%。越來越多的研究顯示在大多數T1期,部分 T2 期,甚至部分 T3a 期腎細胞癌中,腎部分切除術與RN 具有相似的腫瘤學結果,和更好的腎功能保護。對 T1a 期腎細胞癌患者,在技術允許的情況下均推薦首選 NSS,對於解剖結構複雜難以實行腎部分切除術且對側腎功能正常者可行 RN。開放手術、腹腔鏡或機器人等輔助技術均可用於開展腎部分切除術或RN。對於不能接受或耐受手術的 T1a 期腫瘤患者可以選擇消融治療,存在高危因素及預期壽命不佳者的可推薦主動監測;對T1b 期腎細胞癌患者推薦採用 NSS 或 RN,在手術方式的選取上仍舊需要考慮腫瘤的複雜性,如腫瘤大小、位置、深度以及患者的個體差異等。對部分合適的 T2 期腎細胞癌患者也可以選擇NSS,否則接受RN。
術後輔助治療:侷限性腎細胞癌手術後輔助的放、化療,免疫治療及靶向治療均不能降低腫瘤的複發率和轉移率。因此,T1~2N0M0 期腎細胞癌患者術後以隨診觀察爲主,可參加臨牀試驗,不常規使用輔助治療。
4.5.9 (九)局部進展期腎細胞癌的治療。
局部進展性腎細胞癌是指腫瘤突破腎臟被膜,累及腎周脂肪或腎竇脂肪但仍侷限於腎筋膜內,可伴有區域淋巴結轉移或/和靜脈瘤栓,無遠處轉移的腎細胞癌,包括TNM分期爲 T1~2N1M0/T3N0~1M0 期的腎細胞癌,臨牀分期爲Ⅲ期。局部進展性腎細胞癌首選RN,腎部分切除術僅在技術上可行且有臨牀需求的特定患者施行。一些回顧性或前瞻性Ⅱ期研究顯示 T2~T3 期腎細胞癌行術前新輔助靶向治療,具有一定的縮瘤效果,可試用於局部切除困難的cT3 期腫瘤,但尚缺乏高水平的研究證實。近年來,關於免疫檢查點抑制劑單藥或聯合方案的新輔助治療研究也開始廣泛開展。根據病變程度和患者的身體狀況,選擇是否切除區域淋巴結或血管瘤栓。①淋巴結清掃術:局部進展性腎細胞癌患者行區域或擴大淋巴結清掃術,對影像淋巴結陰性者(cN0)只對判定腫瘤的分期有意義,並不提高患者的生存率。而對淋巴結陽性(cN+)的患者,可行淋巴結清掃術,但淋巴結清掃術只對部分患者有益,且清掃的範圍仍有爭議。②腎靜脈或/和腔靜脈瘤栓的外科治療:對於沒有遠處轉移的腎細胞癌合併靜脈瘤栓患者,如技術上可行,應爭取手術切除患腎及瘤栓。腎細胞癌靜脈瘤栓的長度以及瘤栓是否浸潤腔靜脈壁與患者的預後關系密切。③對於術前影像學或術中探查發現腎上腺腫瘤的患者應一併切除患側腎上腺。局部進展性腎細胞癌術後輔助治療:對於局部進展性腎細胞癌術後尚無標準的輔助治療方案,首先推薦加入臨牀試驗,否則給予觀察隨診。在侷限高危的透明細胞腎細胞癌患者,一項隨機、雙盲,安慰劑對照的Ⅲ期臨牀研究(S-TRACtrial),入組 615 例高危透明細胞腎細胞癌(Ⅲ~Ⅳ期和/或區域淋巴結轉移),服用舒尼替尼(50 mg/d,4/2方案)或安慰劑持續 1 年。與安慰劑相比,輔助舒尼替尼可以延長侷限高危腎透明細胞癌術後患者的無病生存時間(6.8年vs.5.6 年,HR 0.76,P=0.03),但未能改善總生存,同時,患者需要承擔明確的藥物相關毒副反應及經濟負擔。因此,現階段僅對於高復發風險的腎透明細胞癌患者,在充分了解輔助治療相關風險和可能獲益的情況下,可以選擇術後輔助維持足量(全劑量)、充分(減少劑量中斷)和長時間(至少1年)的舒尼替尼靶向治療。高危非轉移性腎細胞癌術後輔助治療中國專家共識(2020)指出:現有循證醫學證據不支持腎細胞癌術後細胞因子輔助治療。高危非轉移性腎細胞癌術後輔助免疫檢查點抑制劑免疫治療以及免疫聯合靶向的臨牀試驗正在開展,結果值得期待。
4.5.10 (十)晚期/轉移性腎細胞癌的治療。
晚期/轉移性腎細胞癌指腫瘤已突破腎筋膜,伴區域外淋巴結轉移或遠處轉移,包括TNM 分期爲T4N0~1M0/T1~4N0~1M1 期,臨牀分期爲Ⅳ期的腎細胞癌。以全身藥物治療爲主,輔以原發竈或轉移竈的姑息手術或放療。轉移性腎細胞癌的治療需全面考慮原發竈及轉移竈的情況、腫瘤危險因素評分及患者的體能狀況評分,選擇恰當的綜合治療方案。
4.5.10.1 1.外科治療
外科手術作爲轉移性腎細胞癌的輔助性治療手段,包括原發竈的減瘤手術以及轉移竈的姑息性切除,通常需要在全身系統治療的基礎上施行,以期改善臨牀症狀及生存。對於高度選擇的患者可通過外科手術獲得較長期生存。
4.5.10.1.1 (1)腎原發病竈的外科治療:
外科減瘤術應在有效的全身治療基礎上進行。回顧性研究顯示,減瘤性腎切除及轉移竈切除在腎細胞癌的靶向治療時代仍可能帶來生存獲益。目前實施減瘤性腎切除術較適用於一般情況良好(ECOG評分<2、無或輕微相關症狀,轉移負荷低、手術能顯着降低腫瘤負荷的中度危險因素的轉移性腎細胞癌患者,通常不建議全身治療前接受減瘤性腎切除。此外,對腎腫瘤引起嚴重血尿或疼痛的患者,可行姑息性腎切除術或腎動脈栓塞,以緩解症狀、提高患者的生存質量。
4.5.10.1.2 (2)轉移竈的外科治療:
對孤立性轉移瘤,若患者的行爲狀態良好,可手術切除轉移竈。肺是腎細胞癌最常見的轉移部位,單發肺轉移或轉移竈位於一葉肺,手術切除可能有助於延長患者的生存時間。骨也是腎細胞癌常見的轉移部位,外科手術可用於切除轉移竈,或預防和治療骨相關事件。對原發病竈已切除或可切除,且只有單一骨轉移的患者,應進行積極的外科治療。承重骨伴有骨折風險的患者首選外科治療,應進行預防性內固定,避免骨相關事件的出現。已出現病理性骨折或脊髓的壓迫症狀的患者,若預計患者存活期>3 個月、體能狀態良好、手術能改善生活質量,也應行手術治療。轉移竈切除應在有效全身治療的基礎上進行,有利因素包括腎切除至轉移竈發現≥1 年、單發轉移、轉移竈能完全切除、單純肺轉移、年齡≤60 歲。
4.5.10.2 2.系統治療
4.5.10.2.1 (1)臨牀試驗:
4.5.10.2.2 (2)透明細胞爲主型腎細胞癌的系統治療:
見表14。
①帕博麗珠單抗聯合阿昔替尼:帕博麗珠單抗是一種結合於程序性死亡蛋白-1(programmed death-1,PD-1)的單克隆抗體。阿昔替尼爲新一代VEGFR1~3 的受體多靶點酪氨酸激酶抑制劑。隨機、對照Ⅲ期研究KEYNOTE426 評估了帕博利珠單抗聯合阿昔替尼對比舒尼替尼一線治療轉移性腎透明細胞癌的療效和安全性。入組861 例患者,隨機分爲帕博利珠單抗(200mg,靜脈滴注,每3 周1 次)聯合阿昔替尼(5mg,口服,每天 2 次)(432 例)和舒尼替尼組(50mg,口服,每天 1 次,給藥 4 周/停藥2 周)(429 例)。與舒尼替尼相比,帕博利珠單抗聯合阿昔替尼顯著改善了患者的總生存時間(HR=0.53,95% CI 0.38~0.74,P<0.0001)、中位無進展生存時間(15.1 vs. 11.1 個月,HR=0.69,95%CI0.57~0.84,P=0.0001)及客觀緩解率(59.3%vs.35.7%,P<0.0001)。帕博利珠單抗聯合阿昔替尼在所有亞組中都觀察到良好的療效,包括 IMDC 風險組和程序性死亡配體-1(programmed death ligand-1,PD-L1)表達亞組。治療相關的 3~5 級不良事件發生率,帕博利珠單抗聯合阿昔替尼組爲 62.9%,舒尼替尼組爲 58.1%。
②帕博麗珠單抗聯合侖伐替尼:侖伐替尼是受體酪氨酸激酶抑制劑,可以抑制 VEGFR1(FLT1)、VEGFR2(KDR)、VEGFR3(FLT4)、成纖維細胞生長因子受體(fibroblastgrowthfactor receptor,FGFR)1~4、血小板源性的生長因子受體(platelet derived growth factor receptor,PDGFR)α、KIT 及 RET,這些激酶除了發揮正常的細胞功能外,還參與到病理血管的生成、腫瘤的生長及進展。隨機、對照、Ⅲ期臨牀研究KEYNOTE581/CLEAR (Study307)納入 1069 例未經治療的晚期腎透明細胞癌患者,按1∶1∶1 比例隨機分配接受侖伐替尼(20mg,口服,每天1次)+帕博利珠單抗(200mg,靜脈滴注,每3 周1 次)或侖伐替尼(18mg,口服,每天 1 次)+依維莫司(5mg,口服,每天1 次)或舒尼替尼(50mg,口服,每天1 次,給藥4周/停藥2 周)。結果顯示,與舒尼替尼組相比,侖伐替尼聯合帕博麗珠單抗組顯著延長中位無進展生存(23.9 vs. 9.2個月,HR=0.39,95% CI 0.32~0.49,P<0.001);不論患者PD-L1表達水平,IMDC 風險分層,侖伐替尼聯合帕博麗珠單抗均能帶來顯著的無進展生存時間獲益。中位總生存時間均未達到,但與舒尼替尼組相比,侖伐替尼聯合帕博麗珠單抗組延長總生存時間(HR=0.66,95% CI 0.49~0.88,P=0.005)。侖伐替尼聯合帕博麗珠單抗組有更高的客觀緩解率(71.0%vs.36.1%)及更高的完全緩解率(16.1% vs. 4.2%)。≥3級治療相關不良反應分別爲 71.6%和58.8%。
③納武利尤單抗聯合卡博替尼:納武利尤單抗是一種抗PD-1 的單克隆抗體。卡博替尼是針對VEGFR、MET、AXL等靶點的口服小分子激酶抑制劑。隨機、開放、Ⅲ期臨牀研究Checkmate 9ER 評估了納武利尤單抗聯合卡博替尼對比舒尼替尼一線治療轉移性腎透明細胞癌的療效和安全性。入組651 例患者,隨機分爲納武利尤單抗(240mg,靜脈滴注,每2 周 1 次)聯合卡博替尼(40mg,口服,每天1 次)組(323例)和舒尼替尼(50mg,口服,每天1 次,給藥4 周/停藥2周)組(328 例)。與舒尼替尼相比,納武利尤單抗聯合卡博替尼顯著改善了患者的中位無進展生存時間(17.0 vs.8.3個月,HR=0.52,95% CI 0.43~0.64,P<0.0001)、中位總生存時間(NR vs. 29.5 個,HR=0.66,95% CI 0.50~0.87,P=0.0034)及客觀緩解率(54.8% vs. 28.4%)。
④納武利尤單抗聯合伊匹木單抗:伊匹木單抗是一種人類的細胞毒性 T 淋巴細胞抗原4(Cytotoxic T lymphocyteantigen 4,CTLA-4)的阻斷抗體。CheckMate214 研究是一項多中心隨機對照Ⅲ期臨牀研究,評估納武利尤單抗聯合伊匹木單抗對比舒尼替尼一線治療晚期/轉移性中高危腎細胞癌(1082 例)的效果。結果顯示在IMDC 中高危晚期腎細胞癌的一線治療中,聯合治療組與舒尼替尼組在客觀緩解率(42% vs.27%,P<0.001)及中位總生存時間(未達到對26個月,P<0.001)方面均有明顯獲益。基於此研究結果,2018年 4 月美國食品藥品管理局批准納武利尤單抗聯合伊匹木單抗作爲 IMDC 中高危晚期腎細胞癌的標準一線治療。
⑤培唑帕尼:培唑帕尼是一種能抑制VEGFR1、VEGFR2、VEGFR3、PDGFR、FGFR1、FGFR3、KIT、白介素-2 受體可誘導T 細胞激酶、白細胞特異性蛋白酪氨酸激酶、穿膜糖蛋白受體酪氨酸激酶的多酪氨酸激酶抑制劑。培唑帕尼治療轉移性腎細胞癌的臨牀數據來源於其國際多中心Ⅲ期臨牀研究,結果顯示培唑帕尼的中位無進展生存時間爲 11.1 個月,客觀緩解率爲30%,顯著優於安慰劑對照組,最終生存分析顯示中位總生存時間爲22.6個月。另外一項培唑帕尼與舒尼替尼對照用於轉移性腎細胞癌一線治療的國際多中心Ⅲ期臨牀研究(COMPARZ 研究),國內多家中心參與了該臨牀試驗,獨立評估顯示培唑帕尼與舒尼替尼的中位無進展生存時間分別爲8.4 與9.5 個月,統計學達到非劣效,次要研究終點方面:客觀緩解率分別爲31%與25%,中位生存時間分別爲 28.4 與29.3 個月,生活質量評分培唑帕尼優於舒尼替尼。該研究共納入包含中國受試者在內共計 367 例的亞洲患者,亞組分析顯示亞洲患者培唑帕尼治療組中位無進展生存時間爲8.4 個月,與歐美人羣無顯著性差異。
培唑帕尼推薦劑量:800mg 口服,每天1 次,不和食物同服(至少在進餐前 1 小時或後2 小時)。劑量調整:基線中度肝損傷口服 200mg 每天 1 次。嚴重肝損傷患者不建議使用。
⑥舒尼替尼:舒尼替尼是多靶點受體酪氨酸激酶抑制劑,主要作用靶點爲 VEGFR1~2、PDGFRα、PDGFRβ、c-KIT以及 FMS 樣酪氨酸激酶 3(FMS-like tyrosine kinase 3,FLT3),具有抗腫瘤血管生成、抑制腫瘤細胞增殖的作用。2007 年 the New England Journal of Medicine報道舒尼替尼與 TNF-α 1∶1 對比一線治療轉移性腎透明細胞癌Ⅲ期臨牀研究,共入組 750 例患者,90%患者爲MSKCC中低度風險,中位無進展生存時間分別爲11 個月和5 個月(HR0.42,95% CI 0.32~0.54,P<0.001),客觀緩解率分別爲31%和6%(P<0.001),中位生存時間分別爲26.4 個月和21.8個月(P=0.051)。從而奠定了舒尼替尼一線治療腎透明細胞癌的地位。舒尼替尼一線治療中國轉移性腎細胞癌患者的多中心Ⅳ期臨牀研究結果顯示客觀有效率爲31.1%,其中位無進展生存時間爲 14.2 個月,中位總生存時間爲30.7 個月。基於上述臨牀數據,推薦舒尼替尼用於晚期透明細胞型腎細胞癌的一線治療,用法爲:50mg,每天1 次口服,4/2方案(服藥 4 周,停藥 2 周)給藥。考慮舒尼替尼4/2給藥方案血液學毒性不良反應發生率高,可選擇2/1 方案(服藥2 周,停藥 1 周),耐受性提高,療效未受影響。
⑦阿昔替尼:2013 年 the Lancet 報道隨機對照Ⅲ期臨牀研究,288 例患者按照阿昔替尼與索拉非尼2∶1 入組一線治療晚期腎透明細胞癌,中位無進展生存時間分別爲10.1和 6.5 個月(HR 0.77,95% CI 0.56~1.05)。儘管無進展生存時間延長了 3.6 個月,由於入組例數偏少,統計學無顯著差異,但仍表現出阿昔替尼一線治療腎透明細胞癌的有效性。基於臨牀研究數據,推薦阿昔替尼可以作爲晚期腎透明細胞癌患者的一線治療,具體用法爲5mg,每天2 次。
⑧卡博替尼:一項Ⅱ期多中心隨機研究(CABOSUN)比較了卡博替尼和舒尼替尼一線治療中危或高危(Heng氏評分)腎透明細胞癌患者的療效。157 例患者按照1∶1 的比例隨機接受一線卡博替尼(60mg,每天1 次)或者舒尼替尼(50mg,4/2 方案)治療,結果顯示卡博替尼組無進展生存時間顯著優於舒尼替尼治療組,兩組中位無進展生存時間分別爲8.2與 5.6 個月(P = 0.012),客觀緩解率分別爲46%和18%,總生存時間分別爲 30.3 與 21.8 個月。基於國外臨牀研究數據,推薦卡博替尼可以作爲中高危晚期腎透明細胞癌患者的一線治療,具體用法爲60mg,每天1 次。
⑨替西羅莫司:替西羅莫司爲mTOR 抑制劑,除了通過抑制 mTOR 信號抗腫瘤作用,還具有抑制血管生成作用,主要抑制缺氧誘導因子 HIF-1 的轉錄,減少對血管相關生長因子如 VEGF/PDGF/轉化生長因子等的刺激,從而達到抑制腫瘤血管生成的作用。
替西羅莫司一線治療轉移性腎細胞癌的Ⅲ期臨牀數據來自國際多中心隨機對照Ⅲ期臨牀研究(ARCC 研究),入組患者均爲預後評分爲高危的患者,結果顯示替西羅莫司單藥治療的中位總生存時間爲 10.9 個月,中位無進展生存時間爲 5.5 個月,明顯優於 IFN-α治療組。一項替西羅莫司治療亞洲人羣非隨機單臂開放性Ⅱ期臨牀研究,入組了中國、日本及韓國 82 例轉移性腎細胞癌患者,結果顯示臨牀獲益率爲 48%,客觀有效率爲 11%,中位無進展生存時間時間爲7.3 個月。
替西羅莫司未在中國批准上市,但基於上述臨牀數據,推薦替西羅莫司可以用於晚期透明細胞型腎細胞癌高危患者的一線治療,用法爲:25mg,每週1 次。⑩細胞因子治療:細胞因子治療多集中於早年的研究,主要爲 IFN-α和白介素-2。2002 年JCO 報道經IFN-α治療的 463 例晚期腎細胞癌患者的回顧性分析,中位生存時間13個月,中位進展時間爲 4.7 個月,其中高危、中危和低危患者生存時間分別爲 5 個月、14 個月和30 個月。2003 年Cancer報道了173例轉移性腎細胞癌患者經白介素-2爲基礎治療的回顧性分析,中位生存時間 13 個月,1 年、3 年和5年生存率分別爲 92%、61%和 41%。目前細胞因子一般不作爲一線首選治療。
結合我國具體情況,認爲對於不能接受靶向藥物治療的轉移性腎透明細胞癌患者,可以推薦細胞因子治療作爲替代治療,其中大劑量白介素-2 可以用於一般情況較好,心肺功能正常的轉移性腎透明細胞患者治療,用法爲:1800萬IU/d皮下注射、每週 5 天、用藥 1 周,900 萬IU 每12 小時1次、第 1~2 天,900 萬 IU 每天 1 次、第3~5 天,用藥3周,休1 周後重復。但高劑量白介素-2 治療,嚴重不良反應發生率高,需嚴密監測。IFN-α的用法爲:每次900 萬IU,皮下注射,3 次/周,共 12 周。
①阿昔替尼:2011 年 the Lancet 報道隨機對照Ⅲ期臨牀研究(AXIS 研究),針對一線治療失敗(絕大部分爲細胞因子或舒尼替尼)的晚期腎細胞癌二線治療,共723例患者按照 1:1 分別接受阿昔替尼和索拉非尼治療,中位無進展生存時間分別爲 6.7 個月和 4.7 個月(HR 0.665,95% CI0.544~0.812,P<0.0001),有效率分別爲19%和9%(P=0.0001),一線爲細胞因子治療的中位無進展生存時間分別爲12.1個月和 6.5 個月(P<0.0001),一線爲舒尼替尼的中位無進展生存時間分別爲 4.8 個月和 3.4 個月(P=0.01),中位生存時間分別爲 20.1 個月和 19.3 個月。一項亞洲轉移性腎細胞癌患者二線接受阿昔替尼治療的註冊臨牀研究,其中大部分爲中國患者,結果顯示阿昔替尼中位無進展生存時間爲6.5個月,客觀有效率爲 23.7%。亞組分析顯示既往接受舒尼替尼治療患者二線接受阿昔替尼的中位無進展生存時間時間爲 4.7 個月。基於上述臨牀試驗結果,推薦阿昔替尼作爲轉移性腎細胞癌的二線治療,具體用法爲阿昔替尼5mg,每天2 次。
②依維莫司:依維莫司爲口服給藥的mTOR 抑制劑,其用於轉移性腎細胞癌的臨牀數據主要來自於2008年theLancet 報道的一項國際性多中心隨機對照Ⅲ期臨牀研究(RECORD-1 研究)。經舒尼替尼或索拉非尼治療後進展的晚期腎細胞癌患者按照 2:1 比例分別依維莫司和安慰劑治療,最終統計中位無進展生存時間分別爲4.9 個月和1.9個月(HR,0.33; P <0.001),安慰劑組患者進展後有80%交叉到依維莫司組,故兩組中位生存時間無明顯差異,分別爲14.8個月和 14.4 個月。依維莫司常見的不良反應爲胃炎、皮疹和乏力。一項國內患者接受依維莫司治療的多中心註冊臨牀研究(L2101 研究),證實了依維莫司作爲TKI 治療失敗後二線靶向治療的療效及安全性,疾病控制率61%,中位無進展生存時間爲 6.9 個月,臨牀獲益率爲66%,1 年生存率爲56%,1 年無進展生存率爲 36%。
基於上述臨牀試驗結果,推薦依維莫司作爲轉移性腎細胞癌 TKI 治療失敗後的二線治療藥物,具體用法爲依維莫司10mg,每天 1 次。
③索拉非尼:索拉非尼是最早上市用於轉移性腎細胞癌的多靶點受體酪氨酸酶抑制劑,具有雙重抗腫瘤作用:一方面通過抑制 RAF/MEK/ERK 信號傳導通路,另一方面作用於VEGFR、PDGFR,以及 c-KIT、FLT-3、MET 等靶點,抑制腫瘤生長。
2009 年臨牀腫瘤學雜誌報道索拉非尼與TNF-α1∶1對比一線治療轉移性腎透明細胞癌Ⅱ期臨牀研究,共入組189例患者,索拉非尼 400mg 每天2 次,TNF-α900 萬U每週3 次,索拉非尼組進展後可以加量至600mg 每天2 次,干擾素組進展後可以交叉到索拉非尼組。索拉非尼與TNF-α中位無進展生存時間分別爲 5.7 個月和5.6 個月,兩組出現腫瘤縮小的比例分別爲 68.2%和 39.0%,索拉非尼組有着更好的生活質量評分,耐受性更好。由於索拉非尼一線治療缺乏有效的大型研究結果且替代藥物越來越多,目前NCCN指南不推薦索拉非尼一線治療腎透明細胞癌,主要用於後線治療。一項國內多中心研究對 845 例晚期腎細胞癌患者一線索拉非尼或舒尼替尼治療後的生存和預後因素進行了回顧性分析,結果顯示索拉非尼組與舒尼替尼組的中位無進展生存時間時間分別爲 11.1 個月和 10.0 個月(P = 0.028),兩組的中位總生存時間無差異,均爲24 個月。由於索拉非尼具有良好的耐受性及在亞洲人羣顯示了較高的有效率,因此目前在國內索拉非尼仍在部分腎細胞癌患者推薦爲一線治療方案。
2009 年臨牀腫瘤學雜誌報道Ⅲ期隨機對照臨牀研究,針對一線治療失敗(絕大部分爲細胞因子)的晚期腎透明細胞癌患者,一線治療至少持續 8 個月,ECOG 0~1 分,共903例患者分別接受索拉非尼和安慰劑治療,兩組的無進展生存時間分別爲 5.5 個月和 2.8 個月,中位生存時間分別爲17.8個月和 14.3 個月(HR = 0.78,P=0.029)。
④舒尼替尼:舒尼替尼針二線治療經細胞因子治療後進展的轉移性腎細胞癌患者同樣表現出一定有效性。2006年JCO 報道回顧性研究,63 例經細胞因子治療後進展的腎細胞癌患者二線接受舒尼替尼治療,有效率達40%,中位無進展生存時間爲 8.7 個月。同樣,2006 年JAMA 報道106例患者的回顧性研究,有效率 34%,中位無進展生存時間爲8.3個月。
⑤卡博替尼:卡博替尼二線治療晚期腎透明細胞癌與依維莫司比較有明顯的生存優勢,2016 年Lancet Oncol報道METEOR 研究最終結果,針對一線接受VEGFR-TKI 治療後進展的腎透明細胞癌患者,1:1 接受卡博替尼與依維莫司治療,中位生存時間分別爲 21.4 個月和16.5 個月(HR 0.66,95%CI 0.53~0.83,P=0.000 26),同樣無進展生存時間明顯提升,有效率分別爲 17%和 3%。卡博替尼尚未在中國批准上市,但基於上述國外臨牀試驗結果,推薦卡博替尼作爲轉移性腎細胞癌TKI 治療失敗後的二線治療藥物,具體用法爲卡博替尼60mg,每天1次。
⑥納武利尤單抗:2015 年CheckMate 025 研究結果顯示針對接受過1-2種治療後進展的腎透明細胞癌患者,按照1:1接受納武利尤單抗和依維莫司治療,中位生存時間分別爲25.0 個月和 19.6 個月,有效率分別爲25%和5%,中位無進展生存時間分別爲 4.6 個月和4.4 個月。3/4 度不良反應發生率分別爲 19%和 37%。
⑦侖伐替尼+依維莫司:2016 年Lancet Onco 報道侖伐替尼聯合依維莫司二線治療腎透明細胞癌的Ⅱ期臨牀研究結果,153 例患者隨機接受侖伐替尼聯合依維莫司治療、侖伐替尼單藥治療和依維莫司單藥治療,聯合組與依維莫司組中位無進展生存時間分別爲 14.6 個月和5.5 個月,中位生存時間分別爲 25.5 個月和 15.4 個月,侖伐替尼單藥組中位生存時間 18.4 個月。
⑧培唑帕尼:培唑帕尼一線治療的Ⅲ期試驗中有202例患者爲細胞因子治療後進展的患者,培唑帕尼與安慰劑的中位無進展生存時間分別爲 7.4 個月和4.2 個月。另一項56例患者的Ⅱ期研究顯示,針對舒尼替尼或貝伐珠單抗治療後失敗患者,培唑帕尼治療有效率27%,中位無進展生存時間爲 7.5 個月,2 年生存率 43%。
⑨替西羅莫司:替西羅莫司作爲舒尼替尼治療失敗的腎細胞癌患者的二線治療,中位無進展生存時間爲4.28個月,中位生存時間 12.27 個月。
⑩替沃扎尼:替沃扎尼是一種酪氨酸激酶抑制劑,能抑制 VEGFR1、VEGFR2 和 VEGFR3 的磷酸化,並抑制其他激酶,包括 c-KIT 和 PDGFRβ以及各種腫瘤細胞(包括人腎細胞癌)的生長。適用於既往接受過 2 次或以上的全身治療後復發或難治性晚期腎細胞癌的成人患者。推薦劑量:1.34mg,每天1 次,空腹或餐後均可,服用21 天,停藥7 天(28天1個週期),直至疾病進展或出現不可接受的毒性。對於中度肝功能不全的患者,在治療 21 天后應將劑量降至0.89mg,然後停藥 7 天(28 天週期)。
表 14 轉移性或不可切除性透明細胞型腎細胞癌的藥物治療策略
(推薦在下述任何情況首選參加臨牀研究)

4.5.10.2.3 (3)非透明細胞型腎細胞癌的系統治療:
晚期非透明細胞癌患者由於樣本量少,缺乏相應的大宗隨機對照臨牀試驗。舒尼替尼、索拉非尼以及依維莫司的擴大臨牀研究以及小樣本的Ⅱ期研究顯示這些靶向藥物治療非透明細胞型腎細胞癌有效,但其療效要差於透明細胞型腎細胞癌(表15)。
表 15 轉移性或不可切除性非透明細胞型腎細胞癌的藥物治療策略
(推薦在下述任何情況首選參加臨牀研究)
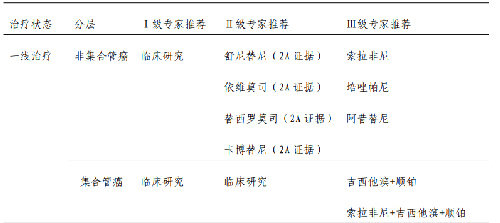
1)舒尼替尼:對於非透明細胞型腎細胞癌的研究目前多爲Ⅱ期臨牀研究,一項涉及31 例患者的研究中,對於非透明細胞癌舒尼替尼的有效率爲36%,中位無進展生存時間爲 6.4 個月;另一項包括 53 例患者的研究中,舒尼替尼/索拉非尼的有效率爲 23%,中位無進展生存時間爲10.6個月。ASPEN 研究中,108 例非透明細胞癌初治患者隨機接受舒尼替尼和依維莫司治療,中位無進展生存時間分別爲8.3個月和 5.6 個月,低危和中危組中位無進展生存時間分別爲14.0 個月與 5.7 個月、6.5 個月與4.9 個月;在高危組中依維莫司略佔優勢,但無統計學意義(4.0 個月與6.1個月)。ESPN 研究中,68 例患者隨機接受舒尼替尼和依維莫司治療,一線治療中,兩組中位無進展生存時間分別爲6.1個月和 4.1 個月(P=0.6),中位生存時間分別爲16.2個月和14.9 個月(P=0.18)。
2)阿昔替尼:目前阿昔替尼針對非透明細胞腎細胞癌患者的治療療效和安全性並不明確,相關研究正在進行中。
3)索拉非尼:一項回顧性Ⅱ期臨牀研究顯示,53例非透明細胞腎細胞癌患者接受舒尼替尼或索拉非尼治療,有效率 10%,中位無進展生存時間爲8.6 個月,中位生存時間19.6個月。
4)貝伐珠單抗:一項Ⅱ期臨牀研究顯示,41 例腎乳頭狀癌患者接受貝伐珠單抗+厄羅替尼治療,其中19 例患者至少接受過一次系統治療,遺傳性平滑肌瘤病和腎細胞癌有效率 60%,散髮乳頭狀癌有效率29%,中位無進展生存時間分別爲 24.2 個月和 7.4 個月。
另一項Ⅱ期臨牀研究顯示,34 例初治的非透明細胞癌患者接受貝伐珠單抗+依維莫司治療,中位無進展生存時間和總生存時間分別爲 11.0 個月和18.5 個月,有效率29%。
5)卡博替尼:目前卡博替尼針對非透明細胞腎細胞癌患者的治療療效和安全性並不明確,相關研究正在進行中。
6)厄洛替尼:一項Ⅱ期臨牀研究顯示,41 例腎乳頭狀癌患者接受貝伐珠單抗+厄羅替尼治療,其中19 例患者至少接受過一次系統治療,遺傳性平滑肌瘤病和腎細胞癌有效率60%,散髮乳頭狀癌有效率 29%,中位無進展生存時間分別爲24.2 個月和 7.4 個月。
7)依維莫司:一項Ⅱ期臨牀研究顯示,34 例初治的非透明細胞癌患者接受貝伐珠單抗+依維莫司治療,中位無進展生存時間和總生存時間分別爲11.0 個月和18.5 個月,有效率 29%。
8)侖伐替尼+依維莫司:目前侖伐替尼+依維莫司針對非透明細胞腎細胞癌患者的治療療效和安全性並不明確,相關研究正在進行中。
9)納武利尤單抗:目前納武利尤單抗針對非透明細胞腎細胞癌患者的治療療效和安全性並不明確,相關研究正在進行中。
10)培唑帕尼:一項意大利的回顧性研究,37 例非透明細胞性腎細胞癌患者一線接受培唑帕尼治療,疾病控制率81%,有效率 27%,中位無進展生存時間和總生存時間分別爲15.9 個月和 17.3 個月。
11)替西羅莫司:一項回顧性的ARCC 試驗顯示替西羅莫司治療非透明細胞癌,中位生存時間11.6個月,針對MSKCC評分高危組替西羅莫司爲Ⅰ類推薦。12)化療:在肉瘤樣和快速進展的RCC 腫使用吉西他濱和多柔比星的聯合方案可能是一種選擇,具體爲多柔比星(50 mg/m2)和吉西他濱(1500 或2000 mg/m2)30分鐘,每 2~3 周 1 次,給與粒細胞集落刺激因子支持治療。
4.5.10.3 3.姑息性放療
對局部瘤牀復發、區域或遠處淋巴結轉移、骨骼或肺轉移患者,姑息放療可達到緩解疼痛、改善生存質量的目的。4.特殊部位轉移的治療原則腎細胞癌常見的轉移部位分別爲肺(45.2%)、骨(29.5%)、淋巴結(21.8%)、肝(20.3%)、腎上腺(8.9%)、腦(8.1%)、腹膜後(6.9%)等。其中肝、骨、腦的轉移由於具有壓迫周圍神經或組織、嚴重影響生活質量以及預後不良等特點而在處理上存在一些特殊性。
4.5.10.3.1 (1)腎細胞癌骨轉移:
腎細胞癌骨轉移部位多見於脊柱、骨盆和四肢近端骨骼,主要症狀爲病變部位進行性疼痛加重;在 X 線攝片下主要表現爲溶骨性骨質破壞,因此轉移部位容易發生病理性骨折,甚至壓迫脊髓引起截癱。此類患者應採用以靶向藥物爲主,結合手術、放療、骨保護劑等相結合的綜合治療。
椎體是常見的腎細胞癌骨轉移部位,根據脊柱轉移瘤NOMS(Neurologic,Oncologic,Mechanical and Systemic)治療規範,對於包括腎細胞癌在內的常規放療不敏感的椎體轉移瘤,推薦 SBRT 或者手術聯合SBRT 的治療模式。文獻報道,SBRT 治療腎細胞癌椎體轉移瘤,1 年局控率高達71%∼90%,1 年疼痛控制率高達 82%,3 度或以上嚴重副反應發生概率僅 0∼ 2%。
對孤立或承重骨轉移竈可考慮手術方法切除轉移竈;承重骨骨轉移伴有骨折風險的患者可採用預防性內固定術等方法以避免骨相關事件的發生。對於已出現病理性骨折或脊髓的壓迫症狀符合下列 3 個條件的患者推薦首選手術治療:①預計患者存活期>3 個月;②體能狀態良好;③術後能改善患者的生活質量,有助於接受進一步的靶向治療、放療和護理。經皮椎體成形術可用於治療脊柱溶骨性破壞和椎體病理性塌陷,可提高轉移部位硬度和受力壓強,緩解局部疼痛。局部姑息性低劑量放射治療對減輕骨轉移疼痛有一定作用。另外,同時使用骨保護劑藥物,包括雙膦酸鹽和地諾單抗、鐳-223,可減少骨相關事件的發生。2016 年美國臨牀腫瘤學會年會的一項METEOR 研究的亞組分析顯示,METEOR研究納入的658例晚期腎細胞癌患者中,有 142 例患者存在骨轉移,其中的112 例患者同時存在骨和內臟轉移。結果顯示,骨轉移患者接受卡博替尼治療後的中位無進展生存時間是 7.4 個月,而依維莫司組爲2.7個月;而對於同時存在骨和內臟轉移的患者,卡博替尼或依維莫司治療後的中位無進展生存時間分別爲5.6 個月和1.9個月,提示卡博替尼可能適合用於腎細胞癌骨轉移患者的治療。
4.5.10.3.2 (2)腎細胞癌腦轉移:
對腦轉移竈,放療的效果優於外科手術治療,且放療可以兼顧多發腦轉移,配合地塞米松和脫水劑可以明顯縮小腫瘤及水腫帶,緩解顱內高壓症狀和其他神經症狀。對體能狀態良好、單純腦轉移的患者(腦轉移竈≤3 個,腦轉移瘤最大直徑≤3cm)首選立體定向放療(γ刀、X 刀、三維適形放療、調強適形放療)或腦外科手術聯合放療;對多發腦轉移患者(腦轉移竈>3 個,腦轉移瘤最大直徑>3cm),可考慮行全顱放療。然後需根據患者的耐受力,進行全身抗腫瘤藥物治療。
4.5.10.3.3 (3)腎細胞癌肝轉移:
腎細胞癌肝轉移患者,通常預後較差,應首先考慮全身靶向藥物治療,如全身治療無效,可考慮聯合肝臟轉移竈的局部治療,如消融治療、經肝動脈化學栓塞術、SBRT 以及高強度聚焦超聲治療等,可作爲綜合治療的一部分,提高肝轉移竈的局部控制,單獨使用治療意義不大。
4.6 七、隨訪
常規隨訪內容包括:①病史詢問。②體格檢查。③實驗室檢查,包括尿常規、血常規、尿素氮、肌酐、腎小球濾過率、乳酸脫氫酶、肝功能、鹼性磷酸酶和血清鈣。如果有鹼性磷酸酶異常升高和/或有骨轉移症狀如骨痛,需要進行骨掃描檢查。④胸部平掃 CT 掃描。⑤腎腫瘤伴有急性神經系統跡象或症狀的患者須即刻進行頭部神經系統橫斷面CT或MRI 掃描或基於相應節段症候的脊髓掃描。
4.6.1 (一)術後隨訪。
對接受手術治療的 pT1N0/NxM0 期腎細胞癌患者應在術後 3~12 個月內做腹部 CT 或MRI 檢查作爲基線片,以後每年進行 1 次,連續 3 年進行腹部影像學超聲、CT 或MRI檢查,每年 1 次連續 3 年行胸部 CT 以確定是否有肺轉移。對接受手術治療的 pT2~4N0/NxM0 腎細胞癌患者影像學檢查時限改爲每 6 個月 1 次至少持續 3 年,此後,每年1 次。
4.6.2 (二)局部治療患者的隨訪。
對接受冷凍和射頻等局部治療的pT1aN0/NxM0 期腎細胞癌患者,應在術後 3~6 個月內做腹部CT 或MRI 檢查作爲基線片,以後每年進行 1 次(包括腹部和胸部影像學檢查);如果隨訪中發現原腎臟病竈增大、出現新的強化、或出現新病竈,則需要對病竈進行穿刺活檢。
4.6.3 (三)晚期患者的隨訪。
對接受全身系統治療的復發/轉移性Ⅳ期腎細胞癌患者,應儘可能在系統治療前對全身所有可評價病竈(病竈最大徑超過 1cm)進行 CT 或 MRI 的影像學檢查,作爲基線片,以後應根據病情和治療方案需要,每6~16 周進行相同的影像學檢查比較病竈大小、數量的變化以評價系統治療的療效。
5 附件 腎癌診療指南(2022 年版)編寫審定專家組
(按姓氏筆畫排序)組長:張旭
成員:馬建輝、王禾、王霄英、田愛平、邢念增、劉玉國、許傳亮、李方、李肖、何立儒、宋巖、張雯傑、鄭閃、鄭翠玲、房輝、黃健、盛錫楠、韓蘇軍、廖晶