2 基本信息
《腦膠質瘤診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
腦膠質瘤診療指南(2022年版)
4.1 一、概述
腦膠質瘤是指起源於腦神經膠質細胞的腫瘤,是最常見的原發性顱內腫瘤,2021年版WHO中樞神經系統腫瘤分類將腦膠質瘤分爲1~4級,1、2級爲低級別腦膠質瘤,3、4級爲高級別腦膠質瘤1。本指南主要涉及星形細胞、少突膠質細胞和室管膜細胞來源的成人高、低級別腦膠質瘤的診治2,3。
我國腦膠質瘤年發病率爲5~8/10萬,5年病死率在全身腫瘤中僅次於胰腺癌和肺癌。腦膠質瘤發病機制尚不明瞭,目前確定的兩個危險因素是:暴露於高劑量電離輻射和與罕見綜合徵相關的高外顯率基因遺傳突變。此外,亞硝酸鹽食品、病毒或細菌感染等致癌因素也可能參與腦膠質瘤的發生。
腦膠質瘤臨牀表現主要包括顱內壓增高、神經功能及認知功能障礙和癲癇發作三大類。目前,臨牀診斷主要依靠CT及MRI等影像學診斷,彌散加權成像(diffusionweightedimaging,DWI)、彌散張量成像(diffusiontensorimaging,DTI)、灌注加權成像(perfusionweightedimaging,PWI)、磁共振波譜成像(magneticresonancespectroscopy,MRS)、功能磁共振成像(functionalmagneticresonanceimaging,fMRI)、正電子發射體層成像(positronemissiontomography,PET)等對腦膠質瘤的鑑別診斷及治療效果評價有重要意義。腦膠質瘤確診需要通過腫瘤切除手術或活檢手術獲取標本,進行組織病理和分子病理整合診斷,確定病理分級和分子亞型。分子標誌物對腦膠質瘤的個體化治療及臨牀預後判斷具有重要意義。腦膠質瘤治療以手術切除爲主,結合放療、化療等綜合治療方法。手術可以緩解臨牀症狀,延長生存期,並獲得足夠腫瘤標本用以明確病理學診斷和進行分子遺傳學檢測。手術治療原則是最大範圍安全切除腫瘤,而常規神經導航、功能神經導航、術中神經電生理監測和術中MRI實時影像等新技術有助於實現最大範圍安全切除腫瘤。放療可殺滅或抑制腫瘤細胞,延長患者生存期,常規分割外照射是腦膠質瘤放療的標準治療。膠質母細胞瘤(glioblastoma,GBM)術後放療聯合替莫唑胺同步並輔助替莫唑胺化療,已成爲成人新診斷GBM的標準治療方案。
腦膠質瘤治療需要神經外科、神經影像科、放射治療科、神經腫瘤科、病理科和神經康復科等多學科合作(multi-disciplinaryteam,MDT),遵循循證醫學原則,採取個體化綜合治療,優化和規範治療方案,以期達到最大治療效益,儘可能延長患者的無進展生存時間和總生存時間,提高生存質量。爲使患者獲得最優化的綜合治療,醫師需要對患者進行密切隨訪和全程管理,定期影像學複查,兼顧考慮患者的日常生活、社會和家庭活動、營養支持、疼痛控制、康復治療和心理調控等諸多問題。
4.2 二、影像學診斷
4.2.1 (一)腦膠質瘤常規影像學特徵。
神經影像常規檢查目前主要包括CT和MRI。這兩種成像方法可以相對清晰精確地顯示腦解剖結構特徵及腦腫瘤病變形態學特徵,如部位、大小、周邊水腫狀態、病變區域內組織均勻性、佔位效應、血腦屏障破壞程度及病變造成的其他合併徵象等。在圖像信息上MRI優於CT。CT主要顯示腦膠質瘤病變組織與正常腦組織的密度差值,特徵性密度表現如鈣化、出血及囊性變等,病變累及的部位,水腫狀況及佔位效應等;常規MRI主要顯示腦膠質瘤出血、壞死、水腫組織等的不同信號強度差異及佔位效應,並且可以顯示病變的侵襲範圍。多模態MRI不僅能反映腦膠質瘤的形態學特徵,還可以體現腫瘤組織的功能及代謝狀況。常規MRI掃描,主要獲取T1加權像、T2加權像、液體衰減反轉恢復(fluidattenuatedinversionrecovery,FLAIR)序列成像及進行磁共振對比劑的強化掃描。腦膠質瘤邊界不清,表現爲長T1、長T2信號影,信號可以不均勻,周邊水腫輕重不一。因腫瘤對血腦屏障的破壞程度不同,增強掃描徵象不一。腦膠質瘤可發生於腦內各部位。低級別腦膠質瘤常規MRI呈長T1、長T2信號影,邊界不清,周邊輕度水腫影,局部輕度佔位徵象,如鄰近腦室可致其輕度受壓,中線移位不明顯,腦池基本正常,病變區域內少見出血、壞死及囊變等表現;增強掃描顯示病變極少數出現輕度異常強化影。高級別腦膠質瘤MRI信號明顯不均勻,呈混雜T1、T2信號影,周邊明顯指狀水腫影;佔位徵象明顯,鄰近腦室受壓變形,中線結構移位,腦溝、腦池受壓;增強掃描呈明顯花環狀及結節樣異常強化影。不同級別腦膠質瘤的PET成像特徵各異。目前廣泛使用的示蹤劑爲氟-18-氟代脫氧葡萄糖(18Ffluorodeoxyglucose,18F-FDG)及碳-11蛋氨酸(11Cmethionine,11C-MET)。低級別腦膠質瘤一般代謝活性低於正常腦灰質,高級別腦膠質瘤代謝活性可接近或高於正常腦灰質,但不同級別腦膠質瘤之間的18F-FDG代謝活性存在較大重疊(2級證據)4。氨基酸腫瘤顯像具有良好的病變-本底對比度,對腦膠質瘤的分級評價優於18F-FDG,但仍存在一定重疊。
臨牀診斷懷疑腦膠質瘤擬行活檢時,可用PET確定病變代謝活性最高的區域。
18F-FET和11C-MET比,18F-FDG具有更高的信噪比和病變對比度(2級證據)5。PET聯合MRI檢查比單獨MRI檢查更能準確界定放療靶區(1級證據)6。相對於常規MRI技術,氨基酸PET可以提高勾畫腫瘤生物學容積的準確度,發現潛在的被腫瘤細胞浸潤/侵襲的腦組織(在常規MRI圖像上可無異常發現),並將其納入到患者的放療靶區中(2級證據)7,8。18F-FDGPET由於腫瘤/皮層對比度較低,因而不適用於輔助制定放療靶區(2級證據)9。神經外科臨牀醫師對神經影像診斷的要求很明確:首先是進行定位診斷,確定腫瘤的大小、範圍、腫瘤與周圍重要結構(包括重要動脈、皮層靜脈、皮層功能區及神經纖維束等)的毗鄰關係及形態學特徵等,這對制定腦膠質瘤手術方案具有重要的作用;其次是對神經影像學提出功能狀況的診斷要求,如腫瘤生長代謝、血供狀態及腫瘤對周邊腦組織侵襲程度等,這對患者術後的綜合療效評估具有關鍵作用。除基礎T1、T2、增強T1等常規MRI序列,多模態MRI序列如DWI、PWI、MRS等,不僅能反映腦膠質瘤的形態學特徵,還可以體現腫瘤組織的功能及代謝狀況。DWI高信號區域提示細胞密度大,代表高級別病變區;PWI高灌注區域提示血容量增多,多爲高級別病變區;MRS中膽鹼(choline,Cho)和Cho/N-乙酰天門冬氨酸(Nacetyl-aspartate,NAA)比值升高,與腫瘤級別呈正相關。DTI、血氧水平依賴(bloodoxygenationleveldependent,BOLD)等fMRI序列,可明確腫瘤與重要功能皮層及皮層下結構的關係,爲手術切除過程中實施腦功能保護提供證據支持。多模態MRI對於腦膠質瘤的鑑別診斷、確定手術邊界、預後判斷、監測治療效果及明確有無復發等具有重要意義,是形態成像診斷的一個重要補充。
表1 腦膠質瘤影像學診斷要點
| 腫瘤類型 | 影像學特徵性表現 | |
| 低級別腦膠質瘤 | 主要指瀰漫性星形膠質細胞瘤、少突膠質細胞瘤、少突星形膠質細胞瘤3種。特殊類型還包括:PXA、第三腦室脊索瘤樣腦膠質瘤和毛細胞型星形細胞瘤等。 | 瀰漫性星形膠質細胞瘤MRI信號相對均勻,長T1、長T2和FLAIR高信號,多無強化;少突膠質細胞瘤表現同瀰漫性星形腦膠質瘤,常伴鈣化。PXA多見於顳葉,位置表淺,有囊變及壁結節。增強掃描,壁結節及鄰近腦膜有強化。第三腦室脊索瘤樣腦膠質瘤位於第三腦室內。毛細胞型星形細胞瘤以實性爲主,常見於鞍上和小腦半球。 |
| 間變性腦膠質瘤(3級) | 主要包括間變性星形細胞瘤、間變性少突膠質細胞瘤。 | 當MRI/CT表現似星形細胞瘤或少突膠質細胞瘤伴強化時,提示間變腦膠質瘤可能性大。 |
| 4級腦膠質瘤 | 膠質母細胞瘤;瀰漫性中線膠質瘤。 | 膠質母細胞瘤特徵爲不規則形周邊強化和中央大量壞死,強化外可見水腫。瀰漫中線膠質瘤常發生於丘腦、腦幹等中線結構,MRI表現爲長T1長T2信號,增強掃描可有不同程度的強化。 |
| 室管膜腫瘤 | 主要指2級和3級室管膜腫瘤。特殊類型:黏液乳頭型室管膜瘤爲1級。 | 室管膜腫瘤邊界清楚,多位於腦室內,信號混雜,出血、壞死、囊變和鈣化可並存,瘤體強化常明顯。黏液乳頭型室管膜瘤好發於脊髓圓錐和馬尾。 |
注:PXA,多形性黃色瘤型星形細胞瘤;FLAIR,液體抑制反轉恢復序列。
4.2.2 (二)腦膠質瘤鑑別診斷。
4.2.2.1 1.腦內轉移性病變
腦內轉移性病變以多發病變較爲常見,多位於腦皮層下,大小不等,水腫程度不一,表現多樣,多數爲環狀或結節樣強化影。腦內轉移性病變的18F-FDG代謝活性可低於、接近或高於腦灰質;氨基酸代謝活性一般高於腦灰質。單發轉移癌需要與高級別腦膠質瘤鑑別,影像學上可以根據病變大小、病變累及部位、增強表現,結合病史、年齡及相關其他輔助檢查結果綜合鑑別。
4.2.2.2 2.腦內感染性病變
腦內感染性病變,特別是腦膿腫,需與高級別腦膠質瘤鑑別。兩者均有水腫及佔位徵象,強化呈環形。腦膿腫的壁常較光滑,無壁結節,而高級別腦膠質瘤多呈菜花樣強化,囊內信號混雜,可伴腫瘤卒中。絕大部分高級別腦膠質瘤的氨基酸代謝活性明顯高於正常腦組織,而腦膿腫一般呈低代謝。
4.2.2.3 3.腦內脫髓鞘樣病變
與腦膠質瘤易發生混淆的是腫瘤樣脫髓鞘病變,增強掃描可見結節樣強化影,診斷性治療後複查,病變縮小明顯,易復發,實驗室檢查有助於鑑別診斷。
4.2.2.4 4.淋巴瘤
對於免疫功能正常的患者,淋巴瘤的MRI信號多較均勻,瘤內出血及壞死少見,增強呈明顯均勻強化。18F-FDG代謝活性一般較高級別腦膠質瘤高且代謝分佈較均勻。
4.2.2.5 5.其他神經上皮來源腫瘤包括中樞神經細胞瘤等。
4.2.3 (三)腦膠質瘤影像學分級。
4.2.3.1 1.常規MRI檢查
除部分2級腦膠質瘤(如多形性黃色星形細胞瘤、第三腦室脊索瘤樣腦膠質瘤和室管膜瘤等)外,高級別腦膠質瘤MRI常有強化伴卒中、壞死及囊變。MRI有無強化及強化程度受到諸多因素影響,如使用激素、注射對比劑的量、機器型號及掃描技術等。
4.2.3.2 2.多模態MRI檢查
包括DWI、PWI及MRS等。DWI高信號區域,提示細胞密度大,代表高級別病變區;PWI高灌注區域,提示血容量增多,多爲高級別病變區;MRS中Cho和Cho/NAA比值升高,與腫瘤級別正相關。
4.2.3.3 3.PET
腦膠質瘤代謝成像的腫瘤-本底對比度偏低,而氨基酸腫瘤顯像具有較好的組織對比度,因此建議採用氨基酸PET腦顯像評價腦膠質瘤級別(2級證據)10。11C-METPET評估準確度高於MRI,高級別腦膠質瘤的11C-MET代謝活性通常高於低級別腦膠質瘤,但高/低級別腦膠質瘤間仍存在一定的重疊(2級證據)11-13。必要時建議使用18F-FDGPET動態成像分析以提高對腦膠質瘤的影像學分級。
4.2.4 (四)腦膠質瘤治療後影像學評估。
腦膠質瘤術後24~72小時內需複查MRI(平掃+增強),評估腫瘤切除程度,並以此作爲腦膠質瘤術後基線影像學資料,用於後續比對。膠質瘤治療效果的影像學評價參見RANO標準(表2)14。
表2 腦膠質瘤治療效果評估RANO標準
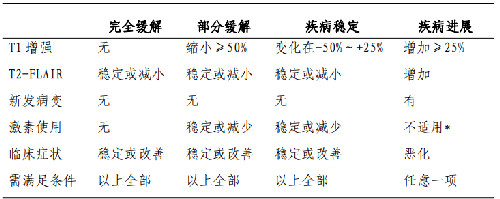
注:*在出現持續的臨牀症狀惡化時,即爲疾病進展,但不能單純的將激素用量增加作爲疾病進展的依據。
腦膠質瘤按照復發部位包括原位復發、遠處復發和脊髓播散等特殊方式,其中以原位復發最爲多見15。組織病理學診斷仍然是金標準。假性進展多見於放/化療後3個月內,少數患者可見於10~18個月內。常表現爲病變周邊的環形強化,水腫明顯,有佔位徵象,需要結合臨牀謹慎判斷。對於高級別腦膠質瘤,氨基酸PET對鑑別治療相關變化(假性進展、放射性壞死)和腫瘤復發/進展的準確度較高(2級證據)16,17。放射性壞死多見於放療3個月後,目前尚無特異性檢查手段鑑別放射性壞死與腫瘤進展/復發。對於高級別膠質瘤,18F-FDGPET用於評價術後腫瘤復發和放射性壞死較MRI優勢不明顯,氨基酸PET用於鑑別腫瘤進展和治療相關反應具有較高的敏感度和特異度。對於低級別膠質瘤,
18F-FDGPET不適用於評價腫瘤治療反應,而氨基酸PET的評價作用也有限(1級證據)18。定期MRI或PET檢查,有助於鑑別假性進展和腫瘤進展/復發(表3)。多模態MRI檢查如PWI及MRS等也有一定的參考意義。

4.3 三、神經病理學與分子病理學診斷
(一)2021版WHO中樞神經系統腫瘤分類標準。腦膠質瘤是一組具有膠質細胞表型特徵的神經上皮腫瘤的總稱。隨着病理學的發展和病理檢測技術的進步,尤其是二代測序、DNA甲基化譜等組學技術的提高,膠質瘤的遺傳背景和發生發展機制逐漸清晰。越來越多的分子標誌物被證明在膠質瘤的分類、分型、分級、預後和治療方面發揮着重要的作用19-22。2021年發佈的第5版《WHO中樞神經系統腫瘤分類》整合了腫瘤的組織學特徵和分子表型,提出了新的腫瘤分類標準,重點推進了分子診斷在中樞神經系統腫瘤分類中的應用。這一分類是目前腦膠質瘤診斷及分級的重要依據(表4)。
成人型瀰漫性膠質瘤
少突膠質細胞瘤,IDH突變伴1p/19q聯合缺失型
膠質母細胞,IDH野生型
兒童型瀰漫性低級別膠質瘤
瀰漫性星形細胞瘤,MYB或MYBL1變異型
血管中心型膠質瘤
瀰漫性低級別膠質瘤,MAPK信號通路變異型
兒童型瀰漫性高級別膠質瘤
瀰漫性中線膠質瘤,H3K27變異型
瀰漫性兒童型高級別膠質瘤,H3野生和IDH野生型
嬰兒型半球膠質瘤
侷限性星形細胞膠質瘤
多形性黃色星形細胞瘤
脊索樣膠質瘤
星形母細胞瘤,伴MN1改變
幕上室管膜瘤
幕上室管膜瘤,ZFTA融合陽性型
幕上室管膜瘤,YAP1融合陽性型
後顱窩室管膜瘤
後顱窩室管膜瘤,PFA組
後顱窩室管膜瘤,PFB組
脊髓室管膜瘤
脊髓室管膜瘤,MYCN擴增型
黏液乳頭型室管膜瘤
室管膜下瘤
4.3.1 (二)腦膠質瘤分類及其分子變異。
4.3.1.1 1.腫瘤分類與分子表型
第5版《WHO中樞神經系統腫瘤分類》根據組織學和分子病理學特點將膠質瘤分爲5個組別(表5):
①成人型瀰漫性膠質瘤;
②兒童型瀰漫性低級別膠質瘤;
③兒童型瀰漫性高級別膠質瘤;
④侷限性星形膠質瘤;
⑤室管膜腫瘤。
| 標誌物 | 遺傳學變異 | 檢測方法 | 診斷價值 | 預後意義 |
| IDH1 | 突變(R132H/C/L/S/G) | 提示預後相對良好;在臨牀試驗中常作爲重要分組指標;與MGMT啓動子甲基化密切相關;對放療和烷化劑相對敏感;潛在的治療靶點(例如Ivosidenib)。 | ||
| IDH2 | 突變(R172K/M/G/W) | Sanger測序,焦磷 酸測序,二代測序 | ||
| 染色體1p/19q | 聯合缺失 | 少突膠質細胞瘤的關鍵變異。 | 提示預後相對良好;對於放療和烷化劑相對敏感。 | |
| H3K27 | 突變(K27M) | 免疫組化,Sanger測序,二代測序 | 診斷瀰漫性中線膠質瘤,H3K27突變型的關鍵參考指標。 | 預後相對較差;可作爲潛在治療靶點(例如EZH2抑制劑)。 |
| H3G34 | 突變(G34R/V) | 免疫組化,Sanger測序,二代測序 | 瀰漫性中線膠質瘤,H3K27突變型。 | 生存期比IDH突變型膠質母細胞瘤略長,但比IDH突變型WHO4級膠質瘤短。 |
| ATRX | 突變 | 免疫組化Sanger測序,二代測序 | 相對於IDH突變型膠質母細胞瘤預後較好。 | |
| TP53 | 突變 | 免疫組化Sanger測序,二代測序 | ATRX核表達缺失和/或p53突變陽性,可在不檢測1p19q的情況下診斷爲IDH突變型星形細胞瘤。可用於鑑別瀰漫或非瀰漫性WHO1級膠質瘤及膠質增生。 | |
| CDKN2A/B | 純合性缺失 | 在IDH突變型膠質瘤中預後較差。 | ||
| TERT | Sanger測序,焦磷酸測序,二代測序 | 在少突膠質細胞瘤和膠質母細胞瘤中常見;在缺少組織學壞死和微血管增生的情況下,是膠質母細胞瘤,IDH野生型,WHO4級的診斷指標之一。 | 在IDH野生型膠質瘤中預後較差;在IDH突變型膠質瘤中預後較好。 | |
7/10 | +7/-10 | FISH,二代測序,微陣列芯片 | 在IDH野生型膠質瘤中預後較差。 | |
| EGFR | 擴增 | FISH,數字PCR,二代測序,微陣列芯片 | ||
| EGFRvIII重排 | 靶向治療的潛在靶點。 | |||
| BRAF | 突變(BRAFV600E) | 靶向治療的靶點(例如vemurafenib)。 | ||
| MGMT | 啓動子區甲基化 | 在膠質母細胞瘤中預後較好;替莫唑胺治療效果較好;與IDH突變和G-CIMP亞型相關。 | ||
| FGFR | 融合基因(FGFR-TACC) | Sanger測序,qPCR,二代測序 | 可作爲靶向治療的潛在靶點(例如FGFR抑制劑)。 | |
| MET | 融合基因(PTPRZ1-MET) 突變(METex14) | Sanger測序, qPCR,二代測序 | 在繼發性膠質母細胞瘤(星形細胞瘤,IDH 突變型,WHO 4 級)中預後較差;可作爲治療靶點(例如MET 抑制劑)。 | |
| miR-181d | 高表達 | microRNA表達譜芯片,qPCR,原位雜交染色 | 在膠質母細胞瘤中表達較高時,對替莫唑胺化療效果較好。 | |
| TSC1/2 | 突變 | Sanger測序,NGS | 診斷室管膜下巨細胞星形細胞瘤的特異性標誌物。 | mTOR信號通路抑制劑(如依維莫司)治療靶點。 |
| ZFTA | 基因融合(C11orf95-RELA) | FISH,NGS | 發生該融合的幕上室管膜瘤患者預後相對較差。 | |
| YAP1 | 基因融合(YAP1-MAMLD1) | FISH,NGS | 發生該融合的幕上室管膜瘤患者預後相對較好。 | |
| MYCN | 擴增 | FISH,NGS | 發生該擴增的脊髓室管膜瘤患者預後相對較差。 | |
| NF1 | 突變 | Sanger測序,NGS | 在視路膠質瘤和IDH野生型膠質母細胞瘤中突變頻率較高。 | 攜帶該突變的毛細胞型星形細胞瘤預後相對較好。 |
注:
FISH,熒光原位雜交技術;
PCR,聚合酶鏈式反應技術;
qPCR,定量聚合酶鏈式反應技術;
MLPA,多重連接依賴探針擴增技術。
4.3.1.1.1 (1)成人型瀰漫性膠質瘤和兒童型瀰漫性膠質瘤:
新版分類首次將瀰漫性膠質瘤分爲成人型和兒童型瀰漫性膠質瘤兩大類。需要注意的是,這一診斷分類並非完全依據腫瘤發病年齡,而是依據主要分子變異及此類腫瘤在不同年齡段分佈等臨牀特徵。成人型瀰漫性膠質瘤是成人膠質瘤的主要類型,但可發生於兒童;而兒童型瀰漫性膠質瘤主要發生在兒童,亦可發生於成人,尤其是青年。異檸檬酸脫氫酶(isocitratedehydrogenase,IDH)突變是成人型瀰漫性膠質瘤重要的診斷標誌物。IDH突變的瀰漫性膠質瘤,如伴有1號染色體短臂/19號染色體長臂(1p/19q)聯合缺失,可診斷爲“少突膠質細胞瘤,IDH突變和1p/19q聯合缺失型”;如無1p/19q聯合缺失,但有ATRX突變的瀰漫性膠質瘤,可診斷爲“星形細胞瘤,IDH突變型”,CDKN2A/B純合性缺失是此類型腫瘤分級標誌物。IDH野生且組蛋白H3野生的瀰漫性膠質瘤,如出現壞死或微血管增生,或具有EGFR擴增、7號染色體擴增/10號染色體缺失(+7/-10)、TERT啓動子區突變三個分子變異之一,可診斷爲“膠質母細胞瘤,IDH野生型”。兒童型瀰漫性低級別膠質瘤以MYB/MYBL1變異和絲裂原活化蛋白激酶(MAPK)信號通路變異爲主要分子特徵。其中,MYB/MYBL1基因拷貝數變異和基因融合是診斷“瀰漫性星形細胞瘤,MYB或MYBL1變異型”和“血管中心型膠質瘤”的重要分子標誌物;MAPK信號通路相關的基因變異,包括BRAF、FGFR1等,是“青少年多形性低級別神經上皮腫瘤”和“瀰漫性低級別膠質瘤,MAPK通路變異型”的重要診斷標準。兒童型瀰漫性高級別膠質瘤則以組蛋白H3變異爲主要分子特徵,包括發生在中線位置、H3K27me3核表達缺失的“瀰漫性中線膠質瘤,H3K27變異型”和發生於半球、H3G34R/V突變的“瀰漫性半球膠質瘤,H3G34突變型”。對於缺乏IDH突變和H3變異,常發生於嬰幼兒、兒童和青年人,具備高級別組織學特徵的瀰漫性膠質瘤,根據其分子變異和甲基化特徵可診斷爲“瀰漫性兒童型高級別膠質瘤,H3野生和IDH野生型”或“嬰兒型大腦半球膠質瘤”。
4.3.1.1.2 (2)侷限性星形細胞膠質瘤:
新版分類將毛細胞型星形細胞瘤、有毛細胞樣特徵的高級別星形細胞瘤、多形性黃色星形細胞瘤、室管膜下巨細胞型星形細胞瘤、脊索樣膠質瘤,以及星形母細胞瘤,MN1變異型等6類膠質瘤歸爲侷限性星形細胞膠質瘤。“侷限性”是指它們相對可控的生長方式,與“瀰漫性”腫瘤相對應,意味着此類膠質瘤的生長方式較侷限,影像學可見腫瘤界限較清晰,但並不代表低級別,某些腫瘤存在侵襲甚至播散可能23。此類腫瘤大部分具有典型的組織學特點,如星形母細胞性假菊形團、毛細胞型星形細胞瘤中的雙相結構和毛樣細胞等,同時還具備一些特徵型的分子變異,如KIAA1549:BRAF融合、BRAFV600E突變、TSC1/TSC2突變、PRKCAD463H突變等。
其中,有毛細胞樣特徵的高級別星形細胞瘤是WHOCNS5中新定義的一類腫瘤,此類腫瘤的診斷需要依賴DNA甲基化譜;具有典型星形母細胞瘤形態的腫瘤,如果攜帶MN1變異,可以診斷爲“星形母細胞,MN1變異型”。
4.3.1.1.3 (3)室管膜腫瘤:
室管膜瘤的分子特徵與其解剖位置、年齡等因素密切相關。幕上室管膜瘤以融合基因爲主要特徵,可分爲ZFTA融合陽性型和YAP1融合陽性型。非ZFTA非YAP1融合的幕上室管膜瘤比例較低。後顱窩室管膜瘤表現爲特徵性的DNA甲基化譜改變,可分爲PFA組和PFB組;PFA組室管膜瘤主要發生在嬰幼兒,多數具有間變性特徵,預後差,組蛋白H3K27me3表達缺失,EZHIP過表達,基因組較穩定;PFB組室管膜瘤主要發生於大齡兒童或成人,預後相對較好,H3K27me3表達正常。脊髓室管膜瘤中有一類以MYCN基因擴增爲特徵,具有很強的侵襲性和轉移能力,預後較差。
4.3.1.2 2.腫瘤WHO分級
新版分類不再跨腫瘤實體分級,而是按照腫瘤類型分級,進一步強調了腫瘤類型內的生物學相似性。同時,在組織學分級的基礎上引入分子特徵,當腫瘤組織形態表現爲低級別但具有特定分子變異時,可將該腫瘤定位高級別,如CDKN2A/B純合性缺失的IDH突變型星形細胞瘤,即使沒有出現微血管增生或壞死等高級別組織學特徵,也將被診斷爲CNSWHO4級。需要注意的是,新版分級體系仍然保留了中樞神經系統的特點,因此建議在定級時使用“CNSWHO級別”一詞。
4.3.1.3 3.NOS(非特指)和NEC(未分類)診斷
使用NOS和NEC可以有效地標識
(2)分子檢測無法進行有效分類或結果爲陰性的不明確的腫瘤診斷。NOS表示無法建立組織形態學聯合分子水平的整合診斷,進而臨牀醫生分子檢測尚未進行或技術原因導致的分子檢測的失敗。另一方面,NEC表示已成功進行了必要的診斷性檢查,但鑑於臨牀、組織學、免疫組織化學和/或遺傳特徵不相匹配,無法做出WHO整合診斷。NEC提醒臨牀醫生儘管進行了充分的病理檢查,但檢測結果不符合WHO的標準診斷。與WHO診斷一樣,NEC和NOS診斷也應當通過分層整合報告。
4.3.1.4 4.病理報告
整合和分層診斷膠質瘤病理報告應當標準化、規範化,並按照新版分類進行整合及分層診斷。內容應包括:
(1)整合診斷;
(3)CNSWHO級別;
(4)分子信息,應註明標本類型、檢測方法、變異類型等詳細信息。同時,病理報告中還應該包括患者基本臨牀信息、腫瘤部位及特殊情況備註等。
4.4 四、治療
4.4.1 (一)手術治療。
4.4.1.1 1.概述
腦膠質瘤手術治療原則是最大範圍安全切除,其基本目的包括:解除佔位徵象和緩解顱內高壓症狀;解除或緩解因腦膠質瘤引發的相關症狀,如繼發性癲癇等;獲得病理組織和分子病理,明確診斷;降低腫瘤負荷,爲後續綜合治療提供條件。
4.4.1.1.1 (1)腫瘤切除術適應證和禁忌證:
①適應證:CT或MRI提示顱內佔位;存在明顯的顱內高壓及腦疝徵象;存在由於腫瘤佔位而引起的神經功能障礙;有明確癲癇發作史;患者自願接受手術。
②禁忌證:嚴重心、肺、肝、腎功能障礙及復發患者,一般狀況差不能耐受手術;其他不適合接受神經外科開顱手術的禁忌證。
4.4.1.1.2 (2)病理活檢術適應證和禁忌證:
①適應證:腫瘤位於優勢半球,廣泛浸潤性生長或侵及雙側半球;腫瘤位於功能區皮質、白質深部或腦幹部位,且無法滿意切除;需要鑑別病變性質。
②禁忌證:嚴重心、肺、肝、腎功能障礙及復發患者,一般狀況差不能耐受手術;其他不適合接受神經外科手術的禁忌證。
4.4.1.1.3 (3)病理活檢手術方式:
活檢可分爲立體定向或導航下活檢和開顱手術活檢兩類。立體定向或導航下活檢適用於位置更加深在的病變;而開顱活檢適用於位置淺表或接近功能區皮質的病變。開顱活檢比立體定向活檢可以獲得更多的腫瘤組織,有利於結果的判定。活檢的診斷準確率高於影像學診斷,但是受腫瘤的異質性和靶區選擇等因素影響仍存在誤診率。
4.4.1.1.4 (4)圍手術期處理:
①術前處理:若術前出現明顯的顱內高壓症狀,應及時給予脫水藥物緩解顱內高壓;若存在明顯腦積水,可考慮先行腦室腹腔分流術或腦室穿刺外引流術。
②術後處理:需根據顱內壓情況選擇是否使用脫水藥物進行降顱壓治療,並適當使用激素穩定患者神經功能狀態;若術後出現發熱,需及時進行腰椎穿刺採集腦脊液進行實驗室檢查,積極防治顱內感染;術後應常規監測電解質,積極糾正電解質紊亂;對幕上腦膠質瘤患者,術後應常規應用抗癲癇藥物預防癲癇發作。
4.4.1.1.5 (5)新型手術輔助技術的運用:
新型手術輔助技術的應用有助於手術切除程度和腫瘤邊界的判定及術中功能保護。
推薦:神經影像導航、功能神經影像導航(2、3級證據)23、術中神經電生理監測技術(例如,皮質功能定位和皮質下神經傳導束定位)(3級證據)24和術中MRI實時影像神經導航(3級證據)25。多模態神經導航聯合術中皮質及皮質下定位,可進一步提高手術安全性,保護神經功能,有利於最大範圍安全切除(3級證據)26。可推薦:熒光引導的顯微手術(2級證據)27和術中B超影像實時定位。
4.4.1.1.6 (6)腦膠質瘤手術切除程度的判定:
強烈推薦腦膠質瘤術後24~72小時內複查MRI,高級別腦膠質瘤以MRI增強、低級別腦膠質瘤以T2-FLAIR的容積定量分析爲標準,並以此影像作爲判斷後續治療療效或腫瘤進展的基線。以此將切除程度按切除腫瘤體積分爲4個等級,即全切除、次全切除、部分切除、活檢,目前具體標準尚不統一。
4.4.1.2 2.高級別腦膠質瘤
強烈推薦最大範圍安全切除(2、3級證據)28,29。手術目的包括:緩解由顱壓高和壓迫引起的症狀;降低類固醇藥物使用,維持較好的生存狀態;降低腫瘤細胞負荷,爲輔助放/化療創造條件;延長生存期;獲得精確病理診斷。與單純活檢相比,儘可能切除腫瘤是影響高級別腦膠質瘤患者預後的重要因素30。但由於高級別腦膠質瘤的浸潤特性,實現病理上完全切除腫瘤常較困難。新型手術輔助技術的運用有助於高級別腦膠質瘤的最大範圍安全切除。腫瘤切除程度是高級別腦膠質瘤的獨立預後因素之一,腫瘤全切可延長術後腫瘤復發時間和患者生存期(2、3級證據)28,29,31。
4.4.1.3 3.低級別腦膠質瘤
低級別腦膠質瘤約佔腦膠質瘤的30%,患者的發病年齡比高級別腦膠質瘤年輕,常位於或靠近重要功能區,如運動、語言、視空間和記憶。對於瀰漫性低級別腦膠質瘤,強烈推薦最大範圍安全切除腫瘤(2、3級證據)32。新型手術輔助技術可以有效提高患者影像學的腫瘤全切率,減低術後永久性神經功能障礙的發生率(2、3級證據)24,25。喚醒手術技術擴大了在腦功能區實施手術的指徵(詳見“功能區腦膠質瘤的手術治療”部分)。針對非功能區或鄰近功能區的低級別腦膠質瘤,腦功能定位技術可以識別與關鍵腦功能有關的皮質和皮質下結構,使手術切除範圍擴大到重要功能結構的臨界,以實現低級別腦膠質瘤的最大範圍安全切除33。
4.4.1.4 4.復發腦膠質瘤
目前,復發腦膠質瘤的手術治療獲益,尚缺乏高級別的循證醫學證據。手術原則是最大範圍安全切除。手術目的包括:獲取組織學和生物學信息,確定是復發還是假性進展,減小腫瘤負荷,緩解症狀,術後可進行其他治療34。新型手術輔助技術有助於實現最大範圍安全切除復發腦膠質瘤。復發腦膠質瘤的手術治療必須個體化,應該考慮患者年齡、臨牀功能狀態、組織學類型、初始治療反應、復發類型(局部還是瀰漫性)、第一次手術和再次手術的時間間隔、既往治療方式等35。
4.4.1.5 5.功能區腦膠質瘤
功能區腦膠質瘤是指根據術前磁共振影像顯示腫瘤累及感覺運動區(中央前回、運動前區、輔助運動區和感覺區)、語言區(包括:優勢半球的顳上回後部、顳中回和顳下回後部、額下回後部、額中回後部、緣上回、角回等)、頂葉視空間認知功能區和計算功能區、基底節或內囊、丘腦、距狀溝視皮質等皮質及皮質下結構36。現代認知神經科學認爲大腦的功能區分佈是一個高度複雜的拓撲網絡結構37,功能區膠質瘤往往侵犯拓撲網絡結構的關鍵節點或連接,可直接或間接造成患者運動、語言、認知和記憶等神經功能損傷。功能區腦膠質瘤手術具有其特殊的手術方式和手術技巧。
4.4.1.5.1 (1)手術方式:
目前,對功能區腦膠質瘤患者手術時推薦採用術中喚醒配合術中腦功能定位38-42,在提高腫瘤切除範圍及切除程度的同時,可有效避免患者出現術後永久性功能障礙。
適應證包括:累及腦功能區的腦膠質瘤患者;對功能定位有主觀配合意願;自願接受喚醒麻醉手術者。除常規全身麻醉下開顱手術禁忌證外,禁忌證還應包括43:患者術前出現嚴重的顱內高壓症狀或已存在腦疝,常規術前使用脫水藥物後功能無改善;存在意識障礙或重度認知障礙;明確精神病史;溝通交流障礙,存在嚴重神經功能缺失或難以配合完成術中指定檢測任務;麻醉醫師和手術醫師無喚醒手術經驗;患者拒絕接受喚醒麻醉手術;年齡小於18歲(相對禁忌),心理發育遲滯;患者不能長時間耐受固定體位等。
4.4.1.5.2 (2)術前評估:
①術前影像學評估:強烈推薦MRIT1、T2、T2-FLAIR、T1增強、任務態BOLD-fMRI、DTI、3D-T1WI;推薦MRS、靜息態功能磁共振(resting-statefunctionalmagneticresonanceimaging,Rs-fMRI)、PWI。T1、T2、T2-FLAIR、T1增強MRI序列:可確定病變範圍,水腫及惡性程度。腫瘤侵襲區域和功能區的距離與患者的功能狀態相關。當腫瘤距離手運動區皮質<6mm時,腫瘤易造成患者術前肌力損傷44。BOLD-fMRI技術常用於對患者四肢運動功能區及語言功能區的定位(3級證據)45,46,但當腫瘤臨近功能區(如腫瘤距離手運動區皮質<4mm時),其定位準確效度會受腫瘤影響而下降(3級證據)47,推薦使用ZOOMit序列進行功能定位,可以有效改善定位精度(3級證據)48。術前應用fMRI技術對患者進行功能區定位,有利於術者在術中確定腫瘤的切除範圍,有效避免患者術後出現永久性功能損傷(3級證據)49。Rs-fMRI是一種不需要患者在檢查中完成任務的成像方法,推薦將該技術作爲一種補充檢查手段(3級證據)50,應用於無法配合完成BOLD-fMRI檢查的患者。DTI及纖維束追蹤:強烈推薦在腫瘤侵犯腦功能區的腦膠質瘤患者中使用,可以提高腫瘤切除範圍,同時保護患者的神經功能(3級證據)51。同時,推薦在非功能區腦膠質瘤患者中廣泛應用該技術,以瞭解腫瘤與周圍神經纖維解剖結構的情況。
②術前神經功能評估:術前應用客觀神經心理學量表評估患者的功能狀態,爲術者制定手術及術後治療方案提供幫助。應用的量表應具備包含正常範圍參考值、可重複性高等特點。
強烈推薦:卡諾夫斯凱計分(Kanofskyperformancescore,KPS)、愛丁堡利手檢查。推薦(根據腫瘤累及的腦功能區選擇):韋氏成人智力量表、西部失語症成套測驗中文版、漢語失語成套測驗、忽視測評(如線段等分劃消實驗等)。可推薦:瓦達試驗、中國康復研究中心失語症檢查法、語言任務標準圖庫(2021SR0231666)、蒙特利爾認知評估量表(MoCA)、抑鬱自評量表、焦慮自評量表、症狀自評量表。
③術前癲癇評估:強烈推薦對患者的癲癇病史、癲癇發作的症狀、癲癇發作程度及藥物控制這四方面情況客觀評估。具體細則參考《國際抗癲癇聯盟(ILAE)癲癇治療指南1981年版、1990年修訂版及2013版癲癇治療指南》52,53,《成人瀰漫性膠質瘤相關癲癇臨牀診療指南(英文版)》54。
4.4.1.5.3 (3)手術準備:
切口設計:根據病變的部位和功能區的位置設計切口,原則上應包含腫瘤和其累及的重要功能腦區(監測靶區)。基於以下因素綜合考慮:
②複發率高的腫瘤(如腦膠質瘤)要考慮二次手術可能。
體位:常採取側臥位或仰臥位,以頭架固定。若採取仰臥,應嚴密注意防範術中誤吸的發生。選擇的體位要保證患者術中舒適,擺好體位後使用保溫毯有助於減少患者喚醒後寒戰以及其引起的顱內壓增高等。麻醉方式:目前功能區腦膠質瘤喚醒手術包括術中喚醒麻醉開顱腦功能區腫瘤切除術和監護麻醉下全程清醒開顱腦功能區腫瘤切除術兩種。睡眠-清醒-睡眠(AAA)麻醉模式,是目前最爲常用的喚醒手術麻醉方式,是一種深度麻醉接近於全身麻醉的技術,此種技術需要喉罩、帶套囊口咽氣道等輔助氣道工具來保持患者氣道通常;在監護麻醉下進行的全程清醒開顱腦功能區腫瘤切除術,是一種使患者處於適度鎮靜的清醒狀態下的腫瘤切除手術,其優勢在於手術過程中患者一直處於自主呼吸狀態,無需進行喉罩等輔助通氣設備,可避免術中喚醒後因拔除喉罩誘發患者顱內壓增高。
4.4.1.5.4 (4)術中操作:
開顱過程:頭架固定釘局部浸潤麻醉、頭皮重要神經阻滯(眶上神經和滑車上神經、耳顳神經、枕小神經、枕大神經和第三枕神經)和切口局部浸潤麻醉,切口麻醉範圍包括術野皮膚、皮下至骨膜,包括皮瓣基底部。告知麻醉醫師喚醒患者,並對硬膜用2%利多卡因浸潤棉片覆蓋15~20min。待患者喚醒且一般狀況及情緒穩定後,剪開硬腦膜並四周懸吊硬腦膜(不可過度牽拉),硬膜外徹底止血55。
術中影像學技術:強烈推薦使用神經導航系統;推薦使用術中MRI、術中超聲等。
①神經導航系統:術中可根據導航棒探針的位置,確定手術切除位置及切除深度(3級證據)56。
②術中MRI技術:可以輔助術者確定腫瘤切除後殘餘腫瘤的體積,提高腫瘤的最終切除程度(3級證據)57。③術中超聲成像:可在術中輔助判斷腫瘤範圍和切除程度,提供病變周圍及內部血流情況。術中腦功能定位技術:強烈推薦直接電刺激定位功能區皮質(2、3級證據)58,59;推薦體感誘發電位定位中央溝,持續經顱或經皮質運動誘發電位監測運動通路完整性,直接電刺激定位皮質和皮質下功能結構,神經導航結合術前fMRI定位影像。
①運動區陽性表現爲對側肢體或面部相應部位肌肉出現不自主動作,同時可記錄到肌電活動;電刺激運動前區或輔助運動區可能引起復雜運動。
②運動區皮質下需要監測和保護的重要結構爲錐體束60-62。感覺區監測:感覺區陽性表現爲對側肢體或頭部脈衝式的異常感覺,多表現爲麻木感;刺激感覺區有時也可引起肢體運動。
語言區監測:推薦的語言任務有:數數和圖片命名。電刺激過程中,患者出現的異常表現(包括:語言中斷、構音障礙、命名錯誤、反應遲鈍、語言重複等)均提示該區域爲物體命名相關語言中樞63。圖片材料推薦選用經過漢語語言標準化的物體圖片。語言區皮質下需要監測和保護的重要結構有弓狀束、上縱束、下枕額束、額斜束、下縱束等64,65。
切除策略:在保留重要功能結構的前提下,選擇適當的手術入路儘可能切除病變。目前國際公認的切除安全範圍應至少距離陽性刺激區5mm(3級證據)66。同時注意保護正常動脈及腦表面重要引流血管。通常先切除非功能區腫瘤,然後逐步推進至重要功能區附近,切除過程持續監測患者功能狀態,可疑存在皮層下重要通路,即時進行皮質下電刺激,以確定重要皮質下功能結構並予以保護。切除病變後,可應用術中MRI、術中超聲或腫瘤熒光顯像等技術觀察病變有無殘留67,68。
4.4.1.5.5 (5)術後評估及預後:
強烈推薦術後24~72h內行MRI檢查,高級別腦膠質瘤以MRI增強、低級別腦膠質瘤以T2-FLAIR的容積定量分析爲標準,評價腫瘤切除程度。推薦分別在術後1-3天、1個月、3個月、6個月評價患者的KPS評分、語言功能、運動功能及生活質量等。評價過程推薦採用神經影像與行爲量表相結合的方式。
應用喚醒手術直接皮質及皮質下電刺激技術定位和保護功能區,可顯著降低患者術後永久性神經功能障礙的發生率,術後暫時性神經功能障礙多可在3個月內恢復(3級證據)69。
4.4.1.6 6.合併癲癇症狀的腦膠質瘤
4.4.1.6.1 (1)手術治療控制腦膠質瘤相關癲癇:
腦膠質瘤全切除優於次全切除對術後癲癇的控制(1級證據)70,71。腦膠質瘤全切除後大部分腦膠質瘤相關癲癇患者能達到無癲癇發作,在安全可行的情況下,儘可能做最大程度病變切除,以利於術後癲癇控制(2級證據)72。術前有繼發性癲癇大發作及腫瘤有鈣化的膠質瘤患者,術後癲癇預後更好(3級證據)73。與單純病變切除相比,應用癲癇外科手術技術可以提高術後癲癇控制率,特別是顳葉腦膠質瘤相關癲癇的患者,行腫瘤切除聯合鉤回、杏仁核選擇性切除和/或顳葉前部皮質切除後,更利於腦膠質瘤相關癲癇的控制(2級證據)。但是否保留海馬結構,需結合患者對記憶以及學習能力的實際需求酌情考量。
腦膠質瘤引起的癲癇發作風險與腫瘤累及的腦區有關(2級證據)74。功能區腦膠質瘤的手術切除範圍相對有限,術後癲癇發生率也相對較高,應充分利用現有技術,在保護腦功能的前提下,儘可能多地切除腫瘤,以減少術後癲癇發作(3級證據)75。
對於伴發癲癇的腦膠質瘤患者,建議酌情采用術中皮質腦電圖或深部腦電監測,指導癲癇竈切除範圍,以改善患者癲癇預後,提高長期癲癇治癒率(2級證據)76。
4.4.1.6.2 (2)術中癲癇的控制:
累及腦功能區的腦膠質瘤,在術中電刺激功能區定位時,存在一定的癲癇發作風險(2級證據)77,78,當術中腦電監測或症狀觀察提示患者出現癲癇發作時,用冰林格氏液或冰生理鹽水沖洗局部可控制大部分癲癇發作(2級證據)79。仍有癲癇持續發作者可以應用抗癲癇藥物、鎮靜藥物或者肌松藥物終止發作(4級證據)78。
4.4.1.6.3 (3)難治性腦膠質瘤相關癲癇的手術治療:
應用抗癲癇藥物過程中出現癲癇復發或加重常提示腫瘤進展(2級證據)80,腦膠質瘤術後無癲癇發作較長時間後再次出現癲癇發作,可能提示腫瘤復發(2級證據)81。腦膠質瘤復發伴頻繁的藥物難治性癲癇發作時,綜合患者情況,可以手術治療。無復發的術後腦膠質瘤伴頻繁癲癇發作,可按照難治性癲癇進行全面評價,對於藥物難治性腦膠質瘤相關癲癇且明顯影響生活質量,可考慮手術(3級證據)82。
4.4.2 (二)放射治療。
放射治療通常是在明確腫瘤病理後,採用6~10MV直線加速器,常規分次,擇機進行,立體定向放射治療不適用於腦膠質瘤的初治。
4.4.2.1 1.高級別腦膠質瘤
手術是基礎治療,放/化療等是不可或缺的重要治療手段,高級別膠質瘤術後放療可以取得顯著生存獲益(1級證據)。
4.4.2.1.1 (1)放療時機:
高級別膠質瘤生存時間與放療開始時間密切相關83,術後早期放療能有效延長患者生存期,強烈推薦術後儘早(術後2-6周)開始放療(2級證據)。
4.4.2.1.2 (2)放療技術:
推薦採用三維適形放射治療或適形調強技術,常規分次,適形放療技術可提高靶區劑量覆蓋率、適形度及對正常組織保護,縮小不必要照射體積,降低併發症(2級證據)84,放療前圖像驗證是放療質控不可缺少的環節。
4.4.2.1.3 (3)放療劑量:
推薦放射治療照射總劑量爲54~60Gy,常規分次,腫瘤體積較大和/或位於重要功能區及3級膠質瘤,可適當降低照射總劑量(1級證據)85。儘管三維適形放射治療或適形調強技術具有提高靶區適形度、減少正常組織受量,最大限度縮小照射體積,能夠給予靶區更高的放療劑量,但提高劑量後的療效尚未得到證實,盲目提高照射總劑量或分次量,應慎重。
4.4.2.1.4 (4)靶區確定:
高級別膠質瘤放療靶區爭議至今,其焦點主要是最初的臨牀靶區(clinicaltargetvolume,CTV)是否需要包括瘤周水腫區,美國腫瘤放射治療協會(TheRadiationTherapyOncologyGroup,RTOG)推薦CTV1需包括瘤周水腫區外2cm區域,給予46Gy,縮野後CTV2需在大體腫瘤靶區(grosstargetvolume,GTV)外擴2cm,劑量爲14Gy。2021年美國國家綜合癌症網絡(NationalComprehensiveCancerNetwork,NCCN)指南推薦MRIT1增強或T2-FLAIR異常信號爲GTV,外擴1~2cm形成CTV;如果考慮水腫區,建議包括在一程CTV1中(46Gy/23f),二程增量區(14Gy/7f)CTV2僅包括殘餘腫瘤和/或術後瘤腔並適當外擴。Ⅱ期臨牀試驗證實:靶區是否包括水腫區,在腫瘤控制和生存期上無明顯差異86,87,歐洲癌症研究和治療組織(EuropeanOrganisationfortheResearchandTreatmentofCancer,EORTC)推薦的CTV設定並不強調一定要包括所有瘤周水腫區。靶區勾畫原則是在安全的前提下,儘可能保證腫瘤照射劑量60Gy,靶區勾畫應參考術前/後MRI,正確區分術後腫瘤殘存與術後改變,預判腫瘤侵襲路徑,在臨牀實踐中,醫師應根據靶區位置、體積、患者年齡、KPS評分等因素綜合考慮,靈活運用以上關於靶區設定的建議,平衡照射劑量、體積與放射性損傷之間的關係。
4.4.2.1.5 (5)聯合放化療:
①GBM:強烈推薦成人初治者放療聯合替莫唑胺(75mg/m2)同步化療,並隨後6週期替莫唑胺(150-200mg/m2)輔助化療,在放療中和放療後應用替莫唑胺,顯著延長患者生存期(1級證據)88,這一協同作用在MGMT啓動子區甲基化患者中最爲明顯(2級證據)89。
②3級膠質瘤:對於存在1p/19q聯合缺失的患者對化/放療更敏感(1級證據)90,91,放療聯合PCV(甲基苄肼+洛莫司汀+長春新鹼)化療是一線治療方案(1級證據),目前替莫唑胺對3級膠質瘤的治療初步顯示療效(2級證據),且副反應更少。研究替莫唑胺、放療、1p/19q聯合缺失三者關係的2項大型臨牀隨機試驗正在進行,中期結果顯示:對於無1p/19q聯合缺失者,放療聯合12個週期替莫唑胺化療,顯著改善患者生存期92。IDH野生型伴或不伴TERT啓動子區突變患者,臨牀預後最差,應提高放化療強度,在2級膠質瘤中也同樣存在這樣的現象93。3級膠質瘤放療應根據患者具體情況,包括一般狀態、分子病理和治療需求等採用個體化治療策略,治療選擇包括放療聯合PCV方案/替莫唑胺多種治療模式,及參加臨牀試驗等。
4.4.2.2 2.低級別腦膠質瘤
低級別膠質瘤術後放療適應證、最佳時機、放療劑量等存在爭議,目前通常根據患者預後風險高低來制訂治療策略。
4.4.2.2.1 (1)危險因素:
年齡≥40歲、腫瘤未全切除,腫瘤體積大,術前神經功能缺損,IDH野生型等是預後不良因素94,95。對於腫瘤未全切除或年齡≥40歲的患者,推薦積極行早期治療。年齡<40歲且腫瘤全切除的患者,可選擇密切觀察96,但應綜合考慮患者病情和分子病理後慎重決定。
4.4.2.2.2 (2)放療劑量:
推薦低級別膠質瘤放療總劑量爲45~54Gy,分次劑量1.8~2.0Gy(1級證據)97。對於IDH野生型低級別膠質瘤(2021版WHO分類定義4級星形細胞瘤)需提高劑量到59.4~60Gy,隨着適形調強放療和分子分型在臨牀普遍應用,適度提高放療劑量(54~59.4Gy)有助於延長患者生存期,尤其對於分子病理定義的星形細胞瘤或MGMT啓動子非甲基化患者98,99。分次劑量超過2Gy會增加發生遠期認知障礙的風險(2級證據)100。
4.4.2.2.3 (3)靶區確定:
GTV主要是根據手術前/後MRIT2-FLAIR異常信號區域,正確區分腫瘤殘留和術後改變尤其重要,推薦以GTV外擴1~2cm作爲低級別膠質瘤的CTV。
4.4.2.3 3.室管膜腫瘤
手術是室管膜腫瘤首選治療方法,腫瘤全切後多數學者主張無需輔助治療,室管膜瘤部分切除和間變性室管膜瘤是放療適應證(3級證據)101。對放療後短期復發或年幼不宜行放療者,可以選擇化療作爲輔助治療,但療效並不確定。
室管膜腫瘤術後3周,需行全腦全脊髓MRI和腦脊液脫落細胞學檢查,無腦和脊髓腫瘤播散證據者,選擇局部放療,反之則推薦全腦全脊髓放療(3級證據)102,103。局部放療:根據手術前/後MRI確定腫瘤局部照射範圍,通常採用增強T1或T2-FLAIR異常信號爲GTV,CTV爲GTV外擴1~2cm,分次劑量1.8~2.0Gy/次,顱內腫瘤總劑量54~59.4Gy,脊髓區腫瘤劑量45Gy,如果腫瘤位於脊髓圓錐以下時,總劑量可以提高至60Gy。全腦全脊髓放療:全腦包括硬腦膜以內的區域,全脊髓上起第一頸髓、下至尾椎硬膜囊,全腦全脊髓照射總劑量36Gy,每次1.8~2.0Gy,後續顱內病竈區縮野局部追加劑量至54~59.4Gy,脊髓病竈區追加劑量至45Gy。
4.4.2.4 4.復發腦膠質瘤
評估復發腦膠質瘤再程放療安全性時,應充分考慮腫瘤位置及大小。對於較小的復發病竈,回顧性研究多采用立體定向放射外科治療或低分次立體定向放射治療技術104,105,傳統的常規分次放療研究多集中在體積相對較大的復發病竈,由於復發前多接受過放療,再次放療劑量的疊加可能會造成腦組織的嚴重損傷,應充分考慮腦組織耐受性和放射性腦壞死的發生風險106。研究顯示:放療聯合貝伐珠單抗及替莫唑胺,能延長部分患者的無進展生存時間和總生存時間107,108。
4.4.2.5 5.放射性腦損傷
放療對腦組織損傷依據發生的時間和臨牀表現劃分爲三種不同類型:急性(放療中或放療後6周內)、亞急性(放療後6周至6個月)和晚期(放療後數月至數年)。
4.4.2.5.1 (1)急性和亞急性放射損傷:
急性和亞急性放射損傷可能爲血管擴張、血腦屏障受損和水腫所致。急性損傷表現爲顱高壓徵象,如噁心、嘔吐、頭痛和嗜睡等。通常是短暫且可逆,應用皮質類固醇可緩解症狀,在MRI上有時表現出瀰漫性水腫;亞急性放射性腦損傷表現爲嗜睡和疲勞,通常可在數週內自愈,必要時予以皮質類固醇類藥物以控制症狀。
4.4.2.5.2 (2)晚期放射損傷:
晚期放射反應常常是進行性和不可逆的,包括白質腦病、放射性壞死和其他各種病變(多爲血管性病變)。放療總劑量、分次劑量等與白質腦病的發生直接相關109,110。非治療相關因素包括一些使血管性損傷易感性增加的伴隨疾病,如糖尿病、高血壓及高齡等,均可使白質腦病的發生率增加。同步化療也是另外一個危險因素110。腦膠質瘤替莫唑胺同步放化療後假性進展發生率明顯增高,其本質就是早期放射性壞死。放療最嚴重的晚期反應是放射性壞死,發生率約爲3%~24%。放療後3年是出現高峯。放射性壞死的臨牀表現與腫瘤復發相似,如初始症狀的再次出現,原有的神經功能障礙惡化和影像學上出現進展且不可逆的強化病竈,其周圍有相關水腫。減少放射損傷根本在於預防,合理規劃照射總劑量,分次量及合適的靶區體積可有效減少放射性壞死發生率。
4.4.3 (三)藥物治療。
化療是通過使用化學藥物殺滅腫瘤細胞的治療方法,化療可以延長腦膠質瘤患者的無進展生存時間及總生存時間111,112。高級別膠質瘤生長及復發迅速,進行積極有效的個體化化療更有價值。其他藥物治療如分子靶向和生物免疫治療等,目前均尚在臨牀試驗階段。鼓勵有條件及符合條件的患者,在不同疾病階段參加藥物臨牀試驗。1.基本原則
(1)腫瘤切除程度影響化療效果。推薦在最大範圍安全切除腫瘤的基礎上進行化療。
(2)術後應儘早開始足量化療。在保證安全的基礎上,完成既定方案,可獲得最佳治療效果,同時應注意藥物毒性並監測免疫功能。
(3)選擇作用機制不同及毒性不重疊的藥物進行聯合化療,減少毒性和耐藥發生率。
(5)某些抗腫瘤和抗癲癇藥物會相互影響,同時使用時應酌情選擇。
(6)積極參與有效可行的藥物臨牀試驗。
4.4.3.1 2.高級別腦膠質瘤
(1)經典化療方案:
①Stupp方案:放療期間同步口服替莫唑胺75mg/(m2·d),連服42天;同步放化療結束4周,進入輔助化療階段,口服替莫唑胺150~200mg/(m2·d),連用5天,每28天重複,共6個週期。
②PCV方案:甲基苄肼60mg/(m2·d)第8~21天,洛莫司汀110mg/(m2·d)第1天,長春新鹼1.4mg/m2第8、29天,8周爲1個週期。
應用於膠質瘤治療的藥物還有卡莫司汀、伊立替康、依託泊苷、順鉑、卡鉑等。
(2)3級膠質瘤化療:3級膠質瘤化療,目前沒有標準方案,推薦在分子病理指導下選擇放療聯合PCV/替莫唑胺的多種化療方案(2級證據)113,或參加臨牀試驗。具有1p/19q聯合缺失的3級少突膠質細胞瘤,推薦放療102加PCV化療方案(1級證據)90,91,放療加同步和/或輔助替莫唑胺化療(2級證據)90,91;對於無1p/19q聯合缺失者推薦放療加輔助替莫唑胺化療114。KPS<60的3級膠質瘤,推薦短程或常規放療聯合替莫唑胺化療(2級證據)115。
(3)GBM化療(年齡≤70歲):KPS≥60患者,若存在MGMT啓動子區甲基化,推薦常規放療加同步和輔助替莫唑胺化療加或不加電場治療(1級證據)85,還可推薦常規放療加同步和輔助替莫唑胺聯合洛莫司汀化療(2級證據)116或臨牀試驗;對於MGMT啓動子區非甲基化或甲基化情況不明確者,推薦放療加同步和輔助替莫唑胺化療加或不加電場治療(1級證據)85,或臨牀試驗。KPS<60患者,推薦短程放療,加或不加同步和輔助替莫唑胺化療(2級證據)115;存在MGMT啓動子區甲基化者,也可單獨替莫唑胺化療(2級證據)。
(4)間變性室管膜瘤化療:化療通常在腫瘤復發,或出現全腦全脊髓播散時進行,常用藥物:鉑劑、依託泊苷、洛莫司汀、卡莫司汀以及替莫唑胺等,或參加臨牀試驗。
4.4.3.2 3.低級別腦膠質瘤
目前低級別膠質瘤化療爭議較大,主要包括:化療時機、化療方案、化療與放療次序等。根據目前循證醫學證據,對於高危低級別膠質瘤患者,應積極考慮放療聯合化療117,118。推薦化療方案包括:PCV方案(1級證據)119;替莫唑胺化療(2級證據)120;替莫唑胺同步和/或輔助化療(2級證據)120。對於有BRAFV600E激活突變或NTRK融合的低級別膠質瘤患者可推薦合適的靶向藥物。
4.4.3.3 4.復發腦膠質瘤
目前尚無針對標準治療後復發膠質瘤的標準化療方案。如爲高級別復發膠質瘤,強烈建議優先選擇臨牀試驗,如果無合適臨牀試驗,可採用以下方案:
4.4.3.3.1 (1)低級別膠質瘤復發後可選方案:
①放療加輔助PCV化療;
②放療加輔助替莫唑胺化療;
⑧如有BRAFV600E激活突變或NTRK融合者可推薦相應的靶向藥物。、
(2)3級膠質瘤復發後可選方案:
①替莫唑胺123;
③PCV方案;
④貝伐珠單抗125;⑤貝伐珠單抗加化療(卡莫司汀/洛莫司汀,替莫唑胺);
⑥依託泊苷126;
⑧如有BRAFV600E激活突變或NTRK融合者可推薦相應的靶向藥物。
(3)GBM復發後可選方案:
①貝伐珠單抗127;
②替莫唑胺128;
④PCV方案;
⑤瑞戈非尼129;
⑦依託泊苷;
⑨如有BRAFV600E激活突變或NTRK融合者可推薦相應的靶向藥物。
4.4.4 (四)電場治療。
腫瘤治療電場的原理是通過中頻低場強的交變電場持續影響腫瘤細胞內極性分子的排列,從而干擾腫瘤細胞有絲分裂,發揮抗腫瘤作用。用於腦膠質瘤治療的電場治療系統是一種無創便攜式設備,通過貼敷於頭皮的電場貼片發揮作用,目前研究顯示電場治療安全且有效130,推薦用於新診斷GBM(1級證據)和復發高級別腦膠質瘤的治療(2級證據)。2020年5月,國家藥品監督管理局通過了電場治療的上市申請,並批准將其與替莫唑胺聯合用於新診斷GBM患者的治療,以及作爲單一療法用於復發GBM患者的治療。
4.4.5 (五)老年腦膠質瘤治療原則。
目前對老年的定義尚沒有統一標準,本指南所指老年是指年齡>70週歲者。GBM是老年膠質瘤最常見的病理類型,老年GBM具有獨特的分子遺傳學特徵,主要包括ATRX、BRAF、IDH和TP53突變率明顯下降,PTEN突變率明顯增加131,TP53突變和EGFR擴增可能與患者預後相關132。老年GBM患者的治療方案主要包括手術切除、放療以及替莫唑胺化療。對於KPS≥60的老年GBM患者,美國2021年NCCN指南還推薦電場治療(1級證據)。
4.4.5.1 1.手術治療
手術切除腫瘤可以使老年GBM患者得到肯定的生存獲益(1級證據)133,全切腫瘤更有利於術後功能的恢復(2級證據)134。綜合老年狀態評估評價較好者,手術切除具有良好的安全性和臨牀獲益135。因此,老年膠質瘤患者同樣優先推薦手術治療,而80歲以上老年患者需要慎重考慮手術,術前評分較差的老年患者不推薦手術治療。
4.4.5.2 2.放療和化療
放療和化療可以明確延長患者總生存時間。老年GBM患者,如KPS≥60推薦應用短程或常規放療聯合替莫唑胺化療(1級證據)136;如KPS<60者則推薦短程放療或替莫唑胺化療。
4.4.6 (六)瀰漫性中線膠質瘤治療原則。
瀰漫性中線膠質瘤是指發生於丘腦、腦幹和脊髓的中線結構膠質瘤。國內目前尚無確切的流行病學數據,國外報道:兒童發病高峯6~7歲,成人20~50歲,沒有明顯性別差異137,治療困難,預後極差。2021年WHO中樞神經系統腫瘤分類將瀰漫性中線膠質瘤定爲4級。臨牀和影像懷疑瀰漫性中線膠質瘤患者建議檢測H3K27M變異情況,主要包括H3.3K27突變、H3.1/2K27突變、H3野生伴EZHIP過表達、EGFR突變,其中H3K27M突變是小兒瀰漫內生性橋腦膠質瘤最常見改變,患者預後更差138,139。
4.4.6.1 1.手術治療
腫瘤位置險要且呈浸潤性生長,手術難以做到腫瘤完全切除,通常不被常規優先推薦。多數情況下腫瘤活檢可行並被推薦,目的是明確病理和分子病理,指導綜合治療140。
4.4.6.2 2.放療和化療
目前尚無成熟的放療和化療方案。放療可提高部分患者腫瘤客觀反應率(3級證據)141,可參考GBM治療方案142,根據具體情況適當調整放療劑量。放療聯合替莫唑胺化療或靶向治療也是治療選擇142,143,推薦合適的患者參加臨牀試驗。
4.4.7 (七)康復及姑息性治療。
腦膠質瘤患者術後大多存在不同程度的生理功能和社會心理方面的障礙,這些障礙限制了患者的日常活動和社會參與度,降低了患者的生活質量。合理適度的康復治療能夠有效降低腦膠質瘤相關致殘率,是腦膠質瘤臨牀管理中不可或缺的重要環節。此外,腦膠質瘤患者在整個疾病發展過程中需要全面的姑息性治療,適當的姑息性治療可以有效減輕腦膠質瘤患者的症狀負擔,並改善患者(特別是終末期患者)及看護人員的生活質量。以上兩類治療的臨牀管理同樣需要腦膠質瘤治療團隊的關注。
4.4.7.1 1.康復治療的模式
對於膠質瘤患者的康復治療,目前推薦採用國內已廣泛應用的三級康復醫療服務體系:一級康復指患者早期在神經外科腫瘤病房的早期康復治療,是神經外科腫瘤醫師在術後針對患者術後可能的併發症及功能障礙進行的康復活動指導,推薦在患者接受手術或其他治療後,生命體徵穩定的情況下早期進行;二級康復是指患者轉入綜合醫院康復病房或專業康復機構後進行的康復治療;三級康復指患者在社區或家中繼續進行的康復治療,應由社區康復醫師在二級康復的基礎上重新制訂康復計劃並實施,如患者功能相對恢復較好,可由康復醫師對患者及家屬進行康復教育,使患者在家自行進行康復鍛鍊。
4.4.7.2 2.常見康復問題及評估
腦膠質瘤所導致的康復問題可分爲殘損、活動限制和參與受限3個層次。
(1)殘損:主要包括肢體肌肉無力、感覺缺失、平衡障礙、吞嚥障礙、構音障礙、失語症、認知障礙和心理障礙等。肌力可用徒手肌力測試評定,感覺缺失可用Fugl-meyer四肢感覺功能評測法評定,平衡障礙則可用伯格平衡量表評定,吞嚥障礙可用窪田飲水試驗、視頻吞嚥造影檢查評定,構音障礙可用改良Frenchay法評定,失語症可用波士頓診斷性失語檢查法,認知障礙評定可用簡易精神狀態檢查法、認知與精神測定量表評定,焦慮和抑鬱可用漢密爾頓焦慮和抑鬱量表評定。
(2)活動限制:指上述神經殘損導致患者在移動和自我照料方面的困難。可採用巴塞爾指數、功能獨立性量表評定。
(3)參與受限:指上述神經殘損導致患者在就業、家庭生活及社會融合等方面的困難。可採用健康調查量表36評定。
4.4.7.3 3.常見康復治療策略
腦膠質瘤患者的康復治療涉及多學科跨領域的合作,需要遵循集體協同的工作模式,其康復治療策略涵蓋範圍也較廣,具體如下:
4.4.7.3.1 (1)運動障礙治療:
腦膠質瘤患者的運動功能障礙並非一定由膠質瘤本身造成,也可能是手術切除、放療以及化療的併發症。其康復治療以運動療法爲主,包括正確體位的擺放、關節活動度練習、肌力訓練、耐力訓練、神經肌肉促進技術訓練、平衡及協調性訓練、步態訓練和呼吸訓練等。對於身體條件能支持正常鍛鍊的膠質瘤患者,國際專家組織建議每週進行至少150分鐘的中等強度或75分鐘的高等強度有氧運動,並進行兩組主要肌羣的強化鍛鍊144。此外,針對部分術後出現運動功能障礙的患者,可採用經顱磁刺激的方式,對重要的功能網絡節點進行刺激,促進節點功能重塑,加快患者術後運動功能康復145。
4.4.7.3.2 (2)感覺障礙治療:
在腦膠質瘤患者中,感覺障礙通常是由包括初級感覺皮質在內的體感通路的直接損傷引起的。在有效治療原發腫瘤或停用引起併發症的化療藥物後,感覺障礙可能會得到明顯緩解或改善。患有感覺障礙的患者需要接受適當的康復治療以防止其感覺功能進行性下降,物理療法通常是針對患者的靜態姿勢、轉移和步態進行訓練,並鼓勵患者更多的依賴視覺而不是感覺去感知周圍環境。此外,可以訓練患者在行走和上下樓梯時使用柺杖一類的輔助設備,以補償其下肢本體感覺敏銳度的降低。
4.4.7.3.3 (3)言語語言障礙治療:
言語語言障礙包括構音障礙及失語症等,需要根據患者言語語言評定的結果分別採用促進言語功能恢復的訓練和非言語交流方式的使用訓練。前者包括語音訓練、聽覺理解能力訓練、口語表達訓練等,後者包括手勢語、畫圖、交流板、交流手冊及電腦交流裝置使用訓練。
4.4.7.3.4 (4)吞嚥障礙治療:
63%的腦腫瘤患者在早期康復治療中會出現吞嚥障礙,吞嚥障礙通常都會逐漸改善,50%的患者在出院時可以恢復正常飲食。吞嚥障礙的康復治療策略主要包括營養攝入途徑的改變、促進吞嚥功能恢復的康復訓練、食物性狀和進食體位的調整、吞嚥康復相關的康復護理和教育四個方面。
4.4.7.3.5 (5)認知障礙治療:
腦膠質瘤及其相關治療可以導致認知功能的跨領域損害,多表現爲記憶缺陷(主要是工作記憶)、執行功能、注意力、定向力和視空間功能障礙等。既往研究已證實,規範的認知康復有助於腦膠質瘤患者認知功能的改善。認知康復治療的內容主要包括增強對認知缺損認識和理解的教育、減少認知缺損所造成影響的適應性治療及針對認知缺損的修復性治療,其中適應性和修復性治療應以患者的生活方式和工作需要爲導向。
4.4.7.3.6 (6)心理治療:
針對腦膠質瘤患者出現的焦慮和抑鬱,可通過心理干預的方法來緩解和消除。對於中、重度焦慮或抑鬱患者可酌情給予抗焦慮和抑鬱的藥物。同時應兼顧對患者的家屬、護工的心理支持和教育。
4.4.7.3.7 (7)作業治療:
作業治療是指以應用與日常生活、工作有關的各種作業活動或工藝過程中的某個運動環節作爲訓練方式,以最終提高患者在生活自理、工作及休閒活動上的獨立能力爲目的的治療方法。主要包括維持日常生活所必需的基本作業治療、創造價值的作業治療、消遣性或文娛性作業治療、教育性作業治療及輔助支具使用訓練等。
4.4.7.3.8 (8)康復工程:
對於腦膠質瘤患者的肢體無力和平衡障礙,可以通過康復工程製作各種輔助器具,以改善患者的日常生活能力。如:用佩戴踝足矯形器來改善足下垂,用寬基底的四腳杖、標準助行器或半助行器來增加支撐面從而降低步行或站立時的跌倒風險等。
4.4.7.3.9 (9)藥物治療:
患者康復治療過程中出現肢體痙攣或疼痛、肺部及尿路感染、抑鬱或焦慮等症狀時,酌情使用一些對症藥物是很有必要的。但與此同時,應當慎重使用對症支持性藥物,因爲這些藥物可能是導致認知功能障礙的潛在原因。此外,不建議基於預防或治療認知功能下降的原因對腦膠質瘤患者進行相關藥物治療。
4.4.7.3.10 (10)祖國傳統醫學和其他康復治療:
可選擇鍼灸、推拿和拳操用於腦膠質瘤患者的康復。4.姑息性治療的內涵及基本原則姑息性治療又稱舒緩性治療,是給予生存期有限的患者(包括惡性腫瘤以及非腫瘤患者,如惡性腫瘤被確診爲晚期時、慢性充血性心力衰竭晚期、慢性阻塞性肺疾病末期等)及家屬全面的綜合治療和照護,盡力保障終末期患者的生存質量,同時也幫助其家屬渡過這一艱難時期的治療形式。姑息性治療的主要目的不是延長生命或治癒疾病,而是減輕患者症狀,維持或改善其功能和生活質量。世界衛生組織指出,姑息性治療“應在疾病早期,與其他旨在延長生命的療法結合使用”。由於大多數腦膠質瘤患者無法治癒,因此姑息性治療在這一患者羣體中顯得尤爲重要,特別是在生命終末期階段。根據歐洲神經腫瘤協會在2017年發佈的膠質瘤患者姑息性治療指南,生命終末期被定義爲臨終前的最後3個月。
(1)以患者爲中心;
(2)關注患者的意願、舒適和尊嚴;
(4)接受不可避免的死亡;
(5)不加速也不延緩死亡。
4.4.7.4 5.姑息性治療過程中的症狀管理
症狀控制是姑息性治療的基礎和核心內容。減輕症狀,儘可能讓患者保持身體上的舒適,是在心理、社會等其他層面對患者進行照顧的基礎。膠質瘤患者根據疾病性質、部位、治療等的不同,其臨牀症狀也具有較強的個體差異。其中頭痛、癲癇、靜脈血栓、疲勞、情緒和行爲障礙是常見的問題。對症處理是幫助終末期患者的第一步,對症處理的方案需要隨患者病情變化不斷調整,直至達到最佳效果。在疾病的終末期,要尤其重視以下幾點:
(2)營養與呼吸支持;
(3)預立治療規劃;
(4)醫患溝通與組織工作。
4.5 五、MDT
膠質瘤MDT是根據不同膠質瘤患者的疾病狀況和各方面的實際情況,由多個相關學科專業人員共同討論,綜合不同學科的專業意見,作出診斷並制定治療方案,定期進行療效評估,根據評估結果不斷調整診療方案,以期取得最佳療效的一種診療模式,旨在爲膠質瘤患者提供個體化、綜合性的診療服務146。腦膠質瘤MDT的目標是整合神經腫瘤相關多學科優勢,以患者爲中心,提供一站式醫療服務,實現最佳序貫治療。
MDT組織形式包括MDT病例討論會和MDT聯合門診等形式126,197。
MDT可爲腦膠質瘤患者帶來諸多獲益:
②MDT的實施可提高患者進入臨牀試驗的可能性;
③實施MDT可改善患者預後;
④MDT有助於臨牀試驗和科研的開展。
MDT同時也爲醫療團隊帶來諸多益處:
①提高了醫療團隊成員之間的溝通,增加了團隊成員的學習和受教育機會;
②實施MDT時團隊成員共享決策,更易獲得最佳實踐和循證醫學的建議;
③MDT臨牀決策制定和治療實施責任由成員們共同承擔,可降低團隊成員工作壓力,減少醫療糾紛;
④MDT還有利於科研工作的開展,提高醫療單位的學術水平。
MDT由相關專科醫師和專業人員組成。推薦根據疾病診治的不同階段,以關鍵臨牀問題爲導向,組織腦膠質瘤MDT成員實施。核心臨牀專業包括神經外科、醫學影像、神經病理和分子病理、放射腫瘤學、神經腫瘤、神經內科。其他可選專業包括感染科、血液科、內分泌科、神經心理、神經康復、臨牀護理、生物樣本庫、姑息治療等。
MDT的組織機構包括:
①召集人(首席專家):由權威專家擔任,對MDT項目全權負責;
②各科專家:專家一般應具有副高職稱或高年資主治醫師以上資格,有良好的神經腫瘤診治基礎並熱心從事該事業;專家定期參與MDT討論,並負責提供病例,準備資料等;
③記錄員:全程記錄MDT,統計MDT病例的臨牀資料;
⑤MDT委員會:可考慮成立MDT委員會,制定MDT制度並監督MDT執行。MDT應根據亟待解決關鍵臨牀問題,設定每一期病例討論會的召集人(首席專家)。召集人一般由患者的臨牀主診科室的權威專家擔任,主持並全程參與討論。
對初次診治患者,MDT實施路徑包括討論診斷及鑑別診斷,擬診腦膠質瘤後決策是否手術及手術方式。對術後患者,獲取組織標本,經過組織病理診斷和分子檢測最終獲得準確的整合病理報告,明確診斷腦膠質瘤,則討論下一步治療方案。如病理存疑,則討論下一步措施(如轉入其他相關科室治療或觀察)。在治療及隨訪過程中,如有需要可再次提請MDT討論,調整治療方案,對可疑復發患者,需要討論病變性質(如治療反應、腫瘤進展)及下一步醫療措施。復發腦膠質瘤常規治療無效且需要納入新型藥物臨牀試驗的病例,建議進行MDT討論。MDT應得到所屬醫院管理部門支持,並建立臨牀數據管理和療效反饋制度。
4.6 六、附錄
4.6.1 附錄一 證據等級(牛津循證醫學中心2011版)

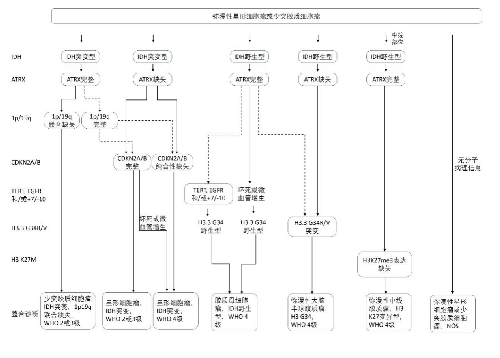
4.6.2 附圖1 腦膠質瘤整合病理診斷流程圖
4.6.3 附圖2 腦膠質瘤臨牀綜合診療流程與推薦證據級別

備註:RT,radiotherapy;PCV,procarbazine,lomustineandvincristineregimen;TMZ,temozolomide;BSC,bestsupportivecare;HFRT,hypofractionatedradiotherapy;KPS,Karnofskyperformancestatus;TTF,tumor-treatingfields.
4.6.4 附件3 腦膠質瘤診療指南(2022年版)編寫審定專家組
組長:江濤
副組長:萬經海、邱曉光、毛穎、馬文斌、蔣傳路、尤永平、康德智、李維平、康春生、李文斌、劉雲會、毛慶、屈延、王偉民、王磊、楊學軍、於如同、餘新光、牟永告、魏新亭、張劍寧成員:艾琳、陳凌、陳謙學、陳禮剛、竇長武、戴宜武、費舟、馮華、豐玉功、洪濤、胡飛、吉宏明、季楠、黃瑋、計穎、李剛、李桂林、李良、李少武、李蘊潛、林志雄、劉獻志、劉豔輝、劉志雄、羅林、呂中強、呂聖青、牛朝詩、潘亞文、龐琦、漆松濤、秦智勇、盛曉芳、陶榮傑、施煒、張俊平、王磊、王睴、王茂德、王曉光、吳勁松、吳安華、張建民、張志文、張忠、張偉、趙剛共同執筆:張偉、樊星、李守巍、劉幸、李博、劉彥偉、陳寶師、柴睿超、陳緒珠、王政、李冠璋、王引言
5 參考文獻
[1] LOUIS D N, PERRY A, WESSELING P, et al. The 2021 WHO Classification of Tumors of theCentral Nervous System: a summary [J]. Neuro Oncol, 2021, 23(8): 1231-51.
[2] JIANG T, MAO Y, MA W, et al. CGCG clinical practice guidelines for the management of adult diffuse gliomas [J]. Cancer Lett, 2016, 375(2): 263-73.
[3] JIANG T, NAM D H, RAM Z, et al. Clinical practice guidelines for the management of adult diffuse gliomas [J]. Cancer Lett, 2021, 499: 60-72.
[4] DUNET V, POMONI A, HOTTINGER A, et al. Performance of 18F-FET versus 18F-FDG-PET for the diagnosis and grading of brain tumors: systematic review and meta-analysis [J]. Neuro Oncol, 2016, 18(3): 426-34.
[5] PAFUNDI D H, LAACK N N, YOULAND R S, et al. Biopsy validation of 18F-DOPA PET andbiodistribution in gliomas for neurosurgical planning and radiotherapy target delineation: results of a prospective pilot study [J]. Neuro Oncol, 2013, 15(8): 1058-67.
[6] WELLER M, VAN DEN BENT M, HOPKINS K, et al. EANO guideline for the diagnosis andtreatment of anaplastic gliomas and glioblastoma [J]. Lancet Oncol, 2014, 15(9): e395-403.
[7] WEBER D C, CASANOVA N, ZILLI T, et al. Recurrence pattern after [(18)F]fluoroethyltyrosine-positron emission tomography-guided radiotherapy for high-grade glioma: a prospective study [J]. Radiother Oncol, 2009, 93(3): 586-92.
[8] MIWA K, MATSUO M, OGAWA S, et al. Re-irradiation of recurrent glioblastomamultiforme using 11C-methionine PET/CT/MRI image fusion for hypofractionatedstereotactic radiotherapy by intensity modulated radiation therapy [J]. Radiat Oncol, 2014, 9: 181.
[9] TRALINS K S, DOUGLAS J G, STELZER K J, et al. Volumetric analysis of 18F-FDGPET inglioblastoma multiforme: prognostic information and possible role in definition of target volumes in radiation dose escalation [J]. J Nucl Med, 2002, 43(12): 1667-73.
[10] MANABE O, HATTORI N, YAMAGUCHI S, et al. Oligodendroglial component complicates the prediction of tumour grading with metabolic imaging [J]. Eur J Nucl Med Mol Imaging, 2015, 42(6): 896-904.
[11] JANSEN N L, SCHWARTZ C, GRAUTE V, et al. Prediction of oligodendroglial histologyand LOH 1p/19q using dynamic [(18)F]FET-PET imaging in intracranial WHOgradeII and III gliomas [J]. Neuro Oncol, 2012, 14(12): 1473-80.
[12] HUTTERER M, NOWOSIELSKI M, PUTZER D, et al. [18F]-fluoro-ethyl-L-tyrosine PET: avaluable diagnostic tool in neuro-oncology, but not all that glitters is glioma [J]. NeuroOncol, 2013, 15(3): 341-51.
[13] RAPP M, HEINZEL A, GALLDIKS N, et al. Diagnostic performance of 18F-FET PET innewly diagnosed cerebral lesions suggestive of glioma [J]. J Nucl Med, 2013, 54(2): 229-35.
[14] WEN P Y, MACDONALD D R, REARDON D A, et al. Updated response assessment criteria for high-grade gliomas: response assessment in neuro-oncology working group[J]. J Clin Oncol, 2010, 28(11): 1963-72.
[15] BRANDES A A, TOSONI A, FRANCESCHI E, et al. Recurrence pattern after temozolomideconcomitant with and adjuvant to radiotherapy in newly diagnosed patients with glioblastoma: correlation With MGMT promoter methylation status [J]. J Clin Oncol, 2009, 27(8): 1275-9.
[16] WALTER F, CLOUGHESY T, WALTER M A, et al. Impact of 3,4-dihydroxy-6-18F-fluoroL-phenylalanine PET/CT on managing patients with brain tumors: the referringphysician's perspective [J]. J Nucl Med, 2012, 53(3): 393-8.
[17] HERRMANN K, CZERNIN J, CLOUGHESY T, et al. Comparison of visual andsemiquantitative analysis of 18F-FDOPA-PET/CT for recurrence detection inglioblastoma patients [J]. Neuro Oncol, 2014, 16(4): 603-9.
[18] ALBERT N L, WELLER M, SUCHORSKA B, et al. Response Assessment in Neuro-Oncologyworking group and European Association for Neuro-Oncology recommendations for the clinical use of PET imaging in gliomas [J]. Neuro Oncol, 2016, 18(9): 1199-208.
[19] WELLER M, PFISTER S M, WICK W, et al. Molecular neuro-oncology in clinical practice: anew horizon [J]. Lancet Oncol, 2013, 14(9): e370-9.
[20] ECKEL-PASSOW J E, LACHANCE D H, MOLINARO A M, et al. Glioma Groups Basedon1p/19q, IDH, and TERT Promoter Mutations in Tumors [J]. N Engl J Med, 2015, 372(26): 2499-508.
[21] CANCER GENOME ATLAS RESEARCH N, BRAT D J, VERHAAK R G, et al. Comprehensive, Integrative Genomic Analysis of Diffuse Lower-Grade Gliomas [J]. N Engl J Med, 2015, 372(26): 2481-98.
[22] HU H, MU Q, BAO Z, et al. Mutational Landscape of Secondary Glioblastoma Guides MET-Targeted Trial in Brain Tumor [J]. Cell, 2018, 175(6): 1665-78 e18.
[23] 李飛, 時雨, 姚小紅, 等. 2021 年世界衛生組織中樞神經系統腫瘤分類(第五版)侷限性星形細胞膠質瘤分類解讀 [J]. 中國現代神經疾病雜誌, 2021, 21(09): 804-8.
[24] DUFFAU H. Is supratotal resection of glioblastoma in noneloquent areas possible? [J]. World Neurosurg, 2014, 82(1-2): e101-3.
[25] WU J S, GONG X, SONG Y Y, et al. 3.0-T intraoperative magnetic resonance imaging-guided resection in cerebral glioma surgery: interim analysis of a prospective, randomized, triple-blind, parallel-controlled trial [J]. Neurosurgery, 2014, 61 Suppl 1: 145-54.
[26] BELLO L, GAMBINI A, CASTELLANO A, et al. Motor and language DTI Fiber Trackingcombined with intraoperative subcortical mapping for surgical removal of gliomas [J]. Neuroimage, 2008, 39(1): 369-82.
[27] STUMMER W, PICHLMEIER U, MEINEL T, et al. Fluorescence-guided surgery with5-aminolevulinic acid for resection of malignant glioma: a randomised controlledmulticentre phase III trial [J]. Lancet Oncol, 2006, 7(5): 392-401.
[28] ZINN P O, COLEN R R, KASPER E M, et al. Extent of resection and radiotherapy in GBM: A 1973 to 2007 surveillance, epidemiology and end results analysis of 21,783 patients [J]. Int J Oncol, 2013, 42(3): 929-34.
[29] KRETH F W, THON N, SIMON M, et al. Gross total but not incomplete resectionof glioblastoma prolongs survival in the era of radiochemotherapy [J]. Ann Oncol, 2013, 24(12): 3117-23.
[30] LAWS E R, PARNEY I F, HUANG W, et al. Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project [J]. J Neurosurg, 2003, 99(3): 467-73.
[31] SANAI N, POLLEY M Y, MCDERMOTT M W, et al. An extent of resection thresholdfor newly diagnosed glioblastomas [J]. J Neurosurg, 2011, 115(1): 3-8.
[32] MCGIRT M J, CHAICHANA K L, ATTENELLO F J, et al. Extent of surgical resectionis independently associated with survival in patients with hemispheric infiltrating low-grade gliomas [J]. Neurosurgery, 2008, 63(4): 700-7; author reply 7-8.
[33] 中國腦膠質瘤協作組(CGCG). 成人幕上低級別膠質瘤的手術治療指南[J]. 中華神經外科雜誌, 2016, 32(07): 652-8.
[34] MONTEMURRO N, PERRINI P, BLANCO M O, et al. Second surgery for recurrent glioblastoma: A concise overview of the current literature [J]. Clin Neurol Neurosurg, 2016, 142: 60-4.
[35] ROBIN A M, LEE I, KALKANIS S N. Reoperation for Recurrent Glioblastoma Multiforme [J]. Neurosurg Clin N Am, 2017, 28(3): 407-28.
[36] CHANG E F, CLARK A, SMITH J S, et al. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain: improvement of long-termsurvival. Clinical article [J]. J Neurosurg, 2011, 114(3): 566-73.
[37] 江濤, 王引言, 方晟宇. 全面解析運動功能網絡的拓撲性質與保護機制[J]. 中華神經外科雜誌, 2020, (02): 109-10-11.
[38] 張忠, 江濤, 謝堅, 等. 喚醒麻醉和術中功能定位切除語言區膠質瘤[J]. 中華神經外科雜誌, 2007, 23(09): 643-5.
[39] 張忠, 江濤, 謝堅, 等. 術中功能定位切除輔助運動區低級別膠質瘤[J]. 中華神經外科雜誌, 2008, (01): 35-8.
[40] 白紅民, 江濤, 王偉民, 等. 類別特異性命名區腦定位的臨牀研究 [J]. 中華神經外科雜誌, 2010, (12): 1067-70.
[41] YORDANOVA Y N, MORITZ-GASSER S, DUFFAU H. Awake surgery for WHOGradeII
gliomas within "noneloquent" areas in the left dominant hemisphere: towarda"supratotal" resection. Clinical article [J]. J Neurosurg, 2011, 115(2): 232-9.
[42] WANG X, WANG Y Y, JIANG T, et al. Direct evidence of the left caudate's role in bilingual control: an intra-operative electrical stimulation study [J]. Neurocase, 2013, 19(5): 462-9.
[43] HERVEY-JUMPER S L, LI J, LAU D, et al. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period [J]. J Neurosurg, 2015, 123(2): 325-39.
[44] JINGSHAN L, SHENGYU F, XING F, et al. Morphometry of the Hand Knob Region andMotor Function Change in Eloquent Area Glioma Patients [J]. Clin Neuroradiol, 2019, 29(2): 243-51.
[45] MOLLER M, FREUND M, GREINER C, et al. Real time fMRI: a tool for the routinepresurgical localisation of the motor cortex [J]. Eur Radiol, 2005, 15(2): 292-5.
[46] XIE J, CHEN X Z, JIANG T, et al. Preoperative blood oxygen level-dependent functional magnetic resonance imaging in patients with gliomas involving the motor cortical areas [J]. Chin Med J (Engl), 2008, 121(7): 631-5.
[47] FANG S, LIANG J, QIAN T, et al. Anatomic Location of Tumor Predicts the Accuracy of Motor Function Localization in Diffuse Lower-Grade Gliomas Involving the Hand KnobArea [J]. AJNR Am J Neuroradiol, 2017, 38(10): 1990-7.
[48] FANG S, BAI H X, FAN X, et al. A Novel Sequence: ZOOMit-Blood Oxygen Level-Dependent for Motor-Cortex Localization [J]. Neurosurgery, 2020, 86(2): E124-E32.
[49] HALL W A, LIU H, TRUWIT C L. Functional magnetic resonance imaging-guidedresection of low-grade gliomas [J]. Surg Neurol, 2005, 64(1): 20-7; discussion 7.
[50] QIU T M, YAN C G, TANG W J, et al. Localizing hand motor area using resting-state fMRI: validated with direct cortical stimulation [J]. Acta Neurochir (Wien), 2014, 156(12): 2295-302.
[51] GUNNARSSON T, OLAFSSON E, SIGHVATSSON V, et al. Surgical treatment of patients with low-grade astrocytomas and medically intractable seizures [J]. Acta Neurol Scand, 2002, 105(4): 289-92.
[52] FISHER R S, CROSS J H, D'SOUZA C, et al. Instruction manual for the ILAE 2017operational classification of seizure types [J]. Epilepsia, 2017, 58(4): 531-42.
[53] SCHEFFER I E, BERKOVIC S, CAPOVILLA G, et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology [J]. Epilepsia, 2017, 58(4): 512-21.
[54] LIANG S, FAN X, ZHAO M, et al. Clinical practice guidelines for the diagnosis andtreatment of adult diffuse glioma-related epilepsy [J]. Cancer Med, 2019, 8(10): 4527-35.
[55] 喚醒狀態下切除腦功能區膠質瘤手術技術指南(2018 版) [J]. 中國微侵襲神經外科雜誌, 2018, 23(08): 383-8.
[56] DU G, ZHOU L, MAO Y. Neuronavigator-guided glioma surgery [J]. Chin Med J (Engl), 2003, 116(10): 1484-7.
[57] 吳勁松, 毛穎, 姚成軍, 等. 術中磁共振影像神經導航治療腦膠質瘤的臨牀初步應用(附61例分析) [J]. 中國微侵襲神經外科雜誌, 2007, (03): 105-9.
[58] BELLO L, GALLUCCI M, FAVA M, et al. Intraoperative subcortical language tract mappingguides surgical removal of gliomas involving speech areas [J]. Neurosurgery, 2007, 60(1): 67-80; discussion -2.
[59] DUFFAU H. Surgery of low-grade gliomas: towards a 'functional neurooncology' [J]. Curr Opin Oncol, 2009, 21(6): 543-9.
[60] KIM S S, MCCUTCHEON I E, SUKI D, et al. Awake craniotomy for brain tumors near eloquent cortex: correlation of intraoperative cortical mapping with neurological outcomes in 309 consecutive patients [J]. Neurosurgery, 2009, 64(5): 836-45; discussion345-6.
[61] DE BENEDICTIS A, MORITZ-GASSER S, DUFFAU H. Awake mapping optimizes the extent of resection for low-grade gliomas in eloquent areas [J]. Neurosurgery, 2010, 66(6):1074-84; discussion 84.
[62] TALACCHI A, TURAZZI S, LOCATELLI F, et al. Surgical treatment of high-grade gliomas in motor areas. The impact of different supportive technologies: a 171-patient series [J]. J Neurooncol, 2010, 100(3): 417-26.
[63] TATE M C, HERBET G, MORITZ-GASSER S, et al. Probabilistic map of critical functional regions of the human cerebral cortex: Broca's area revisited [J]. Brain, 2014, 137(Pt 10): 2773-82.
[64] DUFFAU H, CAPELLE L, SICHEZ N, et al. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study [J]. Brain, 2002, 125(Pt 1): 199-214.
[65] ROUX F E, DUFOR O, LAUWERS-CANCES V, et al. Electrostimulation mapping of spatial neglect [J]. Neurosurgery, 2011, 69(6): 1218-31.
[66] MAGILL S T, HAN S J, LI J, et al. Resection of primary motor cortex tumors: feasibility andsurgical outcomes [J]. J Neurosurg, 2018, 129(4): 961-72.
[67] SANAI N, BERGER M S. Glioma extent of resection and its impact on patient outcome [J]. Neurosurgery, 2008, 62(4): 753-64; discussion 264-6.
[68] ZHANG Z, JIANG T, XIE J, et al. Surgical strategies for glioma involving language areas [J]. Chin Med J (Engl), 2008, 121(18): 1800-5.
[69] LIMA G L O, DEZAMIS E, CORNS R, et al. Surgical resection of incidental diffuse gliomas involving eloquent brain areas. Rationale, functional, epileptological and oncological outcomes [J]. Neurochirurgie, 2017, 63(3): 250-8.
[70] JIANG B, CHAICHANA K, VEERAVAGU A, et al. Biopsy versus resection for themanagement of low-grade gliomas [J]. Cochrane Database Syst Rev, 2017, 4: CD009319.
[71] SHAN X, FAN X, LIU X, et al. Clinical characteristics associated with postoperative seizurecontrol in adult low-grade gliomas: a systematic review and meta-analysis [J]. NeuroOncol, 2018, 20(3): 324-31.
[72] ENGLOT D J, HAN S J, BERGER M S, et al. Extent of surgical resection predicts seizurefreedom in low-grade temporal lobe brain tumors [J]. Neurosurgery, 2012, 70(4): 921-8; discussion 8.
[73] YOU G, SHA Z Y, YAN W, et al. Seizure characteristics and outcomes in 508 Chineseadult patients undergoing primary resection of low-grade gliomas: a clinicopathological study [J]. Neuro Oncol, 2012, 14(2): 230-41.
[74] WANG Y Y, ZHANG T, LI S W, et al. Mapping p53 mutations in low-grade glioma: avoxel-based neuroimaging analysis [J]. AJNR Am J Neuroradiol, 2015, 36(1): 70-6.
[75] ZAATREH M M, SPENCER D D, THOMPSON J L, et al. Frontal lobe tumoral epilepsy: clinical, neurophysiologic features and predictors of surgical outcome [J]. Epilepsia, 2002, 43(7): 727-33.
[76] YAO P S, ZHENG S F, WANG F, et al. Surgery guided with intraoperativeelectrocorticography in patients with low-grade glioma and refractory seizures [J]. J Neurosurg, 2018, 128(3): 840-5.
[77] PEREIRA L C, OLIVEIRA K M, L'ABBATE G L, et al. Outcome of fully awake craniotomy for lesions near the eloquent cortex: analysis of a prospective surgical series of 79supratentorial primary brain tumors with long follow-up [J]. Acta Neurochir (Wien), 2009, 151(10): 1215-30.
[78] LIMA G L, DUFFAU H. Is there a risk of seizures in "preventive" awake surgery for incidental diffuse low-grade gliomas? [J]. J Neurosurg, 2015, 122(6): 1397-405.
[79] BOETTO J, BERTRAM L, MOULINIE G, et al. Low Rate of Intraoperative Seizures DuringAwake Craniotomy in a Prospective Cohort with 374 Supratentorial Brain Lesions: Electrocorticography Is Not Mandatory [J]. World Neurosurg, 2015, 84(6): 1838-44.
[80] VECHT C J, KERKHOF M, DURAN-PENA A. Seizure prognosis in brain tumors: newinsights and evidence-based management [J]. Oncologist, 2014, 19(7): 751-9.
[81] DI BONAVENTURA C, ALBINI M, D'ELIA A, et al. Epileptic seizures heralding a relapse inhigh grade gliomas [J]. Seizure, 2017, 51: 157-62.
[82] KAHLENBERG C A, FADUL C E, ROBERTS D W, et al. Seizure prognosis of patients withlow-grade tumors [J]. Seizure, 2012, 21(7): 540-5.
[83] SUN M Z, OH T, IVAN M E, et al. Survival impact of time to initiationof chemoradiotherapy after resection of newly diagnosed glioblastoma [J]. J Neurosurg, 2015, 122(5): 1144-50.
[84] MERCHANT T E, KUN L E, WU S, et al. Phase II trial of conformal radiation therapy for pediatric low-grade glioma [J]. J Clin Oncol, 2009, 27(22): 3598-604.
[85] CABRERA A R, KIRKPATRICK J P, FIVEASH J B, et al. Radiation therapy for glioblastoma: Executive summary of an American Society for Radiation Oncology Evidence-BasedClinical Practice Guideline [J]. Pract Radiat Oncol, 2016, 6(4): 217-25.
[86] CHANG E L, AKYUREK S, AVALOS T, et al. Evaluation of peritumoral edema in thedelineation of radiotherapy clinical target volumes for glioblastoma [J]. Int J Radiat Oncol Biol Phys, 2007, 68(1): 144-50.
[87] GILBERT M R, WANG M, ALDAPE K D, et al. Dose-dense temozolomide for newlydiagnosed glioblastoma: a randomized phase III clinical trial [J]. J Clin Oncol, 2013, 31(32): 4085-91.
[88] STUPP R, MASON W P, VAN DEN BENT M J, et al. Radiotherapy plus concomitant andadjuvant temozolomide for glioblastoma [J]. N Engl J Med, 2005, 352(10): 987-96.
[89] HEGI M E, DISERENS A C, GORLIA T, et al. MGMT gene silencing and benefit fromtemozolomide in glioblastoma [J]. N Engl J Med, 2005, 352(10): 997-1003.
[90] VAN DEN BENT M J, BRANDES A A, TAPHOORN M J, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951 [J]. J Clin Oncol, 2013, 31(3): 344-50.
[91] CAIRNCROSS G, WANG M, SHAW E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402 [J]. J Clin Oncol, 2013, 31(3): 337-43.
[92] INTERGROUP RADIATION THERAPY ONCOLOGY GROUP T, CAIRNCROSS G, BERKEYB, et al. Phase III trial of chemotherapy plus radiotherapy compared with radiotherapyalone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation TherapyOncology Group Trial 9402 [J]. J Clin Oncol, 2006, 24(18): 2707-14.
[93] YANG P, CAI J, YAN W, et al. Classification based on mutations of TERT promoter andIDH characterizes subtypes in grade II/III gliomas [J]. Neuro Oncol, 2016, 18(8): 1099-108.
[94] DANIELS T B, BROWN P D, FELTEN S J, et al. Validation of EORTC prognostic factors for adults with low-grade glioma: a report using intergroup 86-72-51 [J]. Int J Radiat Oncol Biol Phys, 2011, 81(1): 218-24.
[95] NABORS L B, PORTNOW J, AMMIRATI M, et al. NCCN Guidelines Insights: Central
Nervous System Cancers, Version 1.2017 [J]. J Natl Compr Canc Netw, 2017, 15(11): 1331-45.
[96] SHAW E G, BERKEY B, COONS S W, et al. Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial low-grade glioma: results of aprospective clinical trial [J]. J Neurosurg, 2008, 109(5): 835-41.
[97] SHAW E, ARUSELL R, SCHEITHAUER B, et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/EasternCooperative Oncology Group study [J]. J Clin Oncol, 2002, 20(9): 2267-76.
[98] LIU Y, LI Y, WANG P, et al. High-dose radiotherapy in newly diagnosed low-gradegliomas with nonmethylated O(6)-methylguanine-DNA methyltransferase [J]. Radiat Oncol, 2021, 16(1): 157.
[99] LIU Y, LIU S, LI G, et al. Association of high-dose radiotherapy with improved survival inpatients with newly diagnosed low-grade gliomas [J]. Cancer, 2021.
[100] KLEIN M, HEIMANS J J, AARONSON N K, et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-gradegliomas: a comparative study [J]. Lancet, 2002, 360(9343): 1361-8.
[101] RODRIGUEZ D, CHEUNG M C, HOUSRI N, et al. Outcomes of malignant CNSependymomas: an examination of 2408 cases through the Surveillance, Epidemiology, and End Results (SEER) database (1973-2005) [J]. J Surg Res, 2009, 156(2): 340-51.
[102] MERCHANT T E, LI C, XIONG X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study [J]. Lancet Oncol, 2009, 10(3): 258-66.
[103] 周良輔, 毛穎, 王任直. 中國中樞神經系統膠質瘤診斷與治療指南(2015) [J]. 中華醫學雜誌, 2016, 96(07): 485-509.
[104] FOGH S E, ANDREWS D W, GLASS J, et al. Hypofractionated stereotactic radiationtherapy: an effective therapy for recurrent high-grade gliomas [J]. J Clin Oncol, 2010, 28(18): 3048-53.
[105] CABRERA A R, CUNEO K C, DESJARDINS A, et al. Concurrent stereotactic radiosurgeryand bevacizumab in recurrent malignant gliomas: a prospective trial [J]. Int J Radiat Oncol Biol Phys, 2013, 86(5): 873-9.
[106] LAWRENCE Y R, LI X A, EL NAQA I, et al. Radiation dose-volume effects in the brain[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S20-7.
[107] BOOTHE D, YOUNG R, YAMADA Y, et al. Bevacizumab as a treatment for radiationnecrosis of brain metastases post stereotactic radiosurgery [J]. Neuro Oncol, 2013, 15(9): 1257-63.
[108] MINNITI G, AGOLLI L, FALCO T, et al. Hypofractionated stereotactic radiotherapy incombination with bevacizumab or fotemustine for patients with progressive malignant gliomas [J]. J Neurooncol, 2015, 122(3): 559-66.
[109] DOUW L, KLEIN M, FAGEL S S, et al. Cognitive and radiological effects of radiotherapy inpatients with low-grade glioma: long-term follow-up [J]. Lancet Neurol, 2009, 8(9): 810-8.
[110] POSTMA T J, KLEIN M, VERSTAPPEN C C, et al. Radiotherapy-induced cerebral abnormalities in patients with low-grade glioma [J]. Neurology, 2002, 59(1): 121-3.
[111] STUPP R, HEGI M E, MASON W P, et al. Effects of radiotherapy with concomitant andadjuvant temozolomide versus radiotherapy alone on survival in glioblastoma inarandomised phase III study: 5-year analysis of the EORTC-NCIC trial [J]. Lancet Oncol, 2009, 10(5): 459-66.
[112] WOLFF J E, BERRAK S, KOONTZ WEBB S E, et al. Nitrosourea efficacy in high-gradeglioma: a survival gain analysis summarizing 504 cohorts with 24193 patients [J]. J Neurooncol, 2008, 88(1): 57-63.
[113] VAN DEN BENT M J, BAUMERT B, ERRIDGE S C, et al. Interim results fromthe CATNONtrial (EORTC study 26053-22054) of treatment with concurrent and adjuvant
temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study [J]. Lancet, 2017, 390(10103): 1645-53.
[114] VAN DEN BENT M J, TESILEANU C M S, WICK W, et al. Adjuvant and concurrent temozolomide for 1p/19q non-co-deleted anaplastic glioma (CATNON; EORTCstudy26053-22054): second interim analysis of a randomised, open-label, phase 3 study [J]. Lancet Oncol, 2021, 22(6): 813-23.
[115] MALMSTROM A, GRONBERG B H, MAROSI C, et al. Temozolomide versus standard6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial [J]. Lancet Oncol, 2012, 13(9): 916-26.
[116] HERRLINGER U, TZARIDIS T, MACK F, et al. Lomustine-temozolomide combinationtherapy versus standard temozolomide therapy in patients with newly diagnosedglioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, openlabel, phase 3 trial [J]. Lancet, 2019, 393(10172): 678-88.
[117] BELL E H, ZHANG P, SHAW E G, et al. Comprehensive Genomic Analysis in NRGOncology/RTOG 9802: A Phase III Trial of Radiation Versus Radiation Plus Procarbazine, Lomustine (CCNU), and Vincristine in High-Risk Low-Grade Glioma [J]. J Clin Oncol, 2020, 38(29): 3407-17.
[118] FISHER B J, PUGH S L, MACDONALD D R, et al. Phase 2 Study of a Temozolomide-Based Chemoradiation Therapy Regimen for High-Risk, Low-Grade Gliomas: Long-TermResults of Radiation Therapy Oncology Group 0424 [J]. Int J Radiat Oncol Biol Phys, 2020, 107(4): 720-5.
[119] SHAW E G, WANG M, COONS S W, et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802 [J]. J Clin Oncol, 2012, 30(25): 3065-70.
[120] KESARI S, SCHIFF D, DRAPPATZ J, et al. Phase II study of protracted daily temozolomidefor low-grade gliomas in adults [J]. Clin Cancer Res, 2009, 15(1): 330-7.
[121] TRIEBELS V H, TAPHOORN M J, BRANDES A A, et al. Salvage PCV chemotherapy for temozolomide-resistant oligodendrogliomas [J]. Neurology, 2004, 63(5): 904-6.
[122] MASSIMINO M, SPREAFICO F, RIVA D, et al. A lower-dose, lower-toxicity cisplatin-etoposide regimen for childhood progressive low-grade glioma [J]. J Neurooncol, 2010, 100(1): 65-71.
[123] PERRY J R, BELANGER K, MASON W P, et al. Phase II trial of continuous dose-intensetemozolomide in recurrent malignant glioma: RESCUE study [J]. J Clin Oncol, 2010, 28(12): 2051-7.
[124] WICK W, PUDUVALLI V K, CHAMBERLAIN M C, et al. Phase III study of enzastaurincompared with lomustine in the treatment of recurrent intracranial glioblastoma [J]. J Clin Oncol, 2010, 28(7): 1168-74.
[125] NORDEN A D, YOUNG G S, SETAYESH K, et al. Bevacizumab for recurrent malignant gliomas: efficacy, toxicity, and patterns of recurrence [J]. Neurology, 2008, 70(10): 779-87.
[126] FULTON D, URTASUN R, FORSYTH P. Phase II study of prolonged oral therapy withetoposide (VP16) for patients with recurrent malignant glioma [J]. J Neurooncol, 1996, 27(2): 149-55.
[127] FRIEDMAN H S, PRADOS M D, WEN P Y, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma [J]. J Clin Oncol, 2009, 27(28): 4733-40.
[128] YUNG W K, ALBRIGHT R E, OLSON J, et al. A phase II study of temozolomide vs. procarbazine in patients with glioblastoma multiforme at first relapse [J]. Br J Cancer, 2000, 83(5): 588-93.
[129] LOMBARDI G, DE SALVO G L, BRANDES A A, et al. Regorafenib compared withlomustine in patients with relapsed glioblastoma (REGOMA): a multicentre, open-label, randomised, controlled, phase 2 trial [J]. Lancet Oncol, 2019, 20(1): 110-9.
[130] STUPP R, TAILLIBERT S, KANNER A A, et al. Maintenance Therapy With Tumor-TreatingFields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A RandomizedClinical Trial [J]. JAMA, 2015, 314(23): 2535-43.
[131] FERGUSON S D, XIU J, WEATHERS S P, et al. GBM-associated mutations and alteredprotein expression are more common in young patients [J]. Oncotarget, 2016, 7(43):69466-78.
[132] SRIVIDYA M R, THOTA B, ARIVAZHAGAN A, et al. Age-dependent prognostic effects of EGFR/p53 alterations in glioblastoma: study on a prospective cohort of 140 uniformlytreated adult patients [J]. J Clin Pathol, 2010, 63(8): 687-91.
[133] VUORINEN V, HINKKA S, FARKKILA M, et al. Debulking or biopsy of malignant glioma inelderly people - a randomised study [J]. Acta Neurochir (Wien), 2003, 145(1): 5-10.
[134] ALMENAWER S A, BADHIWALA J H, ALHAZZANI W, et al. Biopsy versus partial versus gross total resection in older patients with high-grade glioma: a systematic reviewandmeta-analysis [J]. Neuro Oncol, 2015, 17(6): 868-81.
[135] EXTERMANN M, HURRIA A. Comprehensive geriatric assessment for older patients withcancer [J]. J Clin Oncol, 2007, 25(14): 1824-31.
[136] PERRY J R, LAPERRIERE N, O'CALLAGHAN C J, et al. Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma [J]. N Engl J Med, 2017, 376(11): 1027-37.
[137] RINEER J, SCHREIBER D, CHOI K, et al. Characterization and outcomes of infratentorial malignant glioma: a population-based study using the Surveillance Epidemiology andEnd-Results database [J]. Radiother Oncol, 2010, 95(3): 321-6.
[138] SCHWARTZENTRUBER J, KORSHUNOV A, LIU X Y, et al. Driver mutations in histone H3.3and chromatin remodelling genes in paediatric glioblastoma [J]. Nature, 2012, 482(7384): 226-31.
[139] BECHET D, GIELEN G G, KORSHUNOV A, et al. Specific detection of methionine 27mutation in histone 3 variants (H3K27M) in fixed tissue from high-grade astrocytomas [J]. Acta Neuropathol, 2014, 128(5): 733-41.
[140] CARAI A, MASTRONUZZI A, DE BENEDICTIS A, et al. Robot-Assisted Stereotactic Biopsyof Diffuse Intrinsic Pontine Glioma: A Single-Center Experience [J]. World Neurosurg, 2017, 101: 584-8.
[141] HAMISCH C, KICKINGEREDER P, FISCHER M, et al. Update on the diagnostic value andsafety of stereotactic biopsy for pediatric brainstem tumors: a systematic reviewandmeta-analysis of 735 cases [J]. J Neurosurg Pediatr, 2017, 20(3): 261-8.
[142] COHEN K J, HEIDEMAN R L, ZHOU T, et al. Temozolomide in the treatment of childrenwith newly diagnosed diffuse intrinsic pontine gliomas: a report fromthe Children's Oncology Group [J]. Neuro Oncol, 2011, 13(4): 410-6.
[143] FLEISCHHACK G, MASSIMINO M, WARMUTH-METZ M, et al. Nimotuzumab andradiotherapy for treatment of newly diagnosed diffuse intrinsic pontine glioma (DIPG): aphase III clinical study [J]. J Neurooncol, 2019, 143(1): 107-13.
[144] PACE A, DIRVEN L, KOEKKOEK J A F, et al. European Association for Neuro-Oncology(EANO) guidelines for palliative care in adults with glioma [J]. Lancet Oncol, 2017, 18(6): e330-e40.
[145] 王引言, 方晟宇, 李連旺, 等. 重複經顱磁刺激治療腦膠質瘤術後運動功能障礙的臨牀分析(附五例報告) [J]. 中華神經外科雜誌, 2020, 36(05): 458-62.
[146] 膠質瘤多學科診治(MDT)中國專家共識 [J]. 中華神經外科雜誌, 2018, 34(02): 113-8.