3 概述
肌萎縮側索硬化(amyotrophic lateral sclerosis,ALS)在早先時期與運動神經元疾病具有完全等同的含義,特指先有下運動神經元損害,之後又有上運動神經元損害的一個獨立的疾病。但後來發現還有另外兩種變異情況,即病程中始終只累及上運動神經元或下運動神經元,前者稱爲原發性側索硬化,後者稱爲脊髓性肌萎縮。到目前爲止有些文獻仍沿用運動神經元病來專指肌萎縮側索硬化。
多數學者習慣根據上、下運動神經元受累的不同組合,將運動神經元病分爲肌萎縮側索硬化、原發性側索硬化和脊髓性肌萎縮三種類型。近年的研究提示肌萎縮側索硬化與多種相關疾病有共同的病理基礎,這些疾病包括原發性側索硬化、ALS -癡呆、ALS-相關性額葉癡呆、進行性脊髓性肌萎縮、多系統萎縮和lewy小體病。病理檢查發現這些疾病同樣含有泛素陽性包涵體和透明團塊包涵體,只是損傷了不同的解剖部位而出現各種各樣的臨牀組合。
肌萎縮側索硬化有家族性和散發性兩種類型,散發性以男性多見,男女之比約爲1.5∶1~2∶1。中年後起病,多數患者爲50~70 歲,平均發病年齡爲55 歲,40歲以下發病也有報告,20~30歲發病約佔5%。家族性ALS佔5%~10%,多爲常染色體顯性遺傳,男女發病率相等,發病年齡較早,平均爲49歲。
6 別名
MND;motor neuron disease;肌萎縮性側索硬化;肌萎縮性脊髓側索硬化;運動神經元病
9 流行病學
美國報告肌萎縮側索硬化的發病率(每年新發病例)爲2/10萬~4/10萬,患病率爲4/10萬~6/10萬。國內尚無確切的流行病學資料。
肌萎縮側索硬化有家族性和散發性兩種類型,散發性以男性多見,男女之比約爲1.5∶1~2∶1。中年後起病,多數患者爲50~70歲,平均發病年齡爲55歲,40歲以下發病也有報告,20~30歲發病約佔5%。
11 發病機制
肌萎縮側索硬化確切的發病機制至今尚未清楚。近年的研究主要集中在銅鋅超氧歧化酶基因突變學說、興奮性氨基酸毒性學說、自身免疫學說和神經營養因子學說。
11.1 銅鋅超氧歧化酶基因突變學說
研究表明,20%的家族性ALS有SODI(Cu/Zn過氧化物歧化酶)基因突變。該基因位於人類染色體21q22.1,其突變可致SODl活性喪失,使超氧化的解毒作用減弱,致自由基過量積聚,細胞損傷。一些散發性的ALS可能也存在2lq22位點的突變。
11.2 興奮性氨基酸毒性學說
興奮性氨基酸包括穀氨酸、天冬氨酸及其衍生物紅藻氨酸(KA)、使君子氨酸(QA)、鵝膏氨酸(IA)和N-甲基d-天冬氨酸(NMDA)。興奮性氨基酸的興奮毒性可能參與LIS的發病。穀氨酸與NMDA受體結合可致鈣內流,激活一系列蛋白酶和蛋白激酶,使蛋白質的分解和自由基的生成增加,脂質過氧化過程加強,神經元自行溶解。此外過量鈣還可激活核內切酶,使DNA裂解及核崩解。ALS的病變主要侷限在運動神經系統可能與穀氨酸的攝取系統有關。這個攝取系統位於神經膠質細胞及神經細胞的細胞膜,能迅速將突觸間隙的穀氨酸轉運到細胞內,終止其作用。研究發現ALS的皮質運動細胞、脊髓膠質細胞和脊髓灰質細胞的穀氨酸攝取系統減少。動物實驗研究也顯示小鼠鞘內注射KA及NMDA可致脊髓神經元變性。
11.3 自身免疫學說
肌萎縮側索硬化患者腦脊液和血清中抗神經元抗體的增加提示其發病可能與自身免疫有關。如存在於ALS患者血清中的L型電壓依賴性鈣通道抗體可與該通道蛋白結合,改變其電生理特性,造成神經元損傷。
12 病理改變
顯微鏡下觀察可見脊髓前角細胞減少,伴膠質細胞增生,殘存的前角細胞萎縮。大腦皮質的分層結構完整,錐體細胞減少伴膠質細胞增生。脊髓錐體束有脫髓鞘現象,而運動皮質神經元細胞完好,表明最初的改變產生於神經軸突的遠端,逐漸向上逆行累及大腦中央前回的錐體細胞,此種改變又稱爲逆行性死亡。一些生前僅有下運動神經元體徵的ALS患者,死後屍檢可見顯著的皮質脊髓束脫髓鞘改變,表明前角細胞功能受累嚴重,掩蓋了上運動神經元損害的體徵。還有一些臨牀表現典型的ALS,其病理改變類似於多系統變性,即有廣泛的脊髓結構損害,脊髓前角、錐體束、脊髓小腦後束、脊髓後索的神經根間區、Clarke核以及下丘腦、小腦齒狀核和紅核均有神經元細胞脫失和膠質細胞增生(Terao,1991)。
採用免疫組織化學染色方法可以在中樞神經系統的不同部位的神經細胞發現異常的泛素陽性包涵體(Arima,1998,Kinoshita etal,1997,張巍,2001)。
這些包涵體包括以下幾種類型:
(1)線團樣包涵體,電鏡下包涵體爲條索或管狀,通常帶有中央亮區爲嗜酸或兩染性。被一淡染暈區包繞,在HE染色中不易見到。
(2)透明包涵體,爲一種顆粒細絲包涵體。細絲直徑爲15~20nm,顆粒物質混於細絲間形成小絨球樣緻密結構,外周常有溶酶體樣小體及脂褐素等膜性結構包繞。
(3)路易體樣包涵體,爲一圓形包涵體,由不規則線樣結構與核糖體樣顆粒組成,中心爲無定形物質或顆粒樣電子緻密物,這些物質包埋於18nm細絲中,排列緊密或鬆散,外周有濃染的環,類似路易體。
(4)Bunina小體,是ALS較具有特異性的病理改變。這些包涵體主要分佈於脊髓的前角細胞和腦幹運動核神經細胞,也可以出現在部分運動神經元病患者的海馬顆粒細胞和錐體細胞、齒狀回、嗅皮質、杏仁核、Onuf核、額顳葉表層小神經元和大錐體細胞胞質中(Arima,1998,Kinoshitaetal,1997)。
13 肌萎縮側索硬化的臨牀表現
1.肌萎縮側索硬化起病隱匿,緩慢進展。
2.半數患者首發症狀爲肢體無力伴肌萎縮(5%)和肌束顫動(4%),上肢遠端尤其突出。此時四肢腱反射減低,無錐體束徵,臨牀表現類似於脊髓性肌萎縮。
3.隨着病情的發展患者逐漸出現典型的上下運動神經元損害的體徵,表現爲廣泛而嚴重的肌肉萎縮,肌張力增高,錐體束徵陽性。60%的患者具有明顯的上下運動神經元體徵。當下運動神經元變性達到一定程度時,肌肉廣泛失神經,此時可無肌束顫動,腱反射減低或消失,也無病理徵。
4.約有10%的患者在整個病程中僅表現爲進行性的肌肉萎縮而無上運動神經元損害的體徵。
5.約30%的患者以腦幹的運動神經核受累起病,表現爲吞嚥困難、構音不清、呼吸困難、舌肌萎縮和纖顫,以後逐漸累及四肢和軀幹。情緒不穩定(強哭強笑)是上運動神經元受累及假性延髓性麻痹的徵象。
6.以脊髓側索受累爲首發症狀的肌萎縮側索硬化罕見。9%的患者可有痛性痙攣,後者是上運動神經元損害的表現,多在受累的下肢近端出現,常見於疾病的早期。10%的患者有主觀的肢體遠端感覺異常或麻木,除非合併其他周圍神經病,ALS無客觀的感覺體徵。整個病程中膀胱和直腸功能保持良好,眼球運動通常不受損害。
7.單純的肌萎縮側索硬化患者一般沒有智力減退。肌萎縮側索硬化伴有其他神經系統變性疾病的症狀和體徵時,稱ALS疊加綜合徵(ALS-plus syndrome)。該綜合徵主要發生在西太平洋地區、日本的關島和北非等地區。合併的症狀和體徵包括錐體外系症狀、小腦變性、癡呆、自主神經和感覺系統症狀以及眼球運動異常。
8.神經肌肉電生理改變 主要表現爲廣泛的神經源性損害。急性神經源性損害(失神經後2~3周)的特徵爲纖顫電位、正銳波、束顫電位和巨大電位,慢性失神經伴有再生時表現爲肌肉輕收縮時運動單位動作電位時限增寬、波幅明顯升高及多相波百分比上升,肌肉大力收縮時可見運動單位脫失現象。ALS的神經源性損害通常累及3個以上的區域(腦神經、頸、胸、腰骶神經支配區)。舌肌、胸鎖乳突肌和膈肌也可表現爲神經源性損害,後者因爲在頸椎病中較少受累,因而可資對兩者進行鑑別(康德暄,1994)。MCV可有輕度減慢,誘發電位波幅下降。感覺傳導速度多正常。
磁刺激運動誘發電位:經顱刺激大腦皮質運動神經元,並在相應的肌肉記錄到動作電位,該方法可測定中樞運動傳導時間,對確定皮質脊髓束的損害具有重要價值。
16 輔助檢查
16.1 神經肌肉電生理檢查
表現爲廣泛的神經源性損害。
急性神經源性損害(失神經後2~3周)的特徵爲纖顫電位、正銳波、束顫電位和巨大電位,慢性失神經伴有再生時,表現爲肌肉輕收縮時運動單位動作電位時限增寬、波幅明顯升高及多相波百分比上升,肌肉大力收縮時可見運動單位脫失現象。
16.2 磁刺激運動誘發電位
磁刺激運動誘發電位可測定中樞運動傳導時間,對確定皮質脊髓束的損害具有重要價值。
16.3 肌肉活檢
17 肌萎縮側索硬化的診斷
1994年世界神經病學聯盟爲了進行大規模的肌萎縮側索硬化臨牀治療研究,提出了一個肌萎縮側索硬化的篩選診斷標準,該標準對臨牀實踐並不實用。
1998年Rowland在此基礎上進行修改,提出以下診斷標準:
17.1 肌萎縮側索硬化必須具備的條件
(1)20歲以後起病。
(2)進展性,無明顯的緩解期和平臺期。
17.2 支持脊髓性肌萎縮(SMA)的條件
(1)上述的下運動神經元體徵。
(2)腱反射消失。
(3)無Hoffmann和Babinski徵。
17.3 支持肌萎縮側索硬化的條件
(2)必須有Hoffmann或Babinski徵陽性或有膝、踝震攣。
(3)可有假性延髓性麻痹和情感不穩定或強哭強笑(emotional lability)。
(4)多爲消瘦體型。
17.4 有可疑上運動神經元體徵(possible upper motor neurone signs)的ALS(即ALS-PUMNS)
(1)上述下運動神經元受累體徵。
(3)無Hoffmann或Babinski徵或膝、踝震攣。
17.5 原發性側索硬化的診斷標準
(1)必要條件:①成人起病;②無中風史或支持多發性硬化的緩解復發病史;③家族中無類似病史;④痙攣性截癱;⑤下肢腱反射亢進;⑥Babinski徵陽性或有踝震攣;⑦無侷限性肌無力、肌萎縮及肢體或舌肌束顫;⑧無持續性的感覺異常或肯定的感覺缺失;⑨無癡呆;⑩肌電圖無失神經的證據。
(2)符合和支持診斷的條件:①假性延髓性麻痹(吞嚥困難、構音障礙);②上肢的上運動神經元體徵(手活動不靈活、輪替動作緩慢笨拙、雙臂腱反射、活躍、Hoffmann徵陽性);③痙攣性膀胱症狀;④MRI示運動皮質萎縮及皮質脊髓束高信號;⑤磁共振光譜(magnetic resonance spectroscope)有皮質乙酰天門冬氨酸缺失的證據;⑥運動皮質磁刺激示中樞運動傳導損害。
(3)診斷原發性側索硬化還應注意排除下列疾病:①MRI排除多發性硬化,後腦畸形、枕骨大孔區壓迫性損害、頸椎病性脊髓病、脊髓空洞和多發性腦梗死; ②血液檢查排除維生素Bl2缺乏、HTLV-1(human T lymphocyte leukemia virus)、極長鏈脂肪酸(排除腎上腺腦白質營養不良)、Lyme抗體、梅毒血清實驗、免疫電泳(排除副蛋白血症);③腦脊液檢查排除多發性硬化、HTLV-1感染和神經梅毒。
18 鑑別診斷
肌萎縮側索硬化的鑑別診斷比較複雜,根據Belsh和Schiffman的統計,本病早期有27%被誤診爲其他疾病,在愛爾蘭的國家ALS登記處有10%的病例爲誤診。
中晚期的肌萎縮側索硬化診斷並不困難,但在疾病早期需與以下疾病進行鑑別。
18.1 頸椎病脊髓
脊髓型頸椎病可以表現爲手肌無力和萎縮伴雙下肢痙攣,而且頸椎病和ALS均好發於中年以上的人羣,兩者容易混淆。由於頸椎病引起的壓迫性脊髓損害很少超過C4,因而舌肌和胸鎖乳突肌肌電圖檢查發現失神經現象強烈提示ALS。超過一個神經根分佈區的廣泛性肌束顫動也支持ALS的診斷。頸椎病性脊髓病時MRI可顯示脊髓受壓,但出現這種影像學改變並不能排除ALS。一方面有些患者雖然影像學有頸髓受壓的證據,但並不一定導致出現脊髓損害的症狀和體徵,另一方面,頸椎病可與ALS同時存在。
18.2 包涵體肌炎(IBM)
包涵體肌炎是繼頸椎病性脊髓病後最容易與ALS混淆的疾病,Brannagan(1999)複習20例IBM,其中半數早期誤診爲ALS或周圍神經病。兩者的共同症狀爲手肌或四肢遠端肌萎縮,腱反射消失,無感覺障礙和感覺異常(IBM合併周圍神經病除外)。
IBM患者指屈肌無力通常較爲明顯,而在ALS到晚期其他手肌明顯受累時纔有指屈肌無力,且第1骨間肌多無萎縮。IBM常有明顯的股四頭肌萎縮伴上樓費力和起立困難,但無束顫和上運動神經元損害體徵。IBM患者的肌肉活檢可見鑲邊空泡和炎症浸潤可資與ALS鑑別。
18.3 多竈性運動神經病
多竈性運動神經病是一種周圍神經病。因其有明顯的肌無力和肌萎縮伴肌束顫動,而腱反射正常或亢進,容易與ALS或SMA混淆。神經電生理檢查發現運動傳導阻滯、運動神經活檢發現脫髓鞘改變及IVIG試驗性治療有效支持多竈性運動神經病。磁共振光譜有皮質乙酰天門冬氨酸缺失及運動皮質磁刺激發現中樞運動傳導障礙提示ALS。
18.4 Kennedy-Alter-Song綜合徵
與ALS的共同點是兩者均有下運動神經元受損的症狀和體徵。Kennedy-Alter-Song綜合徵還有以下特點可資與ALS鑑別:①X連鎖遺傳方式;②姿位性震顫伴乳房腫大;③無上運動神經元的症狀和體徵;④近端肌無力爲主,面部肌肉和吞嚥肌容易受累、撅嘴動作可誘發下巴顫搐(twitching);⑤有時伴有皮膚感覺異常和感覺缺失;⑥腓腸神經感覺電位活動喪失;⑦基因分析有三核苷酸(CAG)重複增多。
18.5 氨基己糖苷酶缺乏症
氨基己糖苷酶缺乏症又稱GM2神經節苷脂累積病或Tay-Sach disease。因有上下運動神經元損害的體徵易與ALS混淆。不同之處爲前者多爲兒童或青少年起病,進展緩慢,有小腦體徵,有些患者可伴抑鬱性精神病和癡呆。
18.6 良性肌束顫動
良性肌束顫動病因未明。其特點爲廣泛束顫不伴肌無力、肌萎縮和腱反射異常。正常人在疲勞、寒冷、焦慮、劇烈運動及抽菸和喝咖啡時容易出現。EMG有自發性電活動,但無運動單位的形狀改變。在少數情況下束顫可爲ALS的首發症狀,應引起注意。肌束顫動高度提示運動神經元核周病變,除多竈性運動神經病和澱粉周圍神經病外,其他周圍神經病罕見。肌病患者出現束顫時應警惕合併周圍神經病的可能。
18.7 平山病
平山病又稱單肢脊髓性肌萎縮(monomelic spinal muscular atrophy)或青年上肢遠端肌萎縮。特點爲20歲左右起病,臨牀表現爲肌萎縮、肌無力、肌束顫動和痙攣。症狀進展1年左右停止,MRI可正常或見脊髓萎縮。一些患者早期表現爲平山病,以後發展爲ALS。
18.8 重症肌無力
咽喉部位受累者須與以延髓麻痹爲首發症狀的ALS鑑別,前者有典型的肌無力和病態疲勞,休息後好轉。新斯的明試驗陽性,肌電圖正常,重頻刺激試驗陽性。有些ALS患者應用新斯的明後肌無力症狀也有一定程度的改善,應注意與重症肌無力鑑別。
18.9 脊髓灰質炎後綜合徵(postpolio syndrome)
脊髓灰質炎後綜合徵是指癱瘓型脊髓灰質炎患者在患病20~25年後出現緩慢進展的肌無力和肌萎縮,多見於肌萎縮後遺症最嚴重的部位,偶爾累及其他未受累肌羣。進展緩慢、無上運動神經元的體徵以及幾乎不累及生命可資與ALS鑑別。
18.10 甲狀腺功能亢進合併肌萎縮側索硬化症狀羣
國外已有近20個病例報告。甲狀腺功能亢進患者可合併單純下運動神經元、單純上運動神經元體徵和上下運動神經元損害的體徵,其中84%的患者抗甲狀腺治療後ALS症狀羣獲得改善。甲亢患者出現這些可逆性ALS症狀羣的確切機制尚不清楚,但可以肯定是神經系統受累,而非甲狀腺肌病。
18.11 副腫瘤性肌萎縮側索硬化
儘管有許多研究顯示ALS患者的腫瘤發病率與正常人相比並不增加,但一些合併腫瘤的ALS患者在腫瘤切除之後,ALS的症狀和體徵可以完全消失。表明二者在病理發生機制方面有一定聯繫。淋巴瘤與ALS的關係似乎更爲密切,儘管淋巴瘤合併單純下運動神經元損害時可能與運動性周圍神經病有關,但國外學者報告61例ALS合併淋巴瘤,其中半數以上合併上運動神經元體徵,而在屍檢病例中,又有半數以上可見皮質脊髓束受累。少數(不到10%)患者免疫抑制治療後ALS的症狀可緩解。
18.12 中樞神經的多系統變性
臨牀上典型的ALS症狀羣可合併癡呆、帕金森症狀羣及小腦體徵等,被稱爲ALS疊加綜合徵,此時應與多系統萎縮、CJD、Alzheimer病、Huntington舞蹈病和Machado-Joseph病等鑑別。
18.13 其他脊髓病
亞急性聯合變性、人類T淋巴細胞白血病病毒相關性脊髓病(HAM)、Lyme病、梅毒和多發性硬化有時也可引起類ALS症狀羣。
18.14 中毒性周圍神經病
19 肌萎縮側索硬化的治療
長期以來肌萎縮側索硬化缺乏有效的治療措施。1995年力魯唑(力如太)作爲ALS的標準治療藥物上市後,經過大量的臨牀驗證發現該藥可延長肌萎縮側索硬化患者處於疾病輕、中度狀態和存活的時間,推遲肌萎縮側索硬化發生呼吸困難的時間,但不能使已經出現的運動障礙獲得改善。該藥主要是通過抑制突觸前谷氨酸的釋放,阻滯興奮性氨基酸受體,抑制神經末梢和神經細胞體上的電壓依賴性鈉通道而發揮作用。用藥方法爲50mg,2次/d,口服,療程爲1~1.5年。該藥耐受性好,常見副反應有噁心、乏力和谷丙轉氨酶升高。
肌萎縮側索硬化的對症治療對改善患者的生存質量具有重要意義。物理治療可延緩肌萎縮的進展,預防關節攣縮。吞嚥功能障礙時應及時插胃管或行胃造瘻手術,保證營養供應,避免嗆咳導致的吸入性肺炎。發生呼吸困難時應行氣管切開,機械通氣。對勞累性呼吸困難的患者可給間歇性正壓輔助呼吸,此種輔助呼吸器材體積小,操作方便,可隨身攜帶,患者容易接受。對有痛性痙攣或嚴重痙攣狀態的患者可給卡馬西平0.1,3次/d或巴氯芬,初始劑量爲5mg,3次/d,以後每3天增加5mg,有效劑量範圍爲30~75mg,最大劑量可達100~120mg。
24 診療指南
24.1 概述
肌萎縮側索硬化(amyotrophic lateral sclerosis,ALS)是一種病因未明、主要累及大腦皮質、腦幹和脊髓運動神經元的神經系統變性疾病。其侷限性分型包括進行性球麻痹(PBP),連枷臂、腿,進行性肌萎縮(PMA),原發性側索硬化(PLS)。ALS 以進行性發展的骨骼肌萎縮、無力、肌束顫動、延髓麻痹和錐體束徵爲主要臨牀表現。一般中老年發病,生存期通常 3~5 年。
24.2 病因和流行病學
大約 90%的 ALS 發病機制目前尚不明確。國內外學者普遍認爲,ALS的發病是基因與環境共同作用的結果。較爲常見的 ALS 致病基因包括SOD1,TDP-43,研究顯示,由 FUS、SOD1 及 OPTN3 種基因的突變造成的患者不超過2%,而25.6%~30.6%的家族性 ALS 患者有 SOD1 突變。其他可能的發病機制包括RNA加工異常、穀氨酸興奮性毒性、細胞骨架排列紊亂、線粒體功能障礙、病毒感染、細胞凋亡、生長因子異常、炎症反應等。
歐洲及美國年發病率是 2/10 萬~3/10 萬,患病率爲(3~5)/10 萬。發病的高峯年齡爲 50~75 歲,不隨着年齡增加而增高。約 10%ALS 患者爲家族性,餘90%爲散發性。ALS 中男女患病率比例爲(1.2~1.5):1。家族性ALS 的平均發病年齡較散發性 ALS 發病年齡早。中國 ALS 的流行病學數據主要來自中國(中國香港地區),發病率約 0.6/10 萬人,患病率約 3.1/10 萬人。
24.3 臨牀表現
ALS 是一種上、下運動神經元同時受累的神經系統變性疾病。臨牀主要表現爲球部、四肢、胸腹部肌肉進行性無力和萎縮。而眼球運動神經和括約肌功能一般並不受累,但在有些患者晚期也可能會被累及。20%~50%的患者可以表現有認知功能障礙,5%~15%的患者甚至會發展爲額顳葉癡呆。發病後平均3~5年因呼吸衰竭死亡,但 5%~10%的患者可以存活 10 年以上。
24.4 輔助檢查
通過詳細的病史和體格檢查,在腦幹、頸、胸、腰骶4 個區域中尋找上、下運動神經元共同受累的證據,是診斷 ALS 的基礎。查體發現在同一區域,同時存在上、下運動神經元受累的體徵是診斷 ALS 的要點。其中下運動神經元受累體徵主要包括肌肉無力、萎縮和肌束顫動。通常檢查舌肌、面肌、咽喉肌、頸肌、四肢不同肌羣、背肌和胸腹肌。上運動神經元受累體徵主要包括病理徵陽性、腱反射亢進、肌張力增高、陣攣等。通常檢查吸吮反射、咽反射、下頜反射、掌頜反射,有無強哭、強笑等假性延髓麻痹表現,四肢腱反射、肌張力、霍夫曼徵、下肢病理徵、腹壁反射等。臨牀查體是發現上運動神經元受累的主要方法,在出現萎縮、無力的區域,如果腱反射不低或活躍,即使沒有病理徵,也可以提示錐體束受損。
24.4.1 1.神經電生理檢查
當臨牀考慮爲 ALS 時,需要進行神經電生理檢查,以確認臨牀受累區域爲下運動神經元病變,並發現在臨牀未受累區域也存在的下運動神經元病變,同時協助排除其他疾病。神經電生理檢查可以看作是臨牀查體的延伸,應該由合格的肌電圖醫生或技師完成,並依據明確的標準進行判斷。
(1)神經傳導測定:神經傳導測定主要用來診斷或排除周圍神經疾病。運動和感覺神經傳導測定應至少包括上、下肢各 2 條神經。
1)運動神經傳導測定:遠端運動潛伏期和神經傳導速度通常正常,無運動神經部分傳導阻滯或異常波形離散。隨病情發展,複合肌肉動作電位波幅可以明顯下降,傳導速度也可以有輕微減慢。
2)感覺神經傳導測定:一般正常。當存在嵌壓性周圍神經病或同時存在其他的周圍神經病時,感覺神經傳導可以異常。在進行下肢的感覺神經傳導測定時,有些老年患者很難引出感覺神經動作電位,並不一定是異常。
3)F 波測定:通常正常。當肌肉明顯萎縮時,相應神經可見F 波出現率下降,而傳導速度相對正常。
(2)同芯針肌電圖檢查:下運動神經元病變的判斷主要通過同芯針肌電圖檢查。肌電圖可以證實進行性失神經和慢性失神經的表現。
1)進行性失神經表現:主要包括纖顫電位、正銳波和束顫電位。當同時存在慢性失神經的表現時,束顫電位與纖顫電位、正銳波具有同等臨牀意義。
2)慢性失神經的表現:運動單位電位的時限增寬、波幅增高,通常伴有多相波增多;大力收縮時運動單位募集相減少,發放頻率升高,當同時存在上運動神經元受累的體徵時,發放頻率的測定會受到影響;大部分ALS 可見發放不穩定、波形複雜的運動單位電位。
3)診斷 ALS 時,肌電圖必須存在慢性失神經的表現,但並不一定都有纖顫電位或正銳波。當肌電圖檢查提示進行性失神經和慢性失神經共存時,對於診斷ALS 有更強的支持價值。如果所有測定區域均無進行性失神經表現,診斷ALS需慎重。
4)肌電圖診斷 ALS 時的檢測範圍:應對 4 個區域均進行肌電圖測定。其中腦幹區域可以測定一塊肌肉,如胸鎖乳突肌、舌肌、面肌或咬肌。胸段可在胸6水平以下的脊旁肌或腹直肌進行測定。對於頸段和腰骶段,應至少測定不同神經根和不同周圍神經支配的兩塊肌肉。
5)在 ALS 早期,肌電圖檢查時可以僅僅出現 1 個或2 個區域的下運動神經元損害。此時對於臨牀懷疑 ALS 的患者,需要間隔 3 個月進行隨訪複查。6)肌電圖出現 3 個或以上區域的下運動神經源性損害時,並非都是ALS。電生理檢查結果應該密切結合臨牀進行分析,不應孤立的對肌電圖結果進行解釋。
(3)運動誘發電位:經顱磁刺激運動誘發電位檢測有助於發現臨牀下的錐體束損傷,主要表現爲中樞運動傳導時間延長。
24.4.2 2.神經影像學檢查
(1)腦或脊髓的影像學檢查有助於 ALS 與其他疾病鑑別,排除結構性損害。例如顱底、腦幹、脊髓或椎管結構性病變導致上和(或)下運動神經元受累時,相應部位的 MRI 檢查可提供幫助。
(2)某些常見疾病,如頸神經根脊髓病等,常與ALS 合併存在,需要注意鑑別。
24.4.3 3.基因檢測
自 20 世紀 90 年代以來,已發現 SOD1、ANG、VAPB、VCP、SQSTM1、TARDBP、DCTN1、DAO、SETX、FUS、C9ORF72、ATXN2、OPTN、SCFD1、NEK1、C21ORF2 等 20 多個基因突變。建議充分、詳細詢問ALS患者及其兄弟姐妹的病史以及患者父母、祖父母的詳細病史和其兄弟姐妹的病史。
24.5 診斷
ALS 的早期臨牀表現多樣,缺乏特異的生物學確診指標。詳細的病史、細緻的查體和規範的肌電圖檢查對於早期診斷具有關鍵性的作用。影像學等其他輔助檢查在鑑別診斷中具有一定價值。根據患者所出現症狀、體徵的解剖部位,可分爲腦幹、頸、胸和腰骶 4 個區域;根據臨牀和肌電圖檢查所證實的上、下運動神經元受累區域多少,可分爲不同的 ALS 診斷級別(EI Escorial 標準修訂版)(表4-1)。
1.臨牀確診 ALS 通過臨牀或電生理檢查,證實在4 個區域中至少有3 個區域同時存在上、下運動神經元同時受累的證據。
2 臨牀擬診 ALS 通過臨牀或電生理檢查,證實在4 個區域中至少有2 個區域同時存在上、下運動神經元同時受累的證據。
3.實驗室支持的擬診 ALS1 個區域上、下運動神經元同時受累或僅有上運動神經元受累伴電生理檢查提示至少 2 個區域的下運動神經元受累,影像和實驗室檢查排除其他疾病。
4.臨牀可能 ALS:通過臨牀或電生理檢查,證實僅有1 個區域存在上、下運動神經元同時受累的證據,或者在 2 個或以上區域僅有上運動神經元受累的證據。已經行影像學和實驗室檢查排除了其他疾病。
表 4-1ALS 診斷標準
核心標準:
1.下運動神經元體徵(包括肌電圖有表現但在臨牀上未累及的肌肉)2.上運動神經元體徵
3.症狀和體徵逐漸進展
排除標準:
2.括約肌障礙
3.視覺障礙
6.阿爾茨海默型癡呆
7.類 ALS 綜合徵(如解剖變異/壓迫綜合徵,獲得性酶缺陷,自身免疫性綜合徵,中毒,感染,內分泌異常等)支持標準:
1.在一個或多個區域肌束震顫
3.運動和感覺神經正常
4.無傳導阻滯
24.6 鑑別診斷
在 ALS 的診斷過程中,根據症狀和體徵的不同,需要與多種疾病進行鑑別,常見的有頸椎病、腰椎病、多竈性運動神經病、平山病、成人脊髓性肌萎縮、肯尼迪病、遺傳性痙攣性截癱等。
24.7 治療
儘管 ALS 仍是一種無法治癒的疾病,但有許多方法可以改善患者的生活質量。早期診斷,早期治療,儘可能地延長生存期。治療上除了延緩病情發展和對症治療的藥物外,還包括營養管理、呼吸支持和綜合治療等。
24.7.1 1.藥物治療
(1)利魯唑:化學名爲 2-氨基-6(三氟甲氧基)-苯並噻唑。其作用機制包括穩定電壓門控鈉通道的非激活狀態、抑制突觸前谷氨酸釋放、激活突觸後穀氨酸受體以促進穀氨酸的攝取等。該藥是目前唯一證實可以在一定程度上延緩病情發展的藥物,用法爲 50mg,每日 2 次口服。常見不良反應爲疲乏和噁心,個別患者可出現肝轉氨酶升高,需注意監測。當患者已經使用有創呼吸機輔助呼吸時,不建議繼續服用。
(2)其他藥物:依達拉奉在部分國家被批准可以用於早期ALS 患者的治療,衆多針對不同發病機制的臨牀試驗也仍在進行。臨牀上也常使用多種維生素治療。另外,根據患者情況,可以選用不同的對症治療藥物以改善抑鬱、焦慮、失眠、流涎、肢體痙攣、疼痛等症狀。
24.7.2 2.營養管理
(1)能夠正常進食時應採用均衡飲食;吞嚥困難時宜採用高蛋白、高熱量飲食以保證營養攝入。進食軟食、半流食,少食多餐。(2)當患者吞嚥明顯困難、體重下降、脫水或存在嗆咳誤吸風險時,應儘快行經皮內鏡胃造瘻術(percutaneous endoscopic gastrostomy,PEG)。對於拒絕或無法行 PEG 者,可採用鼻胃管進食。
3.呼吸支持當 ALS 患者出現呼吸肌無力時,需要儘早考慮治療的方法,與患者和家屬就無創通氣、有創通氣以及後期的處理達成共識。在使用有創呼吸機輔助呼吸前,建議定期檢查肺功能。
4.綜合治療 ALS 患者治療過程中,應注重多科協作,涉及神經科、呼吸內科、消化內科、心理科、康復科、營養科等,護理人員在其中也發揮着重要作用。
24.8 診療流程
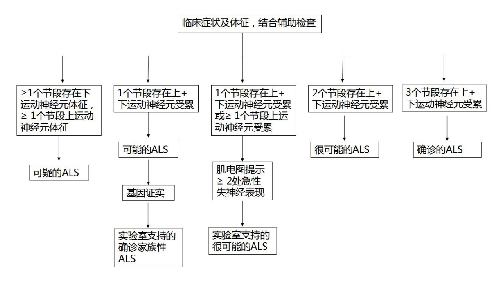
圖 4-1 肌萎縮側索硬化(ALS)診療流程
根據 EI Escorial 標準修訂版
24.9 參考文獻
[1] Brown RH, Al-Chalabi A.Amyotrophic Lateral Sclerosis. NEngl JMed,2017,377(2):162-172.
[2] Brooks BR, Miller RG, Swash M, et al. For the World Federation of NeurologyResearch Committee on Motor Neuron Disease. EI Escorial revisited: revisedcriteria for the diagnosis of amyotrophic lateral sclerosis. Amyotrophic Lateral Sclerosis, 2000,1:293-300.
[3] Ludolph A, Drory V, Hardiman O, et al. Arevisionof theElEscorialcriteria-2015. Amyotroph Lateral Scler Frontotemporal Degener, 2015,16(5-6):291-292.