2 英文參考
buffer solution[WS/T 455—2014 衛生監測與評價名詞術語]
3 註解
緩衝溶液是指加入溶液中能控制pH或氧化還原電位等僅發生可允許的變化的溶液[1]。
與所有的化學平衡一樣,當溶液的濃度、溫度等條件改變時,弱酸、弱鹼的解離平衡會發生移動。就濃度的改變來說,除用稀釋的方法外,還可在弱酸、弱鹼溶液中加入具有相同離子的強電解質以改變某一離子的濃度,從而引起弱酸或弱鹼解離平衡的移動。例如,往HAc溶液中加入NaAc,由於Ac-離子濃度增大,使平衡向生成HAc 的一方移動,結果就降低了HAc的解離度。又如,往NH3水溶液中加入NH4Cl,由於
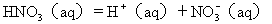
弱酸溶液中加入該酸的共軛鹼,或在弱鹼的溶液中加入該鹼的共軛酸時,可使這些弱酸或弱鹼的解離度降低。這種現象叫做同離子效應。
這種由弱酸(或弱鹼)及其共軛鹼(或共軛酸)所組成的溶液具有一種很重要的性質,其pH值能在一定範圍內不因稀釋或外加的少量酸或鹼而發生顯著變化,即對外加的酸和鹼具有緩衝的能力,故稱爲緩衝溶液。例如,在HAc和NaAc的混合溶液中,HAc是弱酸,解離度較小; NaAc是強電解質,完全解離,因而溶液中HAc和Ac-的濃度都較高。由於Ac-同離子效應,抑制了HAc的解離而使H離子濃度比未加NaAc時要小得多。
HAc(aq)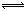 H+(aq)+Ac-(aq)
H+(aq)+Ac-(aq)
當往該溶液中加入少量強酸時,強酸提供的H離子會與溶液中大量存在的Ac-離子結合形成HAc分子,則平衡向左移動,使溶液中Ac-離子濃度略有減少,HAc濃度略有增加,但溶液中H離子濃度不會有顯著變化。如果加入少量強鹼,強鹼會與H離子結合,則HAc解離平衡向右移動,使HAc濃度略有減少,Ac-濃度略有增加,H離子濃度仍不會有顯著變化。
可用通式來表示這種共軛酸鹼之間存在的平衡:
共軛酸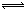 H共軛鹼
H共軛鹼
外加少量強酸,平衡向左移動,共軛鹼與H結合生成共軛酸;外加少量強鹼,平衡向右移動,共軛酸轉變成共軛鹼和H。其中的共軛酸(如
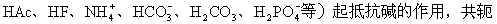
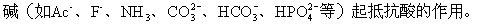

根據共軛酸鹼之間的平衡,可得:

c(H)=Ka·c(共軛酸)/c(共軛鹼)
4 參考資料
- ^ [1] 中華人民共和國國家衛生和計劃生育委員會.WS/T 455—2014 衛生監測與評價名詞術語[Z].2014-11-15.