1 拼音
GBZ/T 240.21—2011 huà xué pǐn dú lǐ xué píng jià chéng xù hé shì yàn fāng fǎ dì 21bù fēn :zhì jī shì yàn
2 英文參考
Procedures and tests for toxicological evaluations of chemicals—Part 21:Teratogenicity test
ICS 13.100
C 52
中華人民共和國國家職業衛生標準 GBZ/T 240.21—2011《化學品毒理學評價程序和試驗方法 第21部分:致畸試驗》(Procedures and tests for toxicological evaluations of chemicals—Part 21:Teratogenicity test)由中華人民共和國衛生部於2011年08月19日發佈,自2012年03月01日起實施。
3 前言
根據《中華人民共和國職業病防治法》制定本部分。GBZ/T 240《化學品毒理學評價程序和試驗方法》現分爲以下四十四部分:
——第1部分:總則;
——第2部分:急性經口毒性試驗;
——第3部分:急性經皮毒性試驗;
——第4部分:急性吸入毒性試驗;
——第5部分:急性眼刺激性/腐蝕性試驗;
——第7部分:皮膚致敏試驗;
——第8部分:鼠傷寒沙門氏菌回覆突變試驗;
——第13部分:哺乳動物精原細胞/初級精母細胞染色體畸變試驗;
——第15部分:亞急性經口毒性試驗;
——第16部分:亞急性經皮毒性試驗;
——第17部分:亞急性吸入毒性試驗;
——第18部分:亞慢性經口毒性試驗;
——第19部分:亞慢性經皮毒性試驗;
——第20部分:亞慢性吸入毒性試驗;
——第21部分:致畸試驗;
——第22部分:兩代繁殖毒性試驗;
——第24部分:慢性經口毒性試驗;
——第25部分:慢性經皮毒性試驗;
——第27部分:致癌試驗;
——第28部分:慢性毒性/致癌性聯合試驗;
——第29部分:毒物代謝動力學試驗;
——第33部分:果蠅伴性隱性致死試驗;
——第35部分:體外哺乳動物細胞程序外DNA合成(UDS)試驗;
——第42部分:一代繁殖試驗;
本部分爲GBZ/T 240的第21部分。
本部分由衛生部職業衛生標準專業委員會提出。本部分由中華人民共和國衛生部批准。
本部分起草單位:上海市疾病預防控制中心、中國疾病預防控制中心職業衛生與中毒控制所。本部分主要起草人:肖萍、孫金秀、薛春霄、林錚。
第21部分:致畸試驗
5 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅所注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
GBZ/T 224 職業衛生名詞術語
9 6 試驗方法
9.1 6.1 實驗動物
首選健康、剛進入性成熟期、未經交配的雌性大鼠或家兔,按雌雄動物比例2:1或1:1交配。試驗前的適應期至少爲3d。
爲了獲得足夠的胎仔數,正確地評價受試樣品致畸的可能性,對於大鼠,每個劑量組和對照組至少應有15只妊娠動物,家兔至少爲12只。
9.2 6.2 劑量設計
試驗至少設3個劑量組、1個陰性對照組,必要時可設1個陽性對照組。陽性對照物可選用環磷酰胺、阿司匹林或維生素A。對照組動物除了不給予受試樣品外,其他處理應與劑量組完全相同。試驗可以先採用預試驗,瞭解受試樣品引起胚胎或胎仔死亡的劑量。在受試樣品理化和生物特性允許的條件下,高劑量組劑量應使母體出現明顯的毒性反應,如輕微的體重下降,但不能引起超過10%的母體死亡;低劑量應不引起動物任何可觀察到的毒性反應;在低劑量和高劑量之間可按幾何級數設置中間劑量。如果受試樣品的毒性較低,1000 mg/kg體重的劑量對胚胎無明顯毒性或致畸作用,則可以採用限量試驗,即試驗不需要設其他劑量組。若高劑量的預試驗對母體確有一定的毒性作用,但對胚胎無不良影響,也可以採用限量試驗。
9.3 6.3 試驗步驟
9.3.1 6.3.1 染毒途徑
通常爲經口灌胃,也可以採用其他與人的接觸方式相同的給樣方式。每天的染毒應在同一時間進行。如果受試樣品是通過灌胃染毒的,應按每隻母體動物的體重來確定每日的染毒量。
9.3.2 6.3.2 交配及染毒期限
雄性和雌性動物按1:1或1:2的比例合籠交配。每天早晨應對雌性動物進行檢查,查看陰道中是否有精子或陰栓。將檢查到精子或陰栓的當天計爲雌性動物妊娠的第0天。將妊娠動物隨機分組後,於胚胎器官的形成期開始染毒(大鼠爲孕後6 d~15 d,家兔爲孕後6 d~18 d),每天一次。
9.3.3 6.3.3 觀察期限及指標
6.3.3.1 每日至少對妊娠動物進行一次仔細的臨牀觀察。發現虛弱或瀕死的動物,應進行隔離或人道處死,對死亡的動物應進行屍檢。如母體有流產、早產症狀者也應處死並作大體檢查。
6.3.3.2 每日稱取妊娠動物體重,每週記錄攝食量,並觀察其臨牀症狀,包括皮膚、毛、眼睛、黏膜、呼吸系統、循環系統、神經系統、四肢活動和行爲方式的改變。
6.3.3.3 及時記錄任何毒性反應,包括出現的時間、程度和持續的時間。
9.3.4 6.3.4 觀察指標
分娩前一天處死妊娠動物(大鼠爲妊娠第20天,小鼠爲妊娠第18天,家兔爲妊娠後第29天),立即進行解剖檢查。
9.3.4.1 6.3.4.1 子宮觀察
取出子宮,分別稱取子宮、胎盤和活胎的重量,記着牀數、活胎數、死胎數及吸收胎數。
9.3.4.2 6.3.4.2 外觀檢查
逐一記錄活胎仔的身長和尾長。檢查外觀有無異常,如頭部:無腦、腦膨出、露腦、頭蓋裂、腦積水、小頭、顏面裂、小眼、無眼、眼球突出、無耳、小耳、耳位低、無顎、小顎、下顎、兔脣和下頜裂;軀幹部:胸骨裂、胸部裂、脊椎裂、脊椎側彎、脊椎前彎、脊椎後彎、臍疝、尿道下裂、無肛門、短尾、卷尾、無尾和腹裂;四肢:多肢、無肢、短肢、半肢、多趾、無趾、並趾、短趾和缺趾。胎鼠畸形檢查方法見附錄A。
9.3.4.3 6.3.4.3 骨骼檢查
將每窩1/2的胎仔放入茜素紅液(配製方法見附錄B的B.1)中染色,進行骨骼檢查。測量囟門大小,矢狀縫的寬度,頭頂間骨及後頭骨缺損情況,然後檢查脊柱骨的數目、融合、縱裂、部分裂開、骨化中心數、發育不全、縮窄、脫離和形狀;骨盆的弓數目、骨化中心數、形狀異常、融合、裂開、縮窄和脫離;四肢骨的形狀和數目;腕骨的骨化中心數;掌骨、趾骨的形狀;肋骨的數目、形狀、融合、分叉、缺損和發育不全;胸骨的形狀、完全缺失、胸骨節融合、裂開、形狀異常和發育不良等情況。
9.3.4.4 6.3.4.4 內臟檢查
將每窩另一半的胎仔放人Bouin's液(配製方法見附錄B的B.2)中,固定兩週後作臟器和軟組織檢查。檢查有無異常,如頭部:嗅球發育不良、側腦室擴張、第三腦室擴張、角膜缺損等;胸部:右心位、房中隔缺損、室間隔缺損、主動脈弓、食道閉鎖、氣管狹窄、無肺、多肺、肺葉融合、膈疝、氣管食管瘻和內臟異位等;腹部:肝分葉異常、腎上腺缺失、多囊腎、膀胱缺失、睾丸缺失、陰睾、卵巢缺失、卵巢異位、子宮缺失、子宮發育不全、腎積水、腎缺失和輸尿管積水等。對於家兔每個胎仔都應解剖進行臟器檢查和骨骼檢查。
10 7 數據處理與結果評價
10.1 7.1 數據處理
數據可以用統一的表格進行統計,表中應顯示每組的實驗動物數、平均體重、受孕動物數、黃體數、着牀數、吸收胎數、活胎數、死胎數及其百分率、胎仔的情況(體重、胎盤重、體長、尾長)、畸胎的類型(包括外觀、骨骼和內臟)、數目及百分率。
數據可採用任何一種適當的統計方法進行處理。應將各劑量組的指標相應地與對照組進行顯著性檢驗。其中,以畸胎率最爲重要,主要有以下兩種:

注:凡每一活胎出現一種以上畸形時,均作一個畸胎計。
當出現的畸胎是以某一種或某幾種畸形爲主時,就應按畸形種類單獨計算該畸形率。

10.2 7.2 結果評價
7.2.1 評價時應結合所用動物品系的歷史性的資料進行,包括自發畸變種類和頻率。
13 附錄A(資料性附錄)胎鼠畸形檢查方法
13.1 A.1 胎鼠外觀檢查
對每隻胎鼠先經肉眼檢查,如果肉眼不能確定某種畸形時,將胎鼠放在解剖顯微鏡下迸一步確定並照相,胎鼠的檢查順序如下。
13.2 A.2 胎鼠的頭部檢查
有無露腦(無頭蓋骨),腦膜膨出,頭部大小(大頭可能腦積水、小頭爲頭部發育不良)。眼睛的有無,眼所在部位,大小(小眼或大眼),突眼或開眼等。兩耳、鼻和嘴外表是否正常和對稱,上下頜有無脣裂。
13.3 A.3 四肢的檢查
四肢有無多趾(指)、並趾、少趾、無趾、足內外翻、短肢等畸形。
13.4 A.4 軀幹的檢查
13.5 A.5 尾部檢查
有無短尾、卷尾、無尾和尾分叉等。
13.6 A.6 標本的製作
將每窩1/2胎鼠放人Bouin's液固定,作爲內臟檢查,另1/2放入95%酒精中固定作爲骨骼檢查。
13.7 A.7 骨骼標本的製備
胎鼠放入1% KOH溶液中軟化至能很清楚地看見骨骼爲止,必要時中間可更換1次KOH溶液。
13.8 A.8 骨骼染色
將骨骼標本放入茜素紅應用液中染色16 h,直至全部骨骼染成紫紅色爲止,中間可更換一次染液。
13.9 A.9 骨骼透明
染好色以後,用自來水衝淨標本,倒掉染液,將標本置於50%甘油中脫色3 d~5 d。
13.10 A.10 骨骼檢查
A.10.1 頭骨檢查:顱骨是否完整,有無骨化不全,骨縫的寬窄,枕骨的形狀。
胎鼠上枕骨骨化程度的分級標準如下:
——0級:上枕骨成片狀或啞鈴狀,兩側骨化點完全融合,融合處寬度大於兩側的1/3。
——Ⅰ級:上枕骨兩側骨化點相連,相連處寬度小於兩側的1/3。
——Ⅱ級:上枕骨兩側骨化點不相連,但可清楚地見到兩個較大的骨化點。
——Ⅲ級:上枕骨兩側的骨化點不相連,僅見小骨化點或僅見一側骨化點。
——Ⅳ級:無上枕骨骨化點。
A.10.2 胸部骨骼:正常胸骨爲6塊,畸形時可有骨骼錯位及骨化不全,注意觀察第2胸骨和第5胸骨。小鼠正常肋骨爲13對,觀察有無多肋、少肋、肋骨分叉、融合、波狀肋等畸形。
A.10.3 四肢骨:檢查骨化程度、長短粗細、指趾骨的發育狀況。
13.11 A.11 胎鼠內臟徒手切片檢查
將胎鼠從Bouin's液中取出,自來水衝淨。測量每隻胎鼠身長及尾長。
13.12 A.12 頭部切片
將胎鼠放在蠟板或木板上,第1刀由嘴開始經兩耳切開,暴露舌、齶、上脣和下頜,檢查舌有無異常,有無齶、脣裂。將頭翻過來前背向上,切剩下的切片。第2刀從眼睛前面切下,暴露鼻中隔、鼻竇,記錄鼻腔是否通。第3刀平眼切下,暴露腦鼻葉,鼻中隔後區的大部分及鼻咽腔、眼組織、視網膜、玻璃體、晶狀體和角膜,檢查這些組織結構有無異常。第4刀從眼後切開,暴露大腦半球和側腦室,並注意有無畸形和擴張。第5刀橫切大腦半球,暴露間腦的第Ⅲ腦室、側腦室、脈絡膜等檢查這些部位有無異常。
13.13 A.13 內臟切片檢查
沿胸腹壁中線和肋下沿水平線各切一刀,暴露胸腔與腹腔內臟,檢查各臟器有無異常。
13.14 A.14 統計
應用適當的統計學軟件對數據進行分析處理。各組母鼠平均體重,胎鼠體重、身長、尾長,計量資料以均數±標準差(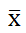
——活胎率=活胎數/胎鼠數×100%;