3 基本信息
ICS 11.020
CCS C 50
中華人民共和國衛生行業標準WS/T 805—2022《臨牀微生物檢驗基本技術標準》(Basic technical standard for clinical microbiology laboratory)由中華人民共和國國家衛生健康委員會2022年11月2日《關於發佈〈臨牀化學檢驗基本技術標準〉等4項推薦性衛生行業標準的通告》(國衛通〔2022〕12號)發佈,自2023年5月1日起施行。
4 發佈通知
關於發佈《臨牀化學檢驗基本技術標準》等4項推薦性衛生行業標準的通告
國衛通〔2022〕12號
現發佈《臨牀化學檢驗基本技術標準》等4項推薦性衛生行業標準,編號和名稱如下:
WS/T 804—2022 臨牀化學檢驗基本技術標準
WS/T 807—2022 臨牀微生物培養、鑑定和藥敏檢測系統的性能驗證
上述標準自2023年5月1日起施行。
特此通告。
國家衛生健康委
2022年11月2日
5 前言
本標準由國家衛生健康標準委員會臨牀檢驗標準專業委員會負責技術審查和技術諮詢,由國家衛生健康委醫療管理服務指導中心負責協調性和格式審查,由國家衛生健康委醫政司負責業務管理、法規司負責統籌管理。
本標準起草單位:華中科技大學同濟醫學院附屬同濟醫院、中國人民解放軍總醫院、北京醫院/國家衛生健康委臨牀檢驗中心、中國醫學科學院北京協和醫院、北京大學人民醫院、安徽省立醫院。
本標準主要起草人:沈定霞、孫自鏞、胡繼紅、徐英春、胡云建、王輝、馬筱玲、簡翠。
6 標準正文
6.1 1 範圍
6.2 2 規範性引用文件
下列文件中的內容通過文中的規範性引用而構成本文件必不可少的條款。其中,注日期的引用文件,僅該日期對應的版本適用於本標準;不注日期的引用文件,其最新版本(包括所有的修改單)適用於本標準。
GB 19489 實驗室生物安全通用要求
WS/T 442 臨牀實驗室生物安全指南
6.3 3 術語和定義
下列術語和定義適用於本標準。
3.1
消毒 disinfection
3.2
滅菌 sterilization
殺滅物體上所有微生物(包括細菌芽胞在內的全部病原微生物和非病原微生物)的方法。
3.3
無菌 asepsis
指不存在活菌。
3.4
無菌操作 aseptic operation
3.5
接種 inoculation
將目標微生物轉移至適於生長繁殖的人工培養基或活的生物體內的方法。
3.6
熒光淬滅 fluorescence quenching
指由於熒光分子與其他分子發生作用而出現的光度降低、發光時間縮短乃至停止發光的現象。
3.7
一套血培養 a set of blood culture
從同一個穿刺點採集的血液,通常分別注入一個需氧血培養瓶和一個厭氧血培養瓶進行血培養。
3.8
微生物培養 microbial culture
利用人工培養基和適宜的培養條件(如溫度、氣體環境等),使微生物生長繁殖的技術。
3.9
細菌鑑定 identification of bacteria
以細菌系統分類學爲原則,通過一系列的方法,將未知細菌歸到一定種屬的過程。
6.4 4 無菌操作及消毒滅菌技術要求
6.4.1 4.1 無菌操作技術要求
對各類標本進行採集、接種等過程及對已生長的微生物進行血清凝集、鑑定和藥敏試驗等操作時需要進行無菌操作。無菌操作技術要求包括:
d) 接種標本或轉種菌株應將接種環(針)加熱滅菌,或使用一次性無菌接種環(針);
e) 打開容器挑取標本或培養物後,應儘快蓋回蓋子,防止他們被污染或造成交叉污染;
f) 用加樣器和吸頭從試管中吸取體液標本或菌液時,應注意加樣器勿接觸管壁。
6.4.2 4.2 消毒滅菌技術要求
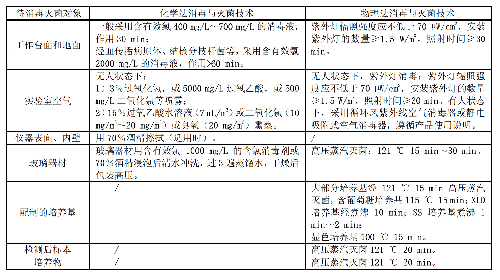
6.5 5 標本處理及製片技術要求
6.5.1 5.1 標本處理的技術要求
微生物實驗室根據標本類型、性狀以及目標微生物種類進行標本處理的技術要求見表2。

6.5.2 5.2 製片的技術要求
6.5.2.1 5.2.1 製片的種類與技術要求
製片宜在生物安全櫃內進行並儘可能使其自然乾燥,不建議加熱乾燥,若採用烤片機,溫度宜控制在60 ℃以下。用於檢查分枝桿菌的塗片必須在Ⅱ級生物安全櫃內進行。製片的種類與技術要求見表3。
表3 製片的種類與技術要求

6.5.2.2 5.2.2 固定
爲了使標本貼緊載玻片,需進行固定,防止染色過程中脫落。可採用加熱固定或使用甲醇固定。加熱固定時,載玻片要迅速通過酒精燈的外焰,來回3次;利用電熱滅菌器固定時,不要將載玻片緊貼電熱滅菌器,時間不宜超過10 s;採用甲醇固定時,將無水甲醇覆蓋在已加有標本的載玻片上,待其揮發幹後即可使用。
6.6 6 染色技術要求
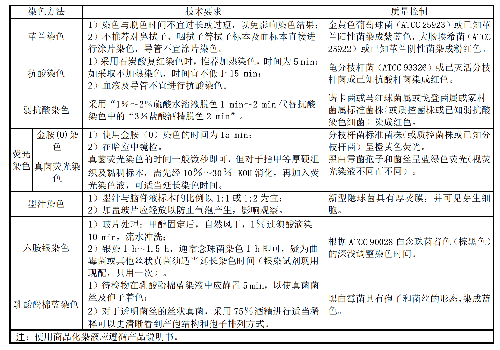
6.7 7 顯微鏡檢查技術要求
6.7.1 7.1 普通光學顯微鏡檢查的技術要求
6.7.1.1 7.1.1 革蘭染色標本的鏡檢要求
a) 在油鏡下觀察菌體形態、排列、染色性,以及細菌是否在白細胞內或白細胞周圍;
b) 將血液及腦脊液培養陽性標本革蘭染色鏡檢結果作爲危急值報告;對於痰及氣管抽吸物標本宜根據低倍鏡下鱗狀上皮細胞數量及白細胞數量判斷是否合格;未離心尿液中,若每個油鏡視野看到1個細菌,相當於尿液細菌計數105/mL;生殖道標本若見到革蘭陰性雙球菌,宜報告其是否位於中性粒細胞內;
c) 若在低倍鏡下發現真菌菌絲或孢子,應轉換至高倍鏡或油鏡確認。
6.7.1.2 7.1.2 抗酸及弱抗酸染色標本的鏡檢要求
a) 觀察抗酸染色標本時,要將玻片按一定方向及順序移動,做到不漏檢、不重複。連續觀察300個油鏡視野未發現抗酸桿菌,方可報告抗酸染色陰性;
b)觀察弱抗酸染色標本時,應注意儘可能全範圍、多視野進行觀察,並注意菌體的形態和排列。
6.7.1.3 7.1.3 墨汁染色標本的鏡檢要求
在低倍鏡下尋找有莢膜的酵母細胞,找到後,轉換至高倍鏡下確認。具有寬厚莢膜且伴有或不伴有出芽者爲隱球菌,腦脊液中發現隱球菌需按危急值報告。治療後菌體減少,莢膜變薄,要注意識別。
6.7.1.4 7.1.4 乳酸酚棉藍染色標本的鏡檢要求
觀察真菌菌絲、孢子的形態,以及菌絲與孢子的關係。注意培養基種類和絲狀真菌的培養時間會影響孢子的形成。
6.7.1.5 7.1.5 不染色標本的鏡檢要求
a)經陰道採樣製作的溼片:注意觀察白細胞、黏附細菌的鱗狀上皮細胞、酵母菌和陰道滴蟲等;
b)KOH溼片:注意觀察真菌結構,如酵母細胞、菌絲和橫隔等。
6.7.2 7.2 熒光顯微鏡檢查的技術要求
熒光顯微鏡主要用於觀察沒有自發熒光、經熒光染色後能發出熒光的病原體。熒光染色後的標本要儘快觀察,避免熒光淬滅對觀察結果的影響;用油鏡觀察標本時,採用無熒光的特殊鏡油;可在高倍鏡(物鏡40倍,目鏡10倍)觀察塗片,至少連續觀察50個視野未發現抗酸桿菌,方可報告熒光染色抗酸桿菌陰性;熒光染色觀察真菌時,應注意具有不同熒光顏色和熒光強度的真菌孢子和菌絲。
6.7.3 7.3 暗視野顯微鏡檢查的技術要求
在暗室內進行暗視野顯微鏡的觀察。如無暗室,應儘可能使用遮光裝置,以阻止目鏡周圍的光線射入。若視場中樣品與背景明暗反差不強,可調節聚光器的位置以提高照明光源的照明強度。在暗視野顯微鏡下觀察到運動活潑、呈穿梭狀或流星狀運動的細菌,應用O1羣及O139羣霍亂弧菌凝集血清分別做制動試驗。暗視野顯微鏡下觀察梅毒螺旋體時,應注意尋找細長、兩端尖銳、彈簧或螺旋狀、折光強的菌體,並注意其是否沿縱軸旋轉並可前後運動。
6.8 8 接種技術要求
6.8.1 8.1 微生物不同接種方式的技術要求
微生物不同接種方式的技術要求見表5。
表5 微生物不同接種方式的技術要求

表5 微生物不同接種方式的技術要求(續)

6.8.2 8.2 微生物接種通用的技術要求
a)臨牀微生物標本接種應在二級生物安全櫃中進行(參見GB 19489和WS/T 442)。標本接種過程要注意無菌操作,避免培養基受到環境微生物污染;
b)實驗室收到標本後應儘快接種。如果不能及時接種,應根據所培養的目標細菌選擇合適的標本存儲條件,或在收集標本時,選用適當的轉運培養基。避免延遲接種導致的細菌自溶或死亡,避免污染菌過度生長掩蓋致病菌,避免因標本存儲不當而降低培養陽性率。
6.8.3 8.3 初次分離用培養基的選擇及接種的技術要求
針對微生物檢測項目和標本類型,應適當選擇初次分離用的培養基種類,接種的技術要求見表6。
表6 不同送檢項目和標本類型所需的培養基種類與接種的技術要求

表 6 不同送檢項目和標本類型所需的培養基種類與接種的技術要求(續)

6.9 9 培養技術要求
6.9.1 9.1 微生物主要培養方式的技術要求
針對微生物的主要培養方式,技術要求(營養條件、氣體環境、培養溫度、培養時間等)見表7。
表7 微生物主要培養方式的技術要求注 1

表 7 微生物主要培養方式的技術要求注 1(續)
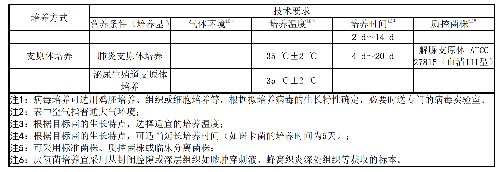
6.9.2 9.2 微生物定量培養技術要求
6.9.2.1 9.2.1 尿液定量培養的技術要求
a) 採用中段尿、膀胱穿刺尿、導管直接導出的尿液或夾住導尿管遠端從導尿管穿刺出來的尿液進行定量培養,不可使用導管導出至尿袋中的尿液進行定量培養;
b) 採用血平板進行尿液定量培養;
c) 使用定量接種環取混勻但未離心的尿液標本時應見接種環內有尿液形成的薄膜;
d)接種環在血平板上不可重複劃線,避免菌落重疊導致計數不準;
e) 接種好的平板放入含5%~10%的CO2孵箱,35 ℃±2 ℃培養24 h,觀察並進行菌落計數。若無菌生長,應繼續培養至48 h觀察並計數,報告計數單位爲每毫升菌落形成單位(Colony forming units per milliliter,CFU/mL)。
6.9.2.2 9.2.2 支氣管肺泡灌洗液定量培養的技術要求
b) 將支氣管肺泡灌洗液震盪混勻,用加樣器或定量接種環進行接種,採用L型玻璃棒或接種環進行均勻塗布;
c) 將接種好的血平板和巧克力平板放入含5%~10% CO2的孵箱,35 ℃±2 ℃培養,24 h後,觀察並進行菌落計數。若無菌生長,則繼續培養至48 h或更長時間後觀察並計數,報告計數單位爲“CFU/mL”。
6.10 10 鑑定技術要求
6.10.1 10.1 微生物鑑定通用的技術要求
b) 儘可能將病原菌鑑定到種(或屬),可採用一種或多種鑑定方法。若實驗室不具備對特殊重要致病菌的鑑定能力,應將其送至有能力鑑定的實驗室或所屬的臨牀檢驗中心進一步鑑定;
c)當鑑定發現具有生物安全危害的病原菌時(如炭疽桿菌、O1羣或O139型霍亂弧菌、布魯桿菌等)應及時上報當地疾病控制中心進行確認;
d)對明確鑑定的、有臨牀意義的致病菌按照相關指南進行藥物敏感試驗(參見WS/T 639和WS/T 497)。
6.10.2 10.2 手工法鑑定的技術要求
常用手工法鑑定試驗的技術要點與要求見表8,開展手工法鑑定時應當注意:
b)根據菌落形態、革蘭染色性、手工生化反應(如葡萄糖發酵、氧化酶、觸酶等)試驗將待測細菌初步分類;
c)進行生化鑑定試驗時,應挑取純菌落,進行觸酶試驗時,不要取到血平板上的瓊脂,進行氧化酶試驗時,不要用在含有染料的培養基(如麥康凱平板、中國藍平板)上或含有葡萄糖的培養基上生長的菌落;
d) 注意培養時間對鑑定試驗結果的影響。如芽管試驗因孵育時間超過3 h,非白念珠菌會出現假陽性;
表8 常用手工法鑑定試驗的技術要點、要求和應用範圍
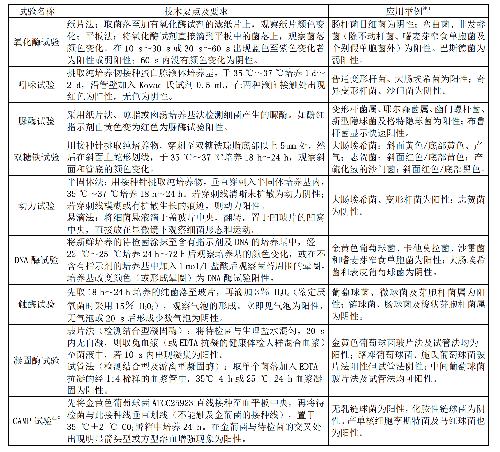
表 8 常用手工法鑑定試驗的技術要點、要求和應用範圍(續)
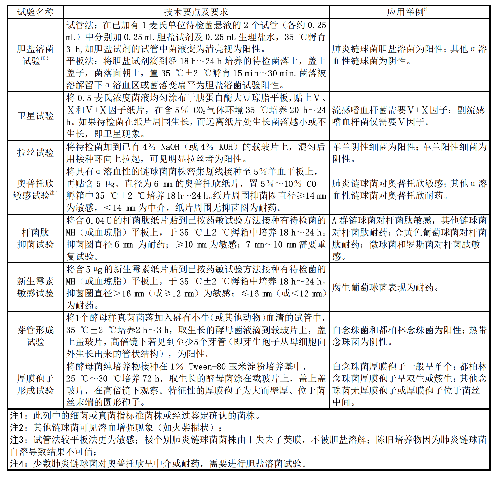
6.10.3 10.3 微生物分析儀鑑定的技術要求
a) 根據手工法初步分類選擇相應的鑑定卡,切忌不進行初步分類直接使用鑑定卡進行鑑定;
b) 儀器提示需增加補充試驗時,應按要求增加相應試驗;
c) 每一批鑑定卡應按要求進行質控,使用前檢查包裝是否有破損,是否在有效期內;
d) 根據製造商對於鑑定數據庫的更新要求,定時更新微生物鑑定系統的數據庫。
6.10.4 10.4 質譜儀器法鑑定的技術要求
a) 待鑑定菌的培養時間應足夠,以滿足其達到所需的量和菌株生長狀態的要求;
c) 靶板塗抹應均勻且厚度適中;
d) 不同的樣本應使用不同的基質和配製溶劑,應避免基質液被污染,基質液應加適當量,並與樣本形成均勻共結晶;
e) 應知曉所用質譜系統數據庫能夠覆蓋的菌屬種類及侷限性,能夠識別並採取措施避免質譜儀可能出現的錯誤鑑定。如將志賀菌屬錯誤鑑定爲大腸埃希菌,將肺炎鏈球菌錯誤鑑定爲緩症鏈球菌羣,將多糖奈瑟菌錯誤鑑定爲腦膜炎奈瑟菌。
6.10.5 10.5 血清凝集法鑑定的技術要求
c) 當生化反應結果與多價血清凝集試驗結果不一致時,應考慮特殊表面抗原的存在。如生化反應符合沙門菌,但A-F多價血清不凝集,應考慮是否存在Vi抗原;又如生化反應符合志賀菌,而與4種多價血清不凝集,應考慮K抗原存在。可將新制成的菌懸液放入沸水浴中加熱15 min~30 min,冷卻後再次做凝集試驗;
d) 注意商品化血清試劑盒的侷限性。若不能分型,需要用其他血清試劑盒或其他方法來分型。
6.11 11 分子檢測技術要求
微生物分子診斷包括以核酸擴增爲核心的熒光定量PCR、巢式PCR、多重PCR、逆轉錄PCR、數字PCR、等溫擴增檢測,以核酸雜交爲核心的基因芯片檢測,以及以測序爲核心的擴增子測序、宏基因組測序、全基因組測序檢測等。不需要單獨進行核酸提取的快速即時檢測技術能做到樣本進、結果出,已應用於微生物檢測。用於微生物分子檢測的技術類型和特點見表9。分子診斷技術因其高靈敏性的特點,需要特別注意避免污染。主要的技術要求有:
a) 基因擴增實驗室需要進行嚴格的物理分隔,設置不同工作區。各區所用的器材(如移液器和吸頭)不可混用。工作流程和空氣流向按照單一方向進行(如試劑貯存和準備區→樣品製備區→擴增區→擴增產物分析區);如使用全自動擴增檢測儀,區域可適當合併;
b)用於分子檢測的標本宜單獨送檢,並注意避免污染。不能及時進行檢測的標本需要進行適當保存;
c) 對提取的核酸,宜採取適當的方法確認核酸片段的完整性、核酸的產率及核酸的純度;
e) 工作結束後應立即對工作區進行清潔,必要時進行消毒及去污染;

6.12 12 免疫學檢測技術要求
針對不同微生物,採取的免疫學檢測方法各異。如膠體金免疫層析法檢測嗜肺軍團菌(抗原)、肺炎鏈球菌(抗原)、幽門螺桿菌(抗原)、布魯桿菌(抗體)及隱球菌(抗原),免疫熒光法檢測艱難梭菌(毒素),酶聯免疫吸附試驗檢測真菌(半乳甘露聚糖),分光光度法檢測革蘭陰性菌(脂多糖內毒素)及真菌{(1-3)-β-D 葡聚糖}等。各免疫學方法的檢測敏感性與技術特點有所不同。主要技術要求包括:
c) 分析可能影響結果的因素及臨牀意義;
e) 根據所用試劑的檢測能力,進行定性或定量結果報告。針對細菌及真菌(成分),目前臨牀微生物實驗室進行免疫學檢測的標本類型、檢測方法和技術特點見表10。
表10 針對細菌及真菌進行微生物免疫學檢測的標本類型、檢測方法及技術特點
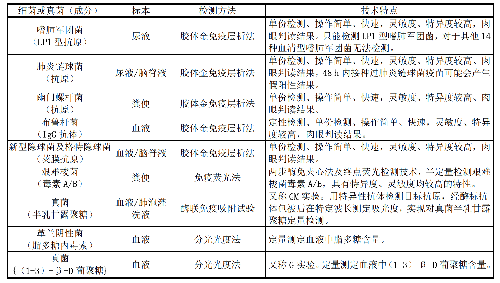
6.13 13 質量保證
6.13.1 13.1 質量管理通用的技術要求
a)臨牀微生物檢驗人員、設備、設施、試劑、耗材、環境等的質量和數量應符合相關規定,滿足所提供服務的需要。PCR實驗室需通過資質認證。實驗室應進行相應的性能驗證及質量控制,並保存記錄;
b)實驗室應遵循法規以及行業標準、規範、指南;制定包括檢驗前、中、後全過程的標準化操作規程,定期審覈、修訂實驗方法,並讓員工易於獲得;
c)應定期進行人員能力評估。由多名專業人員實施的手工檢驗項目應定期進行人員能力比對;
d)制定質量改進目標,如血培養標本質量改進目標。
6.13.2 13.2 微生物檢驗過程質量保證的技術要求
6.13.2.1 13.2.1 檢驗前的技術要求
6.13.2.1.1 13.2.1.1 標本選擇、採集、儲存和運送
d)制定並提供規範的申請單。
6.13.2.1.2 13.2.1.2 標本接收
實驗室應制定標本接收和拒收標準。拒收時立即反饋,以便必要時重新採集。
6.13.2.1.3 13.2.1.3 週轉時間
應告知臨牀醫生標本到達實驗室至發出報告的時間。
6.13.2.2 13.2.2 檢驗中的技術要求
6.13.2.2.1 13.2.2.1 標本質量評估
實驗室應評估標本質量,退檢不合格標本。特殊情況需要檢測不合格標本時,應在報告單中說明。
6.13.2.2.2 13.2.2.2 檢驗方法
a) 未經修改的已確認的檢驗方法(也稱爲檢驗程序,已確認的檢驗方法包括經國家衛生管理部門批准的體外診斷醫療器械使用說明書中的方法,或國家、地區法規規定的方法,或公認的標準、文獻中的方法)在性能驗證滿足要求後,可用於患者標本檢測;
b) 經修改的已確認的檢驗方法或實驗室自建方法,在性能確認滿足要求後,方可用於患者標本檢測。
6.13.2.2.3 13.2.2.3 結果準確性評價
a) 通過參加室間質量評價或實驗室間比對活動評價檢驗結果的準確性。不能進行室間質量評價或實驗室間比對時應通過臨牀評估來評價檢驗結果的準確性。實驗室應保留原始記錄和結果;
b) 檢驗結果準確性評價應由從事常規工作的人員使用與患者標本相同的檢驗方法進行。不可與其他實驗室覈對開展能力驗證的檢測結果。
6.13.2.3 13.2.3 檢驗後的技術要求
6.13.2.3.1 13.2.3.1 結果報告
a)結果報告內容應與檢驗目的一致;
b)按確定的“危急值”清單,及時報告危急值結果,保留報告記錄;
c)宜將藥敏試驗結果分組選擇性報告;
d)應向臨牀提供聯繫方式以便其對可疑結果進行確認,並進行相關諮詢。
6.13.2.3.2 13.2.3.2 菌種保存
6.13.2.3.3 13.2.3.3 標本保存與廢棄處置
7 參考文獻
[1] 國家市場監督管理總局、中國國家標準化管理委員會.醫學實驗室 質量和能力的要求 第1部分:通用要求:GB/T 22576.1-2018.2018.
[2] 國家市場監督管理總局、國家標準化管理委員會.醫學實驗室 質量和能力的要求 第 6 部分:臨牀微生物學檢驗領域的要求:GB/T 22576.6-2021.2021.
[3] 中華人民共和國國家衛生和計劃生育委員會醫政醫管局.全國臨牀檢驗操作規程(第四版).北京:人民衛生出版社,2015.
[4] World Health Organization (WHO). Diagnostic stewardship: a guide to implementation in antimicrobial resistance surveillance sites, 2016.
[5] Clinical Laboratory Standards Institute (CLSI). Principles and Procedures for Detection of Fungi in Clinical Specimens - Direct Examination and Culture; Approved Guideline, M54, 2012.
[6] 中華人民共和國國家衛生和計劃生育委員會.肺結核診斷:WS 288-2017.2017.
[7] 中華人民共和國國家衛生和計劃生育委員會.下呼吸道感染細菌培養操作指南:WS/T 499-2017.2017.
[8] 中華人民共和國國家衛生和計劃生育委員會.尿路感染臨牀微生物實驗室診斷:WS/T 489-2016.2016.
[9] 中華人民共和國衛生部.醫療機構消毒技術規範:WS/T 367-2012.2012.
[10] 中國醫師協會檢驗醫師分會兒科疾病檢驗醫學專家委員會.兒童血培養規範化標本採集的中國專家共識.中華檢驗醫學雜誌,2020,43(5):547-552.
[11] 胡繼紅,馬筱玲,王輝,等.MALDI-TOF MS在臨牀微生物鑑定中的標準化操作專家共識.中華檢驗醫學雜誌,2019,42(4):241-249.
[12] American Society of Microbiology (ASM). Clinical Microbiology Procedures Handbook, Washingtong DC, 2016.
[13] 王輝,馬筱玲,錢淵,等.臨牀微生物學手冊(第12版).北京:中華醫學電子音像出版社,2021.
[14] 沈定霞.醫學重要真菌鑑定指南(第五版).北京:中華醫學電子音像出版社,2016.
[15] 王輝,任健康,王明貴.臨牀微生物學檢驗,北京:人民衛生出版社,2015.