3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 644—2018《臨牀檢驗室間質量評價》(External Quality Assessment/Proficiency Testing in Clinical Laboratory)由中華人民共和國國家衛生健康委員會於2018年12月12日發佈,自2019年06月01日起實施。
4 前言
本標準按照GB/T1.1—2009給出的規則起草。
本標準在GB/T 20470-2006《臨牀實驗室室間質量評價要求》基礎上修訂。
本標準與GB/T 20470-2006相比,主要修改如下:
——修改了術語和定義部分;
——增加了室間質量評價提供者要求;
——增加了室間質量評價參加者要求;
——增加了室間質量評價結果的利用;
——刪除了資料性附錄 A。
本標準起草單位:北京醫院、湖北省臨牀檢驗中心、重慶市臨牀檢驗中心、華中科技大學同濟醫學院附屬同濟醫院、北京和睦家醫院、浙江省臨牀檢驗中心、首都醫科大學附屬北京朝陽醫院、中南大學湘雅醫學院湘雅醫院、上海市臨牀檢驗中心。
本標準主要起草人:王治國、陳文祥、張傳寶、彭明婷、胡繼紅、祝衛平、廖璞、孫自鏞、 孫芾、趙海建、王薇、康鳳鳳、張建平、胡麗濤、楊雪、趙昕。
5 標準正文
5.1 1 範圍
本標準規定了臨牀檢驗室間質量評價提供者要求、參加者要求、室間質量評價結果的利用和評價流程。
本標準適用於開展臨牀檢驗服務的室間質量評價提供者和醫療衛生機構的醫學檢驗科、輸血科,採供血機構的醫學檢驗科,醫學檢驗實驗室等。
5.2 2 術語和定義
下列術語和定義適用於本文件。
2.1
質量 quality
一組固有特性滿足要求的程度。
注1:術語“質量”可使用形容詞如差、好或優秀來修飾。
注2:“固有的”(其反義詞是“賦予的”)就是指存在某事或某物中本身就有的,尤其是那種永久的特性。
[ISO/T 19000 -2016, 3.1.1]
2.2
質量管理的一部分,致力於滿足質量要求。
[GB/T 19000-2016,3.2.10]
2.3
質量管理的一部分,致力於提供質量要求會得到滿足的信任。
[GB/T 19000-2016,3.2.11]
2.4
質量指標 quality indicator
一組內在特徵滿足要求的程度的度量。
注1:質量的測量指標可表示爲,例如,產出百分數(在規定要求內的百分數)、缺陷百分數(在規定要求外的百分數)、百萬機會缺陷數(DPMO)或六西格瑪級別。
注2:質量指標可測量一個機構滿足用戶需求的程度和所有運行過程的質量。如“要求”爲參加者接收的所有尿液樣品未被污染,則收到被污染的尿液樣品佔收到的所有尿液樣品(此過程的固有特性)的百分數就是此過程質量的一個度量。
2.5
計量溯源性 metrological traceability
通過一條形成文件的、具有規定測量不確定度及不間斷的校準鏈,使測量結果與參考標準聯繫起來的特性。
注1:對於該定義,參考標準可以是通過實際復現的某個測量單位的定義,或是包括非序量測量單位的一個測量程
序,或是一個測量標準;
注3:參考標準的技術要求中必須包括利用參考標準建立校準等級圖的時間、以及有關該參考標準的其他計量信息,
注4:對於測量模型中含有一個以上輸入量的測量,其每個輸入量值在計量上應能溯源,相關的校準等級圖可以形成支岔結構或網絡狀。每個輸入量值在建立計量溯源中的工作量,應與該量值對測量結果的貢獻相對應;
注5:測量結果的計量溯源性不能保證測量的不確定度適用於某個特定的目的,或不存在差錯;
注6:如果將比對用於覈查,則兩個測量標準之間的比對可以視爲校準,必要時,可對測量標準之一的量值和測量不確定度進行修正;
注7:ILAC 認爲,確認計量溯源性的要素有:與國際測量標準或國家測量標準相聯繫的一條不間斷的計量溯源鏈;形成文件的測量不確定度;形成文件的測量程序;認可的技術能力;對 SI 的計量溯源性;以及校準的間隔(見ILAC P-10:2002);
注8:簡稱的術語“溯源性”,既可表示“計量溯源性”,有時也可表示其他概念,諸如“樣品溯源性”、“文件溯源性”、“材料溯源性”,這些都代表了一件物品的歷史(溯源)。所以,如有產生混淆的風險時,最好採用術語的全稱“計量溯源性”。
[ISO/IEC Guide 99:2007,定義 2.4.1]
2.6
穩健統計方法 robust statistical method
2.7
偏倚 bias
系統測量誤差的估計。
2.8
準確度 accuracy
2.9
正確度 trueness
無窮多次重複測量所得量值的平均值與一個參考量值間的一致程度。
2.10
測量不確定度 measurement uncertainty/ uncertainty of measurement
注1:測量不確定度包括源自系統影響的不確定度分量,諸如與修正值和測量標準指定量值相伴隨的不確定度分量,以及定義的不確定度。有時,並不修正估計的系統影響,取而代之是將系統影響與伴隨的測量不確定度結合在一起;
注2:參數可以是稱爲標準測量不確定度的標準差(或其特定的倍數),或是具有規定包含因子概率的半寬區間;
注3:測量不確定度通常包含多個分量,其中一些分量可根據系列測量的量值的統計分佈,採用 A 類不確定度評定進行評估,並用標準差表徵。其他一些分量則採用 B 類不確定度評定,由基於經驗或其他信息的概率密度函數進行評估,也可用標準差表徵;
注4:通常,對於給出的一組信息,測量不確定度應伴隨被測量所宣稱的量值,該值的改變也會造成與其相伴的不確定度的改變。
[ISO/IEC Guide 99:2007,定義 2.26]
2.11
能力評定標準差 standard deviation for proficiency assessment
注1:標準差只適用於比例尺度和定距尺度的結果。
注2:並非所有的室間質量評價計劃都根據結果的分散性進行評價。
2.12
離羣值 outlier
一組數據中被認爲與該組其他數據不一致的觀測值。
注:離羣值可能來源於不同的總體,或由於不正確的記錄或其他粗大誤差的結果。
2.13
指定值 assigned value
對質評物的特定性質賦予的值。
注1:在某些定性或半定量計劃中,質評物的特性不是以量值來表示。
注2:指定值的確定有多種方法,以下列出最常用的方法。在大多數情況下,按照以下次序,指定值的不確定度逐漸增大。
a) 已知值——根據特定質評物配方(如製造或稀釋)確定的結果;
b) 有證參考值——根據定義的檢測或測量方法確定(針對定量檢測);
c) 參考值——根據對質評物和可溯源到國家標準或國際標準的標準物質/標準樣品或參考標準的並行分析、測量或比對來確定;
d) 由專家參加者確定的公議值——專家參加者(某些情況下可能是參考實驗室)應當具有可證實的測定被測量的能力,並使用已確認的、有較高準確度的方法,且該方法與常用方法有可比性;
e) 由參加者確定的公議值——使用 ISO13528 和 IUPAC 國際協議中的統計方法,並考慮離羣值的影響。
2.14
實驗室間比對 interlaboratory comparison
按照預先規定的條件,由兩個或多個參加者對相同或類似的物品進行測量或檢測的組織、實施和評價。
2.15
室間質量評價/能力驗證 external quality assessment, EQA/proficiency testing, PT
注1:在本標準中,術語“能力驗證”具有極爲廣泛的含義,室間質量評價等同於能力驗證。
注2:在醫學領域的某些能力驗證提供者,利用術語“外部質量評價(EQA)” 表示其能力驗證計劃和/或更廣義的計劃。但本標準中的要求只適用於符合能力驗證定義的 EQA 活動。
2.16
室間質量評價輪次 external quality assessment round
向參加者發放質評物、評價和報告結果的單個完整流程。
2.17
室間質量評價計劃 external quality assessment scheme
在檢測、測量、校準或檢驗的某個特定領域,設計和運作的一輪或多輪室間質量評價。
注:一項室間質量評價計劃可以包含一種或多種特定類型的檢測、測量、校準或檢驗。
2.18
室間質量評價提供者 external quality assessment provider
2.19
室間質量評價參加者 external quality assessment participant
接受質評物並提交結果以供室間質量評價提供者評價的參加者、組織或個人。
注:在某些情況下,參加者可以是檢驗機構。
2.20
室間質量評價質評物 external quality assessment item
用於室間質量評價的樣品、產品、人工製品、標準物質/標準樣品、設備部件、測量標準、數據組或其他信息。
5.3 3 室間質量評價提供者要求
5.3.1 3.1 組織
3.1.1 室間質量評價提供者或其所在組織,應是一個具有法律地位和能夠承擔法律責任的實體。
3.1.2 有責任確保所提供室間質量評價活動符合本標準要求,並滿足參加者、法定管理機構和對其提供承認的組織的需求。
5.3.2 3.2 管理體系
3.2.1 應建立、實施和保持與其活動範圍相適應的管理體系,這些活動包括所提供室間質量評價的類型、範圍和數量。
3.2.2 對其政策、計劃、程序和指導書的規定以及文件化程度,應能滿足保證室間質量評價各方面質量的需要。體系文件應傳達至有關人員,並被其理解、獲取和執行。
5.3.3 3.3 人員
3.3.1 應有管理和技術人員,他們具有履行其職責所需權限、資源和技術能力。
3.3.2 管理層應規定組織中關鍵崗位所需資格和經驗的最低要求,並確保人員滿足要求。
5.3.4 3.4 室間質量評價計劃的設計
5.3.4.1 3.4.1 策劃
應在室間質量評價計劃開始之前制定文件化的方案,說明本次室間質量評價計劃的目標、目的以及基本設計情況,並提供以下信息,必要時應說明其取捨理由:
a) 室間質量評價提供者的名稱和地址;
b) 協調者以及其他參與室間質量評價計劃設計和運作人員的姓名、地址和聯繫方式;
c) 分包的活動以及參與室間質量評價計劃運作分包方的名稱和地址;
d) 參加計劃應滿足的條件;
f) 所選定的被測量或特性,包括參加者需要鑑別、測量或檢測的有關信息;
i) 對質評物生產、質量控制、存儲、分發的要求;
j) 防止參加者串通或僞造結果的合理預警措施,以及當懷疑串通或僞造時可執行的程序;
k) 將提供給參加者的信息描述,以及室間質量評價計劃各階段時間表;
l) 對於連續室間質量評價計劃,給參加者分發質評物的頻次或日期,參加者返回結果的截止日期,若有必要,參加者進行檢測或測量的日期;
m) 參加者準備檢測材料以及進行檢測或測量所使用的方法或程序的有關信息;
n) 用於質評物均勻性和穩定性檢驗的檢測或測量方法的程序,必要時確定其生物活性;
o) 爲參加者準備其使用的所有標準化報告格式;
p) 所使用統計分析的詳細描述;
r) 參加者能力評價的準則;
t) 參加者結果和根據室間質量評價計劃結果所做結論的公佈範圍描述;
u) 質評物丟失或損壞時應採取的措施。
5.3.4.2 3.4.2 質評物的製備或採購
應建立並執行程序,確保所有質評物以恰當的方式獲得、收集、製備、處置、存儲,需要時包括廢棄物的處理。該程序應確保製備或採購質評物所用材料的獲取符合相關法規和倫理道德要求。
5.3.4.3 3.4.3 均勻性和穩定性
應基於不均勻性和不穩定性對參加者能力評定可能產生的影響,建立合適的均勻性和穩定性判定準則。
5.3.4.4 3.4.4 統計設計
應根據數據的特性(定量或定性,包括排序和分類)、統計假定、誤差的性質以及預期的結果數量,制定和建立符合室間質量評價目標的統計設計。
5.3.4.5 3.4.5 指定值
3.4.5.1 應將確定室間質量評價計劃被測量或特性指定值的程序形成文件。該程序應考慮所需的計量溯源性和測量不確定度,以證明室間質量評價計劃符合其目標。
3.4.5.2 若將公議值作爲指定值,應將原因形成文件,並應根據室間質量評價計劃方案來評估指定值不確定度。
3.4.5.3 應有關於指定值披露的政策。該政策應確保參加者不能從早期的披露中獲益。
5.3.5 3.5 報告
3.5.1 室間質量評價報告應清晰、全面,包含所有參加者結果的資料,並指出每個參加者的能力。
3.5.2 除非不適用或室間質量評價提供者有正當理由,否則報告應包括以下內容:
a) 提供者的名稱和詳細聯繫信息;
c) 報告批准人的姓名、職位、簽名或等效標識;
d) 提供者分包活動的說明;
e) 報告發布日期和狀態(如初期的、中期的或最終的);
f) 報告的頁碼和清晰的結束標記;
g) 結果保密程度的聲明;
h) 室間質量評價計劃報告的編號和清晰標識;
i) 對質評物的清晰描述,包括質評物製備、均勻性和穩定性評定的必要細節;
j) 參加者的結果;
k) 統計數據及總計統計量,包括指定值、可接受結果的範圍和圖形表示;
o) 對應每組參加者使用的檢測方法/程序的指定值和總計統計量(如果不同組的參加者使用了不同的方法);
s) 對統計分析解釋的建議;
t) 基於本輪室間質量評價結果的評述或建議。
注:對於連續室間質量評價計劃,提供較簡單的報告即可,上述很多內容在常規報告中可以省略,但應包含在參加者可獲得的室間質量評價計劃協議或階段性的彙總報告中。
5.4 4 室間質量評價參加者要求
5.4.1 4.1 室間質量評價計劃的選擇
4.1.1 參加者應詳細閱讀並理解室間質量評價計劃書的有關要求。
4.1.2 必須在規定時間內向室間質量評價提供者申請參加某項室間質量評價計劃。
4.1.3 選擇室間質量評價計劃時,應考慮以下因素:
a) 涉及的檢測、測量或校準應與參加者所開展的檢測、測量或校準類型相匹配;
b) 對計劃設計的細節、確定指定值的程序、給參加者的指導書、數據統計處理以及最終總結報告的可獲得性;
c) 室間質量評價計劃運作的輪次;
d) 室間質量評價計劃組織保障方面(如時間、地點、樣品穩定性考慮、樣品發送安排)的適宜性;
e) 接受標準(即用於判定室間質量評價中的滿意表現)的適宜性;
f) 成本;
g) 爲參加者保密的政策;
h) 報告結果和分析數據的時間表;
i) 確信質評物適宜性的特性(如均勻性、穩定性,以及適當時對國家或國際標準的計量溯源性);
j) 與本標準的符合性。
5.4.2 4.2 質評物接收與存儲
4.2.2 根據《室間質量評價活動指導書》,按質評物的性質、存儲要求保存質評物。
5.4.3 4.3 質評物準備與檢測
4.3.1 質評物應由進行常規檢驗的人員檢測,實驗室主任和檢測人員應在室間質量評價提供者提供的工作表上簽字,保證質評物與患者樣品處理方式和安全要求相同。
4.3.2 質評物檢測的次數應與患者樣品常規檢測的次數一致。
4.3.3 要求使用患者樣品檢測的主要檢測系統和常規檢驗方法檢測質評物。
5.4.4 4.4 結果審覈與記錄
4.4.2 應將質評物處理、準備、方法、檢測、審覈等每一步驟形成文件化的記錄。必須保存所有記錄至少 2 年。
5.4.5 4.5 結果回報
4.5.1 應將檢測結果等各項內容逐項填寫回報表,通過“PT/EQA 信息系統”回報給室間質量評價提供者。
4.5.2 質評物檢測項目測量單位(如果測量單位和室間質評組織者要求的不一致需要換算後上報)、有效數字或小數位數按參加者常規檢測項目填報。
4.5.3 在規定回報質評物結果截止日期之前,參加者之間不能進行質評物檢測結果的交流。
5.5 5 室間質量評價結果的利用
5.5.1 5.1 提供者對室間質量評價結果的利用
5.1.1 某一輪次室間質量評價計劃的合格表現可以代表這一次的能力,但不能反映出持續的能力;同樣,在一輪次室間質量評價計劃中的不合格表現,也許反映的是參加者偶然地偏離了正常的能力狀態。正因如此,不能使用室間質量評價作爲唯一的手段。
5.1.2 對報告了不合格結果的參加者,應有政策以:
a) 確保參加者在規定時間內開展調查和評議其能力,並採取適當的糾正措施;
b) (必要時)確保參加者進行後續的室間質量評價以確認所採取的糾正措施有效;
c) (必要時)確保由合適的技術人員對參加者進行現場評價,以確定糾正措施是有效的。
5.1.3 應將對室間質量評價計劃表現不合格可能採取的後續措施告知參加者。這些措施可能包括在規定時間內確認有效糾正措施後維持承認、對相關檢測暫停承認(視糾正措施情況而定),直至撤銷相關檢測的承認。
5.1.4 應有政策,從參加者處獲得對室間質量評價結果所採取的措施,尤其是對不合格結果的措施。
5.5.2 5.2 參加者對室間質量評價結果的利用
5.2.1 參加者應從室間質量評價報告中得出有關自身能力的結論,其間考慮的信息應包括:
a) 質評物的來源和特性;
c) 室間質量評價計劃的組織(如統計設計、重複測試次數、被測量、實施方式);
d) 用於評定參加者能力的準則;
e) 相關的監管、認可或其他要求。
5.2.2 在得到不合格的室間質量評價成績時,應對相關人員進行適當的培訓,對導致室間質量評價失敗的原因進行分析並採取糾正或預防措施。保存文件化記錄至少兩年。
5.2.3 可利用室間質量評價結果向其他相關方證明其能力,例如客戶或分包協議中的相關方。儘管這不是唯一的方式。
5.2.4 在向其它相關方證明其能力時,有責任提供所有相關信息。
5.5.3 5.3 法定管理機構對室間質量評價結果的利用
5.3.1 法定管理機構可利用室間質量評價結果,評價所轄地區參加者的能力。
5.3.2 法定管理機構運作室間質量評價計劃時,應符合本標準要求。
a) 在承認室間質量評價計劃之前,尋求其符合本標準的文件化證據;
b) 與參加者討論室間質量評價計劃的適用性,以便按相關規定恰當地判定參加者的能力。
5.6 6 室間質量評價流程
5.6.1 6.1 室間質量評價計劃書發佈與申請
6.1.1 室間質量評價提供者應在當年發佈下年度室間質量評價計劃書。
6.1.2 室間質量評價提供者應在發放質評物前及早告知參加者質評物將要分發或可能到達的日期。
5.6.2 6.2 室間質量評價計劃輪次和活動內容
6.2.1 每年在大約相同的時間間隔內,室間質量評價輪次應開展三次,特殊檢測項目例外。
6.2.2 每輪次活動應提供 5 份質評物,應具有不同的濃度水平,特殊檢測項目除外。
6.2.3 質評物可通過郵寄方式送達參加者,也可由有關人員攜帶進行現場檢測。
5.6.3 6.3 結果的接收與數據分析
6.3.1 通過“PT/EQA 信息系統”接收參加者回報的檢測結果。
6.3.2 所有的數據處理設備和軟件在投入使用前,應依據程序確認。計算機系統維護應包括備份操作和系統恢複方案,並應記錄維護和運作檢查的結果。
6.3.3 應運用適當的方法記錄和分析參加者提交的結果。應建立和執行程序以檢查數據輸入、傳輸、統計分析和報告的有效性。
5.6.4 6.4 能力評定
6.4.1 室間質量評價提供者應根據室間質量評價計劃目標制定有效評定方法及對評定依據的描述,並形成文件。
6.4.2 參加者不能將質評物送至其他實驗室進行檢測,任一參加者如從其他實驗室收到質評物必須通知室間質量評價提供者。當室間質量評價提供者確認某一參加者將質評物送至其他實驗室進行檢測,則該參加者此輪次室間質量評價成績爲不合格,成績得分爲 0。
6.4.3 參加者在規定的質評物檢測結果回報截止日期前,未能將質評物檢測結果回報給室間質量評價提供者,則本輪次活動該計劃的室間質量評價成績不合格,成績得分爲 0。
6.4.4 參加者每輪次活動某一檢驗項目 PT 成績未能達到 80%(血型未達到 100%)可接受結果,則本輪次活動該檢驗項目室間質量評價成績不合格(微生物學專業除外)。
6.4.5 參加者每輪次活動所有檢驗項目 PT 總成績未達到 80%(血型未達到 100%)可接受結果,則本輪次活動該計劃室間質量評價成績不合格。
5.6.5 6.5 各類室間質量評價計劃具體要求
5.6.5.1 6.5.1 定量檢驗項目
應計算該檢驗項目的偏差,見式(1);或 z 比分數,見式(2):
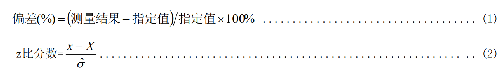
式中:
——與能力評價的目標和目的相符,由專家判定或法規規定(規定值);
——根據以前輪次的室間質量評價得到的估計值或由經驗得到的預期值(經驗值);
——由統計模型得到的估計值(一般模型);
——由精密度試驗得到的結果;
——由參加者結果得到的穩健標準差、標準化四分位距、傳統標準差等。
在每輪次室間質量評價活動中,某一檢驗項目的得分計算公式見式(3):
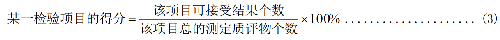
5.6.5.2 6.5.2 定性檢驗項目
在每輪次室間質量評價活動中,某一檢驗項目的得分計算公式見式(4):

5.6.5.3 6.5.3 臨牀微生物學檢驗項目
6.5.3.1 微生物檢驗項目必須包括細菌的分離、鑑定、革蘭染色和藥敏試驗質評物。以確定參加者鑑定試驗及藥敏試驗結果的準確性。
6.5.3.2 對每輪次室間質量評價活動,其得分計算見式(5):

5.6.5.4 6.5.4 正確度驗證計劃
正確度驗證計劃屬於定量計劃的一種,其特點如下:1)質評物爲新鮮(如血細胞計數正確度驗證計劃)或新鮮冰凍樣本(如小分子代謝物、脂類正確度驗證計劃等),與常規臨牀樣本性質接近,無基質效應;2)採用參考方法確定靶值,而非公議值。對參加者不分組,實驗室不能通過串通結果獲得合格成績;3)驗證參加者測量結果的正確度和量值溯源性。
5.6.5.5 6.5.5 質量指標計劃
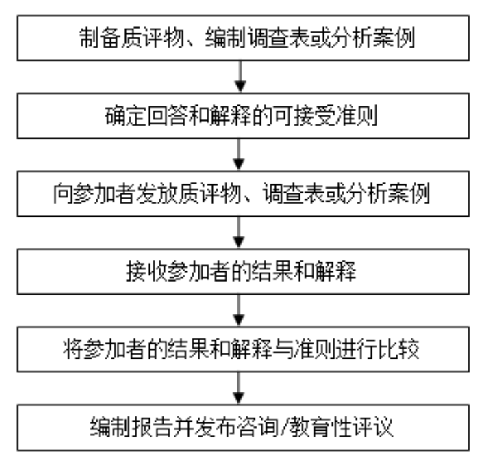
質量指標計劃在評價分析階段的同時,也評價檢驗前和檢驗後的能力。在這類室間質量評價計劃中,與傳統室間質量評價計劃所用質評物的性質可能有很大差異,這些“質評物”可以是一個調查表或分析案例,由室間質量評價提供者發放給每個參加者並要求其反饋特定的答案(見圖1)。
6 參考文獻
[1] Federal Register / Vol.57,No. 40 / Friday, Feburary 28,1992 / Rules and Fegulations.
[2] IFCC: Fundamentals for External Quality Assessment (EQA), Guidelines for Improving Quality by Establishing and Managing EQA schemes. Examples from basic clinical chemistry using limited resources. 1996.
[3] Jean Claude Libeer, et al.Characterization and Classification of External Quality Assessment Schemes(EQA) According to Objectives such as Evaluation of Method and Participant Bias and Standard Deviation. Eur J Clin Chem Clin Biochem 1996, 34:665-678.
[4] 申子瑜主編,楊振華 王治國副主編.醫院管理學 - 臨牀實驗室管理分冊.北京:人民衛生出版社, 2003年5月.
[5] 王治國編著.臨牀檢驗質量控制技術(第3版).北京:人民衛生出版社,2014年6月.
[6] CNAS-GL02 能力驗證結果的統計處理和能力評價指南.中國合格評定國家認可委員會,2014年9月.
[7] CNAS-CL03 能力驗證提供者認可準則(ISO/IEC 17043:2010).中國合格評定國家認可委員會,2011年1月.
[8] 中華人民共和國衛生行業標準 WS/T403-2012 臨牀化學檢驗常規項目分析質量指標. 中華人民共和國衛生部,2012年12月.
[9] 中華人民共和國衛生行業標準 WS/T406-2012 臨牀血液學檢驗常規項目分析質量要求. 中華人民共和國衛生部,2012年12月.
[10] 中華人民共和國衛生行業標準 WS/T496-2017 臨牀實驗室質量指標. 中華人民共和國國家衛生和計劃生育委員會,2017年1月.