3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 640—2018《臨牀微生物學檢驗標本的採集和轉運》(Specimen collection and transport in clinical microbiology)由中華人民共和國國家衛生健康委員會於2018年12月11日發佈,自2019年06月01日起實施。
4 前言
本標準是按照 GB/T 1.1—2009 給出的規則起草。
本標準起草單位:北京大學人民醫院、中日友好醫院、安徽省立醫院、首都醫科大學附屬北京友誼醫院、北京醫院、北京市垂楊柳醫院。
本標準主要起草人:王輝、劉穎梅、張正、馬筱玲、蘇建榮、胡云建、寧永忠、王曉娟。
5 標準正文
5.1 1 範圍
本標準規定了臨牀微生物學(病毒學、細菌學和真菌學)檢驗標本採集和轉運的技術要求。
本標準適用於開展臨牀微生物學檢驗的各級醫療機構及其臨牀微生物學實驗室。
5.2 2 規範性引用文件
下列文件對於本文件的用是必不可少的。凡是註明日期的引用文件,僅所注日期的版本適用於本文件。凡是不註明日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
WS/T 442 臨牀實驗室生物安全指南
WS/T 503 臨牀微生物實驗室血培養操作規範
5.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
微生物學檢驗標本 Clinical Microbiological Specimen
本文件微生物學標本指臨牀病毒學、細菌學和真菌學檢驗(包括塗片鏡檢、培養、抗原、抗體和分子技術等)所用的標本。
3.2
3.3
採樣拭子 Sampling swab
用於採集含病原微生物標本的拭子,由兩部分組成: ① 塗抹棒:柄部常爲塑料或鋁杆,柄部的一端是具有吸附作用的採樣頭,採樣頭材質包括脫脂棉、合成聚酯纖維、聚酰胺纖維、人造絲和泡沫聚氨酯等;② 手柄:位於柄部的另一端,也可作爲轉運裝置(容器或管)的帽。
3.4
轉運 Transport
標本由採樣地點運送到檢驗地點的過程,分爲內部轉運(如使用人工或氣動傳輸等內部送樣方式)和外部轉運(如使用汽車、飛機或火車等外部送樣方式)。
3.5
轉運容器 Transport container
用於盛放轉運培養基和送檢標本的容器。該容器應無菌、無消毒劑及防腐劑、無污染、密封性好及透明以便於從外部觀察。當採樣裝置具備密閉功能,且能有效保護樣本不被污染時,可作爲轉運容器運送標本。
3.6
轉運培養基 Transport medium
液體或半固體的培養基,用於保護和維持標本在轉運期間(從標本採集後到實驗室處理這段時間)的完整性。轉運培養基一般不促進微生物增殖,但保證它們存活。對於苛養菌,可以採用分離培養用的培養基作爲轉運培養基(如羊血瓊脂或巧克力瓊脂等)。
3.7
一套血培養 A set of blood culture
從一個穿刺部位抽取血液,分別注入需氧和厭氧血培養瓶分別進行需氧和厭氧培養。
5.4 4 標本採集、轉運及處理的總原則
5.4.1 4.1 標本採集手冊
實驗室應制定所在機構的臨牀微生物學檢驗標本採集手冊,該手冊提供的信息包括(但不限於)下列內容:
a) 檢驗項目;
c) 適應證;
d) 標本採集部位;
e) 標本類型;
h) 標本的體積或質量;
i) 轉運時限、貯存條件;
l) 生物安全防護信息;
m) 需要獲得的臨牀資料。
5.4.2 4.2 檢驗的申請
4.2.1 樣本採集
依檢驗項目的申請,實驗室應建立臨牀微生物學檢驗的申請程序。檢驗申請單提供的信息包括(但不限於)下列內容:
a) 患者姓名;
b) 患者性別;
c) 患者年齡或出生日期;
d) 患者唯一性標識,如病歷號;
f) 檢驗申請者姓名;
g) 檢驗申請者科室;
h) 標本類型;
i) 標本採集部位;
j) 檢驗項目;
k) 標本採集日期和時間;
m) 臨牀診斷和主要臨牀表現;
a) 無菌體液標本、組織標本、痰標本、支氣管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)、
b) 懷疑隱球菌感染的腦脊液標本:宜同時選擇墨汁染色、隱球菌莢膜多糖抗原檢驗和隱球菌培養;
c) 懷疑分枝桿菌感染的標本:宜同時選擇抗酸染色、分枝桿菌培養和分枝桿菌核酸檢驗;
d) 懷疑厭氧菌感染的標本:宜同時選擇革蘭染色和厭氧培養,不能排除需氧菌時,宜同時做需氧培養;
e) 懷疑諾卡菌感染的標本:宜同時選擇革蘭染色、弱抗酸染色和培養;
f) 懷疑侵襲性真菌感染的標本:宜同時選擇 10% KOH 壓片、真菌培養和真菌抗原檢驗。另可進行乳酸酚棉蘭染色或熒光染色等。
4.2.3 實驗室發佈的標本採集手冊宜對特殊菌的培養要求給予明確說明,以保證醫護人員對採集的標本進行明確標識,檢驗申請單中特殊培養要求包括(但不限於)下列內容:
a) 延長培養時間,例如:血液標本懷疑巴爾通體、布魯菌、弗朗西斯菌等引起的感染,呼吸道標本懷疑諾卡菌引起的感染等;
b) 選擇專用培養基。例如:血液中懷疑分枝桿菌感染宜選擇專用的分枝桿菌培養瓶;
c) 特殊的氣體和溫度環境要求。例如:腦膜炎奈瑟菌和淋病奈瑟菌等需要 CO2環境,彎曲菌和幽門螺桿菌培養需要微需氧環境;懷疑二相真菌感染,宜同時選擇 25 ℃及 37 ℃兩個溫度進行培養。
d) 特定感染宜進行厭氧培養。例如:肝膿腫等封閉膿腫、腹膜炎、腹腔感染和糖尿病足感染等。厭氧菌感染的特徵性表現包括:①局部有氣體產生爲重要指徵之一;②發生在黏膜附近的感染;③深部外傷,如槍傷、人或動物咬傷後的繼發感染;④分泌物有惡臭或暗紅血色或在紫外光下發出紅色熒光,或膿汁中有硫磺顆粒等。
5.4.3 4.3 標本的選擇
4.3.1 實驗室標本採集手冊應詳細描述感染性疾病病原體檢驗的標本類型和臨牀適應證,病原體應包括(但不限於)病毒、細菌和真菌。
4.3.2 選擇標本類型須考慮感染症狀、患者免疫狀態、患者疾病嚴重程度及接受有創檢查的風險、流行病學、可疑病原體的特性和播散能力和受累的器官及感染部位等多方面因素。
4.3.3 適於進行普通細菌、厭氧菌檢驗的標本類型見表 1~表 2。
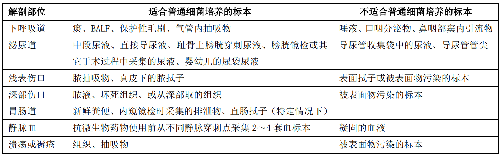
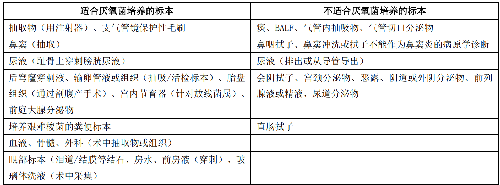
5.4.4 4.4 標本的採集時機、部位、方法
4.4.1 在抗微生物藥物治療之前或者在起始治療後立即採集標本,治療中爲評估治療效果或治療後爲評估結局可以進行相採樣。
4.4.2 應當儘快在疾病初發時採集首份標本。
4.4.3 須避免感染部位周圍以及感染部位附近皮膚或黏膜定植菌羣的污染。
4.4.4 對於有多種細菌定植的部位,宜選擇合適的方法檢驗特定的病原菌,並防止非致病定植菌羣的污染。
4.4.7 除了血液標本外,其他所有標本進行厭氧培養前均應進行革蘭染色(糞便艱難梭菌培養除外)。
4.4.8 無菌體液(例如胸水、滑膜液、心包液和腦脊液)宜放入無菌管或含抗凝劑(注意某些抗凝劑對一些細菌有抑制作用,如果使用,則需告知臨牀其中的影響)的無菌管送檢,也可注入一定量(最好10 mL)的樣品到血培養瓶中進行增菌培養;懷疑細菌或真菌感染時,除了血液標本之外,所有無菌體液標本均宜進行革蘭染色鏡檢。
4.4.9 外科手術標本,宜送液體或組織做塗片和培養,拭子標本僅用於特殊情況。
4.4.10 採集靜脈血時,應首先採集血培養標本,再採集用於其他檢驗的標本。
4.4.11 血標本採集時機見 WS/T 503,痰標本採集時機見 WS/T 499,尿標本採集時機見 WS/T 348。
4.4.12 不宜送檢或接收導尿管的管尖進行培養。
4.4.14 做病毒血清學檢驗時,宜根據不同病毒選擇不同的採集時間和抗體類型;發病早期通常檢驗病毒特異的 IgM 抗體;而對恢復期患者,在疾病急性發作和發作後間隔 2 周~4 周採集雙份血清,檢驗 IgG抗體。
4.4.15 特殊情況下(如懷疑厭氧菌感染時)可以考慮牀旁採樣。
5.4.5 4.5 標本採集量
4.5.1 採集足夠量的標本用於常規細菌學檢驗,至少送檢 0.5 mL 或者 0.5 g(除外特殊標本)。當送檢標本體積不足時,與臨牀溝通,並根據醫囑選擇優先檢驗項目。 腦脊液標本通常 2 mL~5 mL;胸水和腹水 10 mL;BALF 10 mL~20 mL(≥5 mL); 膿液 2 mL~5 mL;羊水、膽汁、關節穿刺液、心包液、胸水、滑膜液大於 1 mL;腹透液 50 mL;眼前房液大於 0.1 mL,玻璃體洗液大於 1 mL。
4.5.2 採集足夠量的標本用於病毒學檢驗,特別是液體標本(如腦脊液和血液),並嚴格遵照臨牀標準的流程操作。腦脊液標本通常 2 mL~5 mL,血液 3 mL~5 mL;
5.4.6 4.6 標本標識
標籤宜由放入冰箱後仍能粘牢的材料製成。標籤貼在容器上,而非容器蓋上。標籤上提供的信息至少包括(但不限於)下列內容:
b) 標本採集日期和時間;
c) 檢驗項目;
d) 標本類型;
e) 急查標本相應的標識(適用時)。
5.4.7 4.7 標本轉運
4.7.1 標本採集手冊應當明確說明某些檢驗項目的特殊轉運方法,以保證醫護人員、標本運送人員在標本採集之前能獲得有關標本採集和轉運的準確信息。
4.7.2 標本的轉運應由經過培訓的專人負責。使用氣動傳輸方式運送標本時,提前確認劇烈震盪、溫度等因素不對檢驗結果產生影響。
4.7.3 標本採集後,應減少運送環節,在規定時間內運達實驗室,並儘可能縮短轉運時間。
a) 用於普通細菌學檢驗的標本:宜在 2 h 內送到實驗室。如果轉運時間超過 2 h,宜使用轉運培養基或在冷藏條件下轉運;一般而言,用於細菌培養的標本室溫下保存不能超過 24 h;血培養標本不可以冷藏轉運;僅用於分子診斷的標本,宜冷藏或冷凍保存(-70 ℃以下最佳,避免反覆凍融)。
b) 標本量較少的體液標本(<1 mL)或組織標本(<1 cm3):宜在 30 min 內送到實驗室。大體積的標本或採集於保存培養基中的標本,可以保存 24 h。
c) 可能分離出對周圍環境敏感細菌的標本:採集後立即送檢。對周圍環境敏感的細菌如百日咳鮑特菌、志賀菌屬、淋病奈瑟菌、腦膜炎奈瑟菌、流感嗜血桿菌、肺炎鏈球菌和厭氧菌。
d) 可能分離出對低溫敏感細菌的標本:採集後不宜冷藏,如腦脊液、生殖道、眼部、中耳及呼吸道標本。對低溫敏感的細菌如淋病奈瑟菌、腦膜炎奈瑟菌、流感嗜血桿菌和肺炎鏈球菌。
e) 用於厭氧菌培養的標本:在常溫下轉運,標本量較少的標本宜在採集後 30 min 內送到實驗室,轉運過程中標本儘可能與空氣隔絕。
a) 用於病毒核酸檢驗的標本:採集後在 2 h~4 h 內送到實驗室。血液標本室溫運送,其他標本在 2 ℃~8 ℃下轉運;若運送時間超過 24 h,標本宜在-70 ℃或更低的溫度下保存和轉運。
b) 用於病毒培養和抗原檢驗的標本:在運送過程中宜保存在適當的病毒轉運液(VTM)或其他相應的緩衝液中。
c) 液體標本:如羊水、血液、腦脊液、尿液和 BALF 等可直接送檢,一般不需使用 VTM 運送。
4.7.6 用於真菌培養的標本(除頭髮、皮膚和指甲宜乾燥送檢外),宜溼潤條件下送檢。
4.7.7 當標本需要進行多種微生物學檢驗時,如病毒、細菌、分枝桿菌和真菌等,分別採樣或將標本分裝至合適的轉運液或容器中。
a) Regan-Lowe 轉運培養基:適用於百日咳鮑特菌和副百日咳鮑特菌的培養。
b) Amies 或 Stuart 轉運培養基:適用於分離腦膜炎奈瑟菌和白喉棒桿菌等。
c) Cary-Blair 轉運培養基:適用於腸道病原菌的檢驗。
a) 病毒轉運液可以由實驗室自行配製或購買。基礎成分包括:Hank 平衡鹽溶液、牛血清白蛋白、L-穀氨酸、HEPES 緩衝液(pH7.3)、酚紅、兩性黴素 B 及抗微生物藥物等。
b) 使用商品化試劑盒進行病毒核酸或抗原檢驗時,遵照生產廠商對標本轉運液或相應運送體系說明進行操作。
4.7.10 標本採集常用的拭子:
a) 聚酯纖維、滌綸或人造絲頭,柄部爲塑料或鋁的拭子:宜用於病毒學檢驗標本的採集。病毒學檢驗標本的採集不宜使用柄部爲木質的拭子。
b) 棉拭子:宜用於支原體檢驗的陰道、宮頸及尿道標本的採集,不宜用於細菌(特別是苛養菌)、衣原體檢驗標本的採集。
d) 植絨拭子:由尼龍纖維經專有的噴霧技術製成,宜用於呼吸道病毒採樣和真菌培養標本的採樣。
e) 藻酸鈣拭子:宜用於衣原體和百日咳鮑特菌鼻咽拭子的採集。但不宜用於脂質包膜病毒及細胞培養的採樣,不宜用於淋病奈瑟菌及解脲脲原體的採樣。
4.7.11 實驗室間轉運標本時,應按照國家有關生物安全標準標識、包裝標本,運送過程符合生物安全規範的要求。運送者應接受培訓,經考覈合格後方可上崗,運送期間配備必要的保護屏障。對於檢驗高致病性病原微生物標本的轉運應當按照《可感染人類的高致病性病原微生物菌(毒)種或樣本運輸管理規定》中的相關要求進行。
5.4.8 4.8 標本接收
4.8.1 標本到達實驗室後記錄接收時間和處理時間。
4.8.3 如果信息不全,實驗室聯繫標本採集部門以獲得缺失的信息。
4.8.4 如果標本標記錯誤或無患者姓名,重新採集標本;當標本不能重新採集時,才允許對標記錯誤的標本進行重新標記;如果是重新標記的標本,在檢驗結果報告中明確標出;如果是歸屬錯誤,則不能重新標記。
4.8.5 及時處理送檢標本,並儘快將所出現的問題通知相關科室。
5.4.9 4.9 標本拒收
4.9.3 拒收容器破損的標本,拒收容器表面嚴重污染的標本,拒收使用不符合專業規範容器採集的標本。
4.9.4 拒收質量評估不合格的標本,合格的標本需滿足相應的質量判斷方法,如:痰(除用於軍團菌和分枝桿菌檢查的標本外):鱗狀上皮細胞<10/低倍視野。
4.9.5 採集部位、轉運容器以及轉運條件不符合要求,宜重新採集標本。表 3 根據標本採集、轉運條件和轉運時間,列出了可接受的標準。
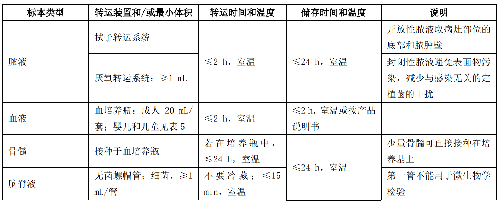
表 3 (續)
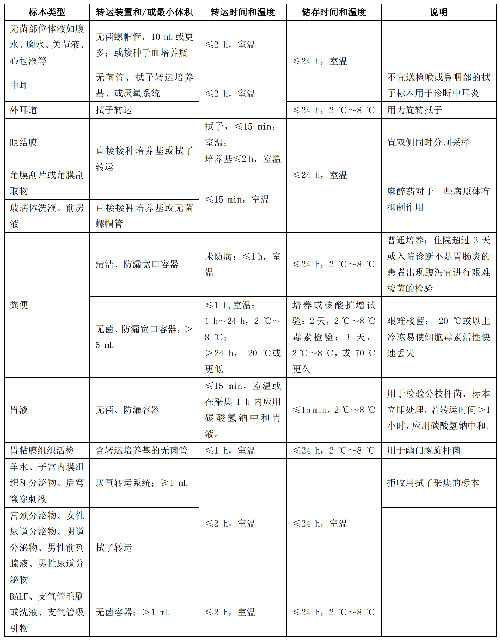
表 3 (續)
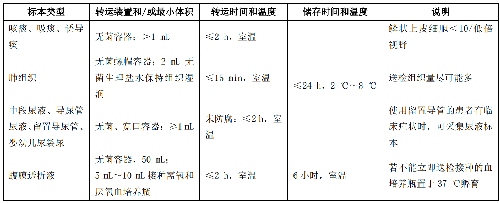
4.9.6 標本拒收時應聯繫臨牀,向其解釋拒收的原因並要求其重新採集合格標本。
4.9.7 實驗室應明確規定哪些情況允許特殊處理不合格標本,規定特殊處理過程中哪些步驟需要覈實和記錄,規定能進行特殊處理的負責人。經特殊處理的不合格標本的檢驗結果,應在檢驗結果報告中明確標出(不合格因素、可能對結果造成的影響等)。
5.4.10 4.10 標本優先處理原則
4.10.1 實驗室建立緊急檢查程序,明確需要緊急處理的標本類型、檢驗項目、標本檢驗順序。
4.10.2 實驗室接收緊急標本後應立即處理。塗片染色鏡檢結果宜在 2 h 內反饋給臨牀。緊急檢查標本包括(但不限於)下列標本:
a) 腦脊液標本(直接塗片結果宜 30 min 內發報告);
5.4.11 4.11 標本的前處理與保存
4.11.1 一些標本在檢查前,須進行前處理。前處理方法包括(不限於):
c) 均質化:當菌體被裹挾或黏附在其他物質內時,將菌體釋放出來。例如咳痰標本培養前宜先消化釋放菌體。組織標本宜採用機械研磨釋放菌體。導管和假體等標本宜通過超聲和機械振盪等方式釋放菌體。拭子標本宜採取振盪等方式,將菌體從纖維絲上釋放出來。
d) 減少干擾:臨牀標本分離培養結核分枝桿菌和非結核分枝桿菌前,採用酸、鹼或其他適宜的方法進行處理。
b) 如無細胞離心機,可使用普通離心機,大於 1.0 mL 的標本 1500 g~2500 g 離心 10 min 後,用移液管吸出上清,剩餘 0.1mL~0.5 mL 沉澱,充分混勻此沉澱後用於檢驗。
c) 血性標本或是明顯的膿液,宜進行直接塗片。塗片薄厚適宜,類似於血液薄膜片。
a) 用於細菌培養的組織、骨或假體標本宜在研磨器裏研磨或超聲處理,組織標本可以使用手工研磨器或自動勻漿器/研磨機;吸取混懸液製備塗片,並接種合適的培養基;
b) 用於真菌培養的組織或骨標本,除了研磨後接種標準培養基外,點種一小塊完整的組織到每塊瓊脂培養基裏面。
4.11.4 所有體液和組織標本,感染導致的膿液、壞疽等均宜做革蘭染色。一些拭子標本,如診斷細菌性陰道病的拭子標本宜做革蘭染色。
4.11.5 實驗室應制定程序保留標本,即使標本已用完,也要保留空容器。標本保存在冰箱或者是超低溫冰箱,無菌標本建議至少要保存 5 天。
具體見WS/T 442。
5.5 5 臨牀常見標本的採集和轉運
5.5.1 5.1 血培養標本
血培養採集指徵、檢驗申請、採集時間、採集套數和採集血量、血培養標本的轉運等參照WS/T 503。
5.1.1 血培養適應證及採集套數
表4 血培養適應證及採集套數

5.1.2 推薦的採集血液體積
5.1.2.1 普通細菌培養:兒童及成人推薦的採血量見表 5。
表5 血培養推薦的採血量

5.1.2.2 分枝桿菌培養:成人患者建議採集 3 次,每次 5 mL(或按介紹要求體積)血液直接注入分枝桿菌專用血培養瓶,室溫下儘快送抵實驗室。
5.1.2.3 酵母菌培養:成人患者採集 2~4 套血培養,每套血培養採集 20 mL~40 mL 血液,宜接種 2個需氧培養瓶,室溫下儘快送抵實驗室。
5.5.2 5.2 用於病毒學檢驗的血液標本
5.5.2.1 5.2.1 方法
5.5.2.2 5.2.2 註釋
a) 血漿核酸檢驗標本選擇抗凝真空採血管,首選的抗凝劑是 EDTA;
c) 病毒分離培養時,取 EDTA 抗凝血 5 mL~10 mL,室溫下運送至實驗室。白細胞分離宜在 8 h內進行。
5.5.3 5.3 腦脊液標本
5.5.3.1 5.3.1 方法
a) 患者去枕側臥位,背部與檢查臺垂直呈 90°,低頭曲頸,使膝部儘量貼近腹部,脊柱前屈,使椎間隙張開便於進針;
b) 確定穿刺點,選擇腰 3~腰 4 椎間隙,穿刺點相當於雙髂後上嵴最高點連線與脊柱中線相交處;
c) 嚴格無菌操作,佩戴無菌手套,使用皮膚消毒劑對腰椎穿刺點及其周圍 15 cm 區域的皮膚消毒,待消毒劑乾燥後(約 1 min)再以 75%的酒精擦拭兩遍;
d) 覆蓋無菌孔巾,待消毒劑徹底揮發後,用 1%~2%利多卡因在穿刺點行皮內、皮下浸潤麻醉,然後垂直緩慢進針椎間棘突間隙,邊回吸邊注藥,回吸注意無回血,充分麻醉後拔針;
e) 左手固定麻醉點,右手進針,對準脊椎間隙刺入皮下,針尖斜向與脊柱平行,穿刺針穿過皮膚、皮下組織、棘上韌帶、棘間韌帶、黃韌帶、硬脊膜,有落空感進入蛛網膜下腔,採集腦脊液分別放入 3 個無菌螺帽管中,做好標本標記;
f) 最小標本量要求:細菌≥1 mL,真菌≥2 mL,分枝桿菌≥5 mL,病毒≥2 mL;
g) 腰椎穿刺採集的第一管腦脊液用於生化學檢驗,第二管用於微生物學檢驗,第三管可以用於細胞學、分子核酸檢驗等。分別放入 3 個無菌螺帽管中,做好標本標記和標清順序。
5.5.3.2 5.3.2 註釋
b) 嬰幼兒:可選擇腰 4~腰 5 或腰 5~骶 1 椎間隙穿刺進針,以免損傷脊髓。
5.5.4 5.4 腹腔標本
5.5.4.1 5.4.1 腹水
c) 常規消毒穿刺點及其周圍 15 cm 區域的皮膚,解開穿刺包,戴無菌手套,覆蓋消毒孔巾;
d) 行局部逐層麻醉後,在麻醉部位垂直刺入,放液或抽液後拔針並敷以無菌紗布;
e) 採集 10 mL 或更多液體,置於無菌容器中,室溫下立即送檢。
5.5.4.2 5.4.2 腹膜透析液
a) 收集 50 mL 腹膜透析液,置於無菌容器中,室溫下立即送檢;
b) 同時牀旁接種 5 mL~10 mL 腹透液,分別打入接種於需氧和厭氧血培養瓶,室溫下立即送檢;
c) 若不能立即送檢,血培養瓶可置於 37 ℃條件下孵育。
5.5.5 5.5 胸水
a) 患者反向坐椅上,兩臂置椅背,前額伏手臂上。不能起牀者,可取半臥位,患側前臂置於枕部;
b) 用超聲或叩診方法定位穿刺點,常規消毒穿刺點及其周圍 15 cm 區域的皮膚,解開穿刺包,戴無菌手套,覆蓋消毒孔巾;
d) 沿肋骨上緣緩慢垂直刺入進針,當針剛進入皮膚,抽空穿刺針後乳膠管內空氣,然後用止血鉗夾閉。當針穿過壁層胸膜時,胸水即被吸入穿刺針後的乳膠管,連接 50 mL 注射器,放開止血鉗即可抽液;
f) 採集 10 mL 或更多液體,置於無菌容器中,室溫下立即送檢。
5.5.6 5.6 組織標本
5.5.6.1 5.6.1 外科手術採集的組織標本
b) 採集足夠量的組織標本,微生物學檢驗所需的標本量≥1cm3爲宜。
c) 選擇合適的採樣方法以區別污染和真正的感染。例如:骨科人工關節修復手術,在同一個手術部位不同的區域採集 5 塊分開的組織,分別放置於五個容器並分別做 5 份培養。若來自同一個手術部位的三塊或更多的組織生長相同的菌,那麼該菌可能是關節的病原菌而非污染菌。
d) 選擇無菌保溼容器運輸組織,小塊組織宜用 2 mL 無菌水或生理鹽水保溼;特別小塊的組織標本宜放在一個方形潤溼的無菌紗布裏送檢。
e) 組織厭氧菌培養,宜採用厭氧轉運管或厭氧轉運瓶運送;大塊組織標本可直接用於厭氧培養。
5.5.6.2 5.6.2 經支氣管鏡肺活檢的組織標本
b) 經鼻導入支氣管鏡到達病變所在的肺段或亞段後,將活檢鉗插入所選擇的亞段支氣管內,穿過支氣管壁至病變區;
c) 打開活檢鉗推進少許,在患者呼氣末關閉活檢鉗獲得標本,緩緩退出;
d) 將取出的組織放入 2 mL 無菌鹽水的無菌容器中,立即送到實驗室。
5.5.6.3 5.6.3 CT 引導下經皮穿刺肺活檢組織標本
a) 根據 CT 顯示病變的部位選擇相對舒適的體位;
b) 確定穿刺點、進針方向、角度及深度,根據病竈位置選定穿刺針的型號和長度;
c) 穿刺點常規消毒,待消毒劑徹底揮發後,行局部麻醉至胸膜,保留針頭再次局部掃描確認進針深度和角度;
d) 在患者屏氣時快速進針至病竈後再次對病竈掃描,當穿刺針尖達到預定位置後切割取材;
e) 切割獲得的(1.0~2.0)cm×0.1 cm 大小的組織標本,放入 2 mL 生理鹽水無菌容器內送微生物實驗室。放入 10%甲醛固定液內送病理科,甲醛處理後的標本不能進行微生物學檢查。
5.5.6.4 5.6.4 心律植入裝置感染標本(囊袋組織、贅生物、起搏器)
a) 行起搏器拔除術,切開囊袋部位,採用無菌操作採集培養標本。取樣前不要應用抗微生物藥物對囊袋內進行清創消毒。
b) 囊袋組織:打開囊袋後,用新更換的無菌工具取囊袋內組織塊約 2 cm2,放入帶螺帽無菌容器中,加入適量生理鹽水,浸沒囊袋組織,旋緊螺帽立即送檢。
c) 心律植入裝置:起搏器、導線等心律植入裝置也可以作爲標本送培養。將術中拔除的起搏器和導線立即放入螺帽無菌容器中,送至實驗室檢驗。
d) 贅生物:對於導線上附着的贅生物可將其連帶導線一齊剪下,放入帶螺帽無菌容器中,加入可浸沒標本的生理鹽水,旋緊螺帽立即送檢。
e) 對於導線這類細長標本,從患者體內拔出後儘快放入無菌容器中,全過程避免導線不慎觸到手術檯、患者皮膚等部位。
5.5.6.5 5.6.5 關節假體周圍感染標本(關節假體、關節液及假體周圍組織)
5.5.6.5.1 5.6.5.1 關節液
a) 術前穿刺:患者仰臥於手術檯上,下肢半屈曲位。穿刺部位按常規進行皮膚消毒,待消毒劑徹底揮發後,用局部麻醉藥作局部麻醉。用注射器,一般於髕骨外上方,由股四頭肌腱外側向內下刺入關節囊;或於髕骨下方,由髕韌帶旁向後穿刺達關節囊。術後用消毒紗布覆蓋穿刺部位,再用膠布固定。
b) 術中穿刺:同翻修手術同時進行,患者全麻後,消毒鋪巾切開皮膚、皮下脂肪組織達關節囊,用注射器穿刺抽取關節液。
5.5.6.5.2 5.6.5.2 假體
5.5.6.5.3 5.6.5.3 假體周圍組織
術中取假體後,更換手術刀採集 4~5 塊組織,分別置於不同的無菌小瓶中,並標明每塊組織的部位或編號。
5.5.6.5.4 5.6.5.4 註釋
a) 引起假體關節周圍感染的病原菌可形成生物膜,建議臨牀在翻修術中同時送檢假體、假體周圍組織和關節液;
b) 術前普通關節液穿刺培養宜在停用抗微生物藥物 2 周後採集,以提高培養陽性率。
5.5.7 5.7 尿液標本
5.5.7.1 5.7.1 導尿管尿液標本
5.5.7.1.1 5.7.1.1 採集直接導尿管尿液
c) 棄去先流出的 15 mL 尿液之後,採集尿液到無菌螺帽容器或硼酸轉運管。
5.5.7.1.2 5.7.1.2 採集留置導尿管尿液
a) 夾住導尿管 10 min~20 min 後,用 75%酒精消毒導管採集部位;
5.5.7.2 5.7.2 中段尿液
a) 用肥皂水或清水清洗外陰後,分開陰脣(女性),縮回包皮(男性),開始排尿;
5.5.7.3 5.7.3 用於分子診斷的清晨首次尿液
a) 留取少於 30 mL 的清晨首次尿液;
b) 尿液採集到無菌容器或核酸擴增試驗廠商提供的專用轉運培養基內送檢。
5.5.7.4 5.7.4 恥骨上膀胱穿刺尿液
b) 待消毒劑徹底揮發後,麻醉穿刺部位(恥骨上 2 cm 或 2 橫指);
5.5.7.5 5.7.5 嬰幼兒尿液的收集
b) 分開兒童雙腿;
c) 用肥皂和水清洗恥骨和會陰區,使之乾燥,無粉末、油和護膚品等污染物;
e) 對於女性兒童,拉緊會陰部皮膚,將膠條緊壓於外生殖器四周的皮膚上,固定收集袋於直腸與陰道之間的位置,避免來自肛門區域的污染;對於男性兒童,將收集袋套於陰莖上,將膠條壓緊於會陰部皮膚上;
f) 確保膠條牢固地粘於皮膚,膠條的粘貼無皺摺;
g) 定時察看收集袋中的尿液(如每隔 15 min);
5.5.7.6 5.7.6 標識
a) 申請單上註明標本採集自留置導尿管、直接導尿管、穿刺尿液等。若爲穿刺尿液需註明是否進行厭氧培養。
b) 申請單上標明患者是否有症狀,是否使用了抗微生物藥物及種類。
5.5.7.7 5.7.7 註釋
a) 拒收導尿管和長期留置導管的導管尿液;
b) 通常情況下,帶有留置管的患者 48 h~72 h 就會有定植菌,且常爲多種細菌;
d) 僅在臨牀申請時進行厭氧培養;
5.5.8 5.8 支氣管鏡標本(支氣管毛刷、BALF)
5.5.8.1 5.8.1 方法
c) 用局部麻醉藥潤滑患者兩個鼻孔及支氣管鏡,經鼻或經口(氣管插管或切開患者經人工氣道)導入支氣管鏡。根據影像學或支氣管鏡下表現,選取病變段嚴重區域進行灌洗或採樣。
d) BALF:將支氣管鏡頂端緊密嵌頓在目標支氣管段或亞段開口,末端連接無菌樣本採集杯和負壓吸引器。經操作孔道分 5 次快速注入總量爲 60 mL~100 mL 的 37 ℃或室溫滅菌生理鹽水,每次灌入 20 mL~50 mL 生理鹽水後,以合適的負壓(推薦小於 -100 mmHg 的負壓)吸引回收灌洗液,可直接使用標本採集器送檢,也可在無菌操作下吸取 10 mL~20 mL BALF(≥5 mL)到帶螺帽無菌容器中,立即送檢。
注:每次回吸收量不低於灌入量的5%(總回收率以≥30%爲宜)。若每次的回收率均<5%,則要及時停止灌洗以免液體大量瀦留於肺內。兒科患者只能灌入(1 mL~2 mL)/kg,通常兒童的回收量不超過10 mL,大於10 mL的兒童標本可離心提高陽性率。
e) 支氣管毛刷:將檢查用毛刷插入支氣管鏡,推進毛刷直至推出護套,刷取標本後將刷子抽回護套,取出整個毛刷,用無菌剪刀將刷子頭剪下,放入 1 mL 生理鹽水或乳酸鈉林格溶液中,立即送實驗室。
f) 支氣管吸引物:通過支氣管鏡直接抽吸呼吸道較大管道內的分泌物。
5.5.8.2 5.8.2 註釋
a) 支氣管鏡取材的標本會受到上呼吸道菌羣的污染,宜進行質量評估;
b) 支氣管毛刷標本大概含有 0.001 mL 到 0.01 mL 的分泌物,爲避免分泌物乾燥引起細菌死亡,毛刷迅速置於 1 mL 的無菌鹽水中;
c) BALF 標本必須定量培養,定量結果與臨牀的相關性優於痰標本;
5.5.9 5.9 痰
5.5.9.1 5.9.1 咳痰
d) 指導患者用力咳出深部痰,勿將唾液和鼻後分泌物當作痰送檢;
e) 立即蓋好蓋子並擰緊,立即送檢;
f) 最好選擇晨起漱口後,咳出的深部痰送檢。
5.5.9.2 5.9.2 誘導痰
a) 當咳嗽無痰或少痰時,可採集誘導痰;
d) 用超聲霧化器,患者吸入 3% NaCl 約 3 mL~5 mL;
5.5.9.3 5.9.3 氣管吸引物
5.5.9.4 5.9.4 註釋
b) 痰標本不能進行厭氧培養;
c) 痰塗片革蘭染色鏡檢對痰培養結果具有參考價值。
5.5.10 5.10 鼻咽拭子
5.5.10.1 5.10.1 方法
c) 當遇到阻力後即到達後鼻咽,停留數秒吸取分泌物;
d) 輕輕旋轉取出拭子,置於轉運培養基中;
e) 用於病毒學檢驗的拭子,將拭子頭浸入病毒運送液,尾部棄去,旋緊管蓋;
f) 用於細菌學檢驗的拭子,插回採樣裝置或適宜的轉運裝置中。
5.5.10.2 5.10.2 註釋
a) 不推薦鼻咽拭子做普通細菌培養,特殊細菌除外,如百日咳鮑特菌、腦膜炎奈瑟菌。
b) 若懷疑百日咳鮑特菌感染,需提前通知實驗室,準備特殊的轉運培養基(Regan-Lowe)。條件許可時可提供接種培養基,直接牀旁接種後轉運至實驗室。
5.5.11 5.11 口咽拭子
5.5.11.1 5.11.1 方法
a) 請患者坐下,頭後傾,張大嘴,去除鼻前孔中表面的分泌物;
b) 採樣者用壓舌板固定舌頭,用滌綸或藻酸鈣拭子越過舌根到咽後壁及扁桃體隱窩、側壁等處;
c) 反覆擦拭 3~5 次,收集粘膜細胞;
e) 拭子插回採樣裝置中或適宜的轉運裝置中。
5.5.11.2 5.11.2 註釋
a) 對化膿性咽炎,口咽拭子細菌培養主要用於篩查 A 羣β-溶血鏈球菌和溶血隱祕桿菌;
b) 當檢驗口咽拭子中的淋病奈瑟菌時,臨牀需提前告知實驗室;
d) 一般情況下,不單獨選用咽拭子標本診斷上呼吸道感染,宜與鼻咽拭子或鼻咽吸取物聯合檢驗以提高呼吸道感染的病原檢出率。
5.5.12 5.12 糞便標本
5.5.12.1 5.12.1 送檢原則
b) 排除一些病原體的攜帶狀態,需要連續 3 份標本陰性。若需要連續採集 3 份標本,則兩次採集標本間隔 48 h。
5.5.12.2 5.12.2 方法
a) 將糞便排入乾燥清潔的便盆,避免使用坐式馬桶或蹲式便盆。糞便標本中不宜混入尿液及其它異物,採集過程儘量無菌操作;
b) 用無菌竹籤挑取標本中異常部分(有粘液、膿液和血液的部分)2 mL~5 mL 糞便懸液或 2 g~5 g 糞便標本置於無菌螺帽容器中,立即送檢。
5.5.12.3 5.12.3 標識
申請單上建議標註特殊病史。
5.5.12.4 5.12.4 標本拒收
a) 乾燥的拭子、含鋇糞便、黃軟成形便、幹便或明顯污染的糞便;
b) 一天內重複送檢的標本;
c) 未使用運輸培養基,採集後室溫條件下超過 2 h 未送檢的糞便;
d) 使用運輸培養基,4 ℃條件下保存超過 48 h 或 35 ℃條件下保存超過 24 h 未送檢標本。
5.5.12.5 5.12.5 註釋
a) 糞便標本常規不進行厭氧培養;
d) 下列腹瀉患者宜連續 3 天送檢標本:社區獲得性腹瀉(入院前或 72 h 內出現症狀)。醫院獲得性腹瀉(入院 72 h 後出現症狀),且至少有下列情況之一:大於 65 歲並伴有基礎疾病、HIV感染、粒細胞缺乏症(中性粒細胞<0.5×109/L)及疑似院內暴發感染時。
5.5.13 5.13 直腸拭子和肛拭子
5.5.13.1 5.13.1 送檢原則
a) 嬰兒或重症患者腹瀉時且暫時沒有糞便,纔可採集直腸拭子標本檢驗腹瀉病原菌;
c) 常規培養通常針對沙門菌屬和志賀菌屬,國際上還包括彎曲菌屬。如果懷疑其他細菌感染,宜先諮詢實驗室。
5.5.13.2 5.13.2 方法
a) 無菌棉拭子用生理鹽水溼潤,輕輕地插入肛門括約肌上方(約 6 cm~7 cm),旋轉,取出,置於運輸培養基中,拭子上可見糞便;
b) 對於淋病奈瑟菌培養,採集肛環內的肛竇部位,儘量避免糞便污染;
c) 立即將淋病奈瑟菌培養拭子置於運輸培養基中, 或在患者牀邊接種。
5.5.13.3 5.13.3 標識
5.5.13.4 5.13.4 註釋
a) 如果懷疑患者感染大腸埃希菌 O157:H7、耶爾森菌屬、弧菌屬、氣單胞菌屬或鄰單胞菌屬,宜通知實驗室;
5.5.14 5.14 子宮頸內或宮頸標本
a) 用溫鹽水溼潤陰道窺器;
b) 使用陰道窺器輕輕按壓子宮,打開窺器,使用藻酸鈣、滌綸或沒有毒性的棉拭子採集分泌物。或者打開窺器,將拭子插入宮頸管 1 cm~2 cm,轉 2 圈~3 圈採集分泌物,必要時停留 20 s~30 s 並轉動取樣;
5.5.15 5.15 男性泌尿生殖道標本
a) 從尿道擠壓分泌物,一根拭子採集分泌物用於培養,保存於轉運培養基中送檢。另一根拭子採集分泌物用於塗片,將拭子在玻片表面滾動 2 cm~3 cm。
b) 若無分泌物,可將泌尿生殖道拭子插入尿道約 2 cm,輕輕旋轉取出。將標本儘快接種於特殊培養基,並置於 35 ℃ CO2環境中培養。接種後的拭子製備塗片用於染色,最好採集兩個拭子分別用於塗片和培養。
c) 尿道分泌物革蘭染色查到白細胞內革蘭陰性雙球菌可作爲男性淋病患者的診斷依據。
5.5.16 5.16 眼科標本
5.5.16.1 5.16.1 方法
a) 結膜囊分泌物:將植絨拭子用病原體保存液或無菌生理鹽水預溼,由內眥部開始從內到外旋轉輕拭下方結膜囊和下瞼結膜表面(注意內眥部), 採集後立即接種培養基或立即轉運;接種後製備塗片,將拭子在載玻片上自內而外滾動塗成直徑 1.0 cm~1.5 cm 的近圓形。
b) 角膜及結膜刮片:由眼科專業人員採集,角膜刮片推薦用 15 號手術刀片刮取潰瘍基底部、潰瘍進行緣或損傷部位,將刮取物直接接種於培養基;瞼結膜刮片宜翻轉上瞼暴露瞼結膜,固定後,垂直刮擦組織。將刮取物直接塗抹於載玻片上,儘量均勻塗開。
c) 房水及玻璃體液:由眼科專業人員採集,將無菌注射器中的標本直接接種於培養基或液體增菌培養基,常規進行苛養菌、真菌及厭氧菌培養,同時直接製片或甩片製片。
5.5.16.2 5.16.2 標識
a) 使用具體的解剖部位及類型描述來自眼部的標本,如左眼、右眼、角膜/結膜分泌物、角膜/結膜刮取物、結石、前房液、玻璃體標本等;
b) 註明臨牀診斷。
5.5.16.3 5.16.3 轉運
所有標本均應當迅速送至實驗室。
5.5.16.4 5.16.4 註釋
a) 角/結膜刮取物、前房及玻璃體抽吸液量很少,宜在診室或患者牀邊採集標本後直接接種培養皿和製備塗片;
b) 結膜感染時,即使只有一隻眼睛感染,也宜對兩眼的結膜取樣,有助於正常定植菌與致病菌的判斷;
c) 結膜刮片採樣可在使用不含防腐劑的表面麻醉劑後進行,用於細菌、真菌、沙眼衣原體、病毒和阿米巴等培養;分泌物採集不建議使用麻醉藥。
5.5.17 5.17 耳標本
5.5.17.1 5.17.1 方法
a) 取中耳標本時,若鼓膜完整,先用肥皂水清潔耳道,再行鼓膜穿刺術用注射器抽出中耳內液體;
b) 取中耳標本時,若鼓膜穿孔,通過耳鏡用軟杆的採樣拭子收集液體(僅限於需氧培養);
c) 外耳道:用溼拭子將耳道的碎屑或硬皮除去,用一新拭子在外耳道用力旋轉拭子取樣。
5.5.17.2 5.17.2 註釋
b) 中耳滲出液直接塗片革蘭染色對臨牀很有幫助。
5.5.18 5.18 皮膚、結締組織及傷口標本
a) 閉合性膿腫:消毒皮膚後,用注射器抽取膿腫物,無菌轉移所有抽吸物至厭氧和需氧轉運裝置中。
b) 開放性膿腫:用無菌生理鹽水或 75%酒精擦拭去除表面分泌物,儘可能採集抽吸物,或將採樣拭子插入至病竈的底部或膿腫壁取其新鮮邊緣部分。
c) 膿皰或水皰:酒精消毒揮發後,挑破膿皰,用拭子收集膿液;較大的膿皰消毒後宜直接用注射器抽取。陳舊的膿皰,去除損傷表面,用拭子擦拭損傷基底。
d) 蜂窩織炎液化後宜先注射無菌生理鹽水隨後抽吸,可以獲得足量的標本進行培養。若患者病情迅速進展,或蜂窩織炎沒有液化則需要採集組織活檢標本。
e) 傷口標本:區分淺表傷口標本、深部傷口標本及外科手術傷口標本。宜從感染進展的前緣採集活檢標本。活檢標本和抽吸物(膿液、滲出液)優於拭子標本;淺表傷口標本不能進行厭氧培養。
f) 燒傷傷口:清潔並清除燒傷創面,有液體滲出時,用拭子擦拭取樣。燒傷的組織宜做定量培養,定量檢驗結果≥105 CFU/g 則可預示有可能進展爲創傷相關膿毒症。
6 參考文獻
[1] American Society for Microbiology. Manual of clinical microbiology. 11th Edition. 2015
[2] American Society for Microbiology. Clinical Microbiology procedures handbood. 3rd edition. 2010
[3] Baron EJ, Miller JM, Weinstein MP, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM). Clin Infect Dis. 2013;57:e22-e121
[4] Johns Hopkins Medical Microbiology. Specimen collection guidelines. 2013
[5] American Society for Microbiology. A guide to specimen management in clinical microbiology. 2nd edition. 1998
[6] American College of Physicians. Expert Guide to Infectious Diseases.2nd edition. 2002
[7] 中華人民共和國國家衛生和計劃生育委員會. 可感染人類的高致病性病原微生物菌(毒)種或樣本運輸管理規定. 中華人民共和國衛生部令第45號. 2005
[8] Nair B, Stapp J, Stapp L, et al. Utility of gram staining for evaluation of the quality of cystic fibrosis sputum samples. J Clin Microbiol. 2002;40:2791–2794.
[9] CLSI. Principles and procedures for blood cultures; approved Guideline. CLSI document M47-A. 2007.
[10] Osmon DR, Berbari EF, Berendt AR, et al. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2013;56:e1-e25.
[11] Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63:e61-e111.
[12] CLSI M40-A2. Quality control of microbiological transport systems; approved standard, 2nd edition.(2014)
[13] CLSI M54-A. Principles and procedures for detection of fungi in clinical specimens direct examination and culture; approved guideline.(2012)
[14] WS/T 503—2017 臨牀微生物實驗室血培養操作規範