3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 639—2018《抗菌藥物敏感性試驗的技術要求》(Technical specification on antimicrobial susceptibility tests)由中華人民共和國國家衛生健康委員會於2018年12月11日發佈,自2019年06月01日起實施。本標準代替 WS/T 125-1999,WS/T 248—2005。
4 前言
本標準按照 GB/T 1.1—2009 給出的規則起草。
本標準代替 WS/T 125-1999《紙片法抗菌藥物敏感試驗標準》和 WS/T 248-2005《厭氧菌的抗微生物藥敏感試驗方法》。本標準整合了 WS/T 125-1999 和 WS/T 248-2005 的內容,並做了以下變化:
——增加了常規藥敏試驗報告原則和報告格式;
——增加了稀釋法、梯度擴散法和自動化儀器法等其他藥敏試驗檢測方法;
——增加了少見菌藥敏判定標準和商品化藥敏試驗檢測系統的性能驗證;
本標準起草單位:北京大學人民醫院、安徽省立醫院、首都醫科大學附屬北京友誼醫院、北京醫院。
本標準主要起草人:王輝、張正、馬筱玲、胡云建、蘇建榮、王曉娟、陳宏斌、李荷楠。
本標準實施之日起,WS/T 125-1999 和 WS/T 248-2005 廢止。
5 標準正文
5.1 1 範圍
本標準規定了臨牀抗菌藥物敏感性試驗的技術要求,包括常規藥敏試驗的藥物選擇和報告、藥敏試驗方法、各種屬細菌藥敏試驗、常見菌特殊耐藥表型檢測、藥敏試驗的質量控制、商品化藥敏試驗檢測系統的性能驗證。
5.2 2 術語和定義
下列術語和定義適用於本文件。
2.1
抗微生物藥物敏感性試驗 Antimicrobial susceptibility testing
檢測微生物(本文件特指細菌)對抗微生物藥物(本文件特指抗菌藥物)的體外敏感性,以指導臨牀合理選用藥物的微生物學試驗,簡稱藥敏試驗。
2.2
最低抑菌濃度 Minimal inhibitory concentration;MIC
在瓊脂或肉湯稀釋法藥物敏感性檢測試驗中能抑制肉眼可見的微生物生長的最低抗菌藥物濃度。
2.3
折點 Breakpoint
能預測臨牀治療效果,用以判斷敏感、中介、劑量依賴型敏感、耐藥、非敏感的最低抑菌濃度(MIC)或者抑菌圈直徑(mm)的數值。
2.3.1
敏感 Susceptible;S
當抗菌藥物對分離株的MIC值或抑菌圈直徑處於敏感範圍時,使用推薦劑量進行治療,該藥在感染部位通常達到的濃度可抑制被測菌的生長,臨牀治療可能有效。
2.3.2
中介 Intermediate;I
當菌株的MIC值或抑菌圈直徑處於中介時,該數值接近藥物在血液和組織中達到的濃度,從而治療反應率低於敏感菌羣。該分類意味着採用高於常規劑量治療時或在藥物生理濃集的部位,臨牀治療可能有效。該分類同樣可作爲“緩衝域”,以防止由微小、不可控的技術因素導致的重大偏差,尤其是毒性範圍較窄的藥物。
2.3.3
劑量依賴型敏感 Susceptible-dose dependent;SDD
細菌菌株對抗菌藥物的敏感性依賴於抗菌藥物的劑量。當某種藥物對菌株的MIC或抑菌圈直徑在SDD範圍時,臨牀可通過提高劑量和(或)增加給藥頻率等修正給藥方案以達到臨牀療效。
2.3.4
耐藥 Resistant;R
當抗菌藥物對分離株的MIC值或抑菌圈直徑處於該分類範圍時,使用常規治療方案,該藥在感染部位所達到的藥物濃度不能抑制細菌的生長,和(或)被測菌株獲得特殊耐藥機制,且治療性研究顯示該藥臨牀療效不確切。
2.3.5
對於那些因未現或罕現耐藥,而僅具有敏感折點的抗菌藥物, 當該藥對某分離株的MIC值高於或抑菌圈直徑低於敏感折點時,此分類爲非敏感。
2.4
流行病學界值 Epidemiological cutoff value;ECV
將微生物羣體區分爲有或無獲得性耐藥的MIC值或抑菌圈直徑,是羣體敏感性的上限。根據ECV,可將菌株分爲野生型和非野生型。
2.4.1
野生型 Wild-type;WT
根據ECV值,將抗菌藥物(包括抗真菌藥物)評估中未獲得耐藥機制或無敏感性下降的菌株定義爲野生型。
2.4.2
非野生型 Non-wild-type;NWT
根據ECV值,將抗菌藥物(包括抗真菌藥物)評估中獲得了耐藥機制或存在敏感性下降的菌株,定義爲非野生型。
2.5
效價 Potency
抗菌藥物中具有抗菌活性的成分,通過同類標準物質測定得出。單位mg/g、IU/g或用百分比表示。
2.6
基本一致性 Essential agreement;EA
待測MIC系統與參考方法MIC值相差不超過1個稀釋倍數。當待評估方法爲紙片擴散法時,不計算EA。
2.7
分類一致性 Categorical agreement;CA
被評估藥敏方法與參考方法判斷試驗結果爲敏感、中介、耐藥的一致性。
2.8
極重大誤差 Very major error;VME
2.9
重大誤差 Major error,ME
2.10
小誤差 Minor error
2.11
常規藥敏試驗 Routine test
2.12
補充(非常規)藥敏試驗 Supplemental (not routing) test
通過常規紙片擴散法、肉湯或瓊脂稀釋法以外的方法檢測某種或某類藥物的敏感性或耐藥性,且該方法無需額外試驗確證藥物的敏感性或耐藥性。
2.13
篩選試驗 Screening test
提供假定結果的試驗。當篩查結果陽性時,需進行附加試驗進行確認。
2.14
替代藥物試驗 Surrogate agent test
當目標抗菌藥物的藥敏無法檢測或替代藥物的藥敏檢測性能優於目標藥物時,該藥物可替代目標藥物進行藥敏試驗。
2.15
等效藥物試驗 Equivalent agent test
某藥可預測與其密切相關的同類藥物的藥敏結果,測定該藥的藥敏試驗可減少其他相關藥物的檢測數量以提高檢測效率。
5.3 3 常規藥敏試驗的藥物選擇和報告
5.3.1 3.1 藥敏試驗測試藥物的分組
B組:常規測試,但只選擇性報告的基本抗菌藥物,例如當對A組同類藥物耐藥時。選擇性報告指徵還包括:特定部位分離菌(如三代頭孢菌素對腦脊液中腸桿菌科菌)、混合感染、多部位感染、患者對A組藥物過敏/不耐受/無反應、出於感染控制目的。
C組:包括替代性或補充性的抗菌藥物。在某些醫療機構,地方或流行菌株對A組/B組多個藥物耐藥時,需測試該組藥物;當對基本測試藥物過敏、或測試少見細菌時、或流行病學和感染控制需要時,需測試的補充藥物。
各級實驗室結合當地病原譜特徵、藥物代表性、臨牀需求和本實驗室條件等,確定本室不同菌種/藥物測試和報告組合。綜合上述原則選擇自動化藥敏板,當藥敏板無法滿足需求時,予以補充。
5.3.2 3.2 結果解釋分類
實驗室測試和報告抗菌藥物的MIC值或抑菌圈直徑(mm)的結果,按折點分爲:敏感(S)、劑量依賴型敏感(SDD)、中介(I)、耐藥(R)或非敏感(NS);按ECV分爲野生型(WT)或非野生型(NWT)。
5.3.3 3.3 報告原則
5.3.3.1 3.3.1 基本原則
只有當分離株可能有臨牀意義而非定植或污染時,纔可報告藥敏試驗。藥敏試驗檢測獲得性耐藥而非天然耐藥,實驗室應明確各類菌屬的天然耐藥譜,避免將天然耐藥誤報爲敏感。個別菌屬對某些藥非常敏感,或該菌引起的感染不需使用抗菌藥物時(如大腸埃希菌O157引起的腹瀉),常規不需藥敏試驗。實驗室根據藥物分組、標本類型等,選擇性報告藥敏結果。
5.3.3.2 3.3.2 藥敏方法和折點的選擇
針對不同藥物/菌種組合,實驗室應選擇適當的藥敏方法,並制定相應藥敏試驗的操作程序(包括質控標準、結果解釋等)。實驗室宜採用國內、外權威機構近兩年發佈的折點,並每年評審本室藥敏檢測系統的折點範圍;因藥敏板條濃度範圍受限,無法採用新折點時,需補充相應的耐藥表型檢測試驗,且告知臨牀。
判定折點的適用性與菌種、藥敏方法、檢測條件、紙片含量、感染部位、藥物(種類、劑量、頻次、途徑)有關。當上述條件符合相應要求時,折點方適用。對於國際藥敏委員會未給出折點的藥物,建議採用國內、外專家共識和權威文獻等進行操作和判斷,並告知臨牀。
5.3.3.3 3.3.3 藥敏報告特殊注意事項
a) 腸道分離的沙門菌屬和志賀菌屬僅需報告氨苄西林、一種氟喹諾酮類藥物和甲氧苄啶/磺胺甲噁唑。腸道外分離的沙門菌屬,需增加測試並報告一種三代頭孢菌素,必要時測試並報告氯黴素。傷寒樣沙門菌(傷寒沙門菌和甲、乙、丙型副傷寒沙門菌)應進行藥敏試驗,腸道分離的非傷寒樣沙門菌一般不進行藥敏試驗。沙門菌屬和志賀菌屬對第一代、第二代頭孢菌素、頭黴素和氨基糖苷類體外可能敏感,但臨牀治療無效,所以不測試和報告這些藥物。
b) 苯唑西林耐藥葡萄球菌對目前可用的β-內酰胺類(除頭孢洛林等外)均耐藥。測試青黴素和苯唑西林或頭孢西丁可以推測其它β-內酰胺類的敏感性。
c) 腸球菌屬對氨基糖苷類(除外高濃度的氨基糖苷類)、頭孢菌素類、克林黴素和甲氧苄啶/磺胺甲噁唑體外可能出現敏感,但臨牀治療無效,不應報告爲敏感。
d) 腦脊液分離菌株,不宜常規測試和報告下列藥物:僅有口服劑型的藥物、第一代和第二代頭孢菌素(除外頭孢呋辛注射劑)和頭黴菌素類、克林黴素、大環內酯類、四環素類和氟喹諾酮類。
e) 呼吸道分離株不應測試和報告達託黴素,尿液分離株不報告氯黴素、克林黴素和紅黴素,非尿液分離株不測試和報告呋喃妥因。
f) 罕見耐藥表型、廣泛耐藥或全耐藥菌應複覈後方可發出藥敏報告。一旦確認應報告醫院感染控制辦公室。實驗室保留這些菌株,以備流行病學調查或臨牀追加額外的藥敏試驗之需。
5.3.3.4 3.3.4 報告單內容和形式
5.3.3.4.1 3.3.4.1 一般信息
報告單包括:患者信息(姓名、年齡、性別、病歷號等)、臨牀信息(如科室、臨牀診斷、抗菌藥物使用、標本類型等)、實驗室信息(包括標本採集時間、送檢時間、接收時間和審覈報告時間、操作人和審覈人雙簽名)等。
5.3.3.4.2 3.3.4.2 藥敏試驗
細菌名稱應規範化,參見細菌命名標準。宜標註拉丁文名稱。藥物名稱應使用規範的化學通用名稱,不使用商品名。宜同時顯示藥物的中英文名稱,且同一類藥物不同品種集中排列。
3.3.4.2.2 結果呈現
a) 報告單應明確列出各類藥物對該菌種的折點、本實驗室所用標準的版本號或出版時間。
b) 若沒有折點而借用其他菌種折點或採用權威文獻折點,需備註說明。
c) MIC 法報告 MIC 值(單位爲 mg/L 或 μg/mL)和結果解釋;紙片擴散法報告抑菌圈直徑值(應爲整數,單位爲 mm)。結果解釋根據折點或 ECV 判斷爲 S、I、R、SDD、NS、WT、NWT 等類型。
d) 不報告替代藥物的藥敏結果。如用於判斷金黃色葡萄球菌對苯唑西林耐藥性的頭孢西丁不應報告。
3.3.4.2.3 特殊耐藥表型
宜在報告中明確標註特殊耐藥表型,同時對特殊耐藥表型進行專業解釋,包括含義、機制、用藥限制和建議等。對於罕見耐藥現象,進行復核,並標示結果狀態,如複覈中、已複覈等。少見和矛盾耐藥表型進行確認。
3.3.4.3 報告單備註或註釋
a) 形式性註釋:用於符號、縮寫等的詳細解釋。
b) 專業性註釋:包括概念解釋(如特殊菌天然耐藥)、臨牀意義和治療建議等,專業性註釋宜有科學依據。
c) 重要性提示:如“高致病性/高傳播性”。
d) 時效性提示:如“若有疑義,請於 48 h 內與實驗室聯繫”。
f) 免責提示:如“該結果僅對該標本負責”,“該結果解釋宜結合患者臨牀表現與治療反應,僅供參考”等。
5.3.3.5 3.3.5 報告發放
藥敏報告應儘快發放。緊急情況應將部分結果先行發出,如血培養和腦脊液等其他無菌體液培養的初步藥敏試驗結果。無論提前還是延時,報告上應顯示時間,並註明報告級別(初步報告或最終報告)。保存抗菌藥物敏感性試驗資料,至少每年向臨牀報告流行病學分析結果。
5.4 4 藥敏試驗方法
5.4.1 4.1 藥敏試驗方法的分類
藥敏試驗方法包括:稀釋法(包括瓊脂稀釋法和肉湯稀釋法)、紙片擴散法、梯度擴散法和自動化儀器法。稀釋法是檢測抗菌藥物敏感性的定量試驗方法,爲藥敏試驗的參考方法。
5.4.2 4.2 稀釋法
5.4.2.1 4.2.1 瓊脂稀釋法
5.4.2.1.1 4.2.1.1 材料
4.2.1.1.1 Mueller-Hinton 瓊脂(Mueller-Hinton Agar,MHA)a) 按產品說明稱量 MHA 乾粉。
b) 103.4 Kpa、121.3 ℃高壓蒸汽滅菌 15 min。
c) 立即放至 40 ℃~50 ℃水浴鍋備用。
d) 培養基製備完畢後室溫下(25 ℃)校正 pH 值爲 7.2~7.4。
e) 某些營養要求高的苛養細菌如流感嗜血桿菌、淋病奈瑟菌和鏈球菌屬等,MHA 培養基須加入相應補充物質或使用特殊培養基,詳見附錄 A。
4.2.1.1.2 抗菌藥物梯度稀釋a) 抗菌藥物梯度稀釋液的整個配製過程嚴格無菌操作。見光易分解的替加環素避光保存,易降解、不穩定的藥物如頭孢克洛、氨苄西林、克拉維酸和亞胺培南現用現配。
實際稱取抗菌藥物粉末重量(mg)=實際配製抗菌藥物儲液的體積(mL)×儲液濃度(mg/L)/抗菌藥物的效價(μg/mg)
或
實際配製抗菌藥物儲液的體積(mL)=實際稱取抗菌藥物粉末重量(mg)×抗菌藥物的效價(μg/mg)/儲液濃度(mg/L)
d) 配製藥物儲液:藥物儲液的濃度不低於 1000 mg/L 或高於待測抗菌藥物最高檢測濃度的 10 倍。對大多數穩定、且不易降解的抗菌藥物,將未用完的儲液分裝至無菌小管,置於-70 ℃或更低溫度貯存,時限爲 6 個月。每次使用取一管,避免反覆凍融影響其活性。
e) 抗菌藥物儲液的稀釋:採用倍比稀釋法制備一系列所需抗菌藥物檢測梯度。
4.2.1.1.3 含藥的 MHA 平皿a) 將梯度對倍稀釋的抗菌藥物(生長對照 MHA 平皿加無菌水)按 1:9 比例加入 4.2.1.1.1 製備的已高壓滅菌完畢且溫度在 40 ℃~50 ℃的 MHA 瓊脂中。
c) 傾注平皿, MHA 含藥瓊脂平皿厚度爲 3 mm~4 mm。
d) 室溫放置冷卻至凝固,當日使用或將平皿裝入密閉塑料袋中,置於 2 ℃~8 ℃保存,貯存時限爲 5 天。
e) 平皿使用前置室溫平衡,可置於孵箱中 30 min 使瓊脂表面乾燥。
5.4.2.1.2 4.2.1.2 操作步驟
4.2.1.2.1 製備初始接種菌懸液被測菌株和質控菌株配製0.5麥氏濁度單位的菌懸液,約1×108CFU/mL~2×108CFU/mL,作爲初始接種物,並按一定順序放入試管架。
4.2.1.2.2 稀釋接種菌懸液用無菌肉湯或生理鹽水將初始接種物1:10稀釋,混勻後將稀釋後的接種物按排列順序分別吸取0.1mL至96孔微孔板。
4.2.1.2.3 接種菌懸液a) 標記含藥 MHA 平皿接種點方向。
b) 採用多點接種儀或標準接種環等將稀釋後的接種物按順序分別接種 1 μL~3 μL 至無抗菌藥物的生長對照平皿、含梯度藥 MHA 平皿表面(從低濃度到高濃度)和第二塊生長對照平皿。最終菌液接種量爲 104CFU/點(點直徑爲 5 mm~8 mm)。
c) 平皿室溫放置至菌點乾燥,但放置時間不超過 30 min。
4.2.1.2.4 孵育置於35 ℃±2 ℃空氣環境中孵育16 h~20 h。苛養菌的藥敏試驗平皿孵育條件和時間見附錄A。
4.2.1.2.5 結果判讀將平皿置於黑色、無反光背景上讀取結果。以抑制細菌肉眼可見生長的最低濃度爲MIC。
5.4.2.2 4.2.2 肉湯稀釋法
5.4.2.2.1 4.2.2.1 材料
4.2.2.1.1 陽離子校正的 Mueller-Hinton 肉湯 (Cation-adjusted Mueller-Hinton broth,CAMHB)
a) 按產品說明稱量 CAMHB 乾粉。
b) 103.4 Kpa、121.3 ℃高壓蒸汽滅菌 15 min,冷卻至室溫備用。
c) 培養基製備完畢後宜在室溫環境(25 ℃)校正 pH 值爲 7.2~7.4。
4.2.2.1.2 抗菌藥物梯度稀釋液
b) 將配製好的梯度稀釋抗菌藥物溶液每個梯度按 0.05 mL/孔分裝至 96 孔微孔板(微量肉湯稀釋法)或按 1 mL/管分裝至 13 mm×100 mm 帶螺帽的試管中(宏量肉湯稀釋法),當日使用或凍存於≤ -20 ℃備用。
5.4.2.2.2 4.2.2.2 操作步驟
4.2.2.2.1 製備初始接種菌懸液
被測菌株和相應質控菌株如大腸埃希菌ATCC 25922配製0.5麥氏濁度單位的菌懸液,作爲初始接種物菌懸液。
4.2.2.2.2 稀釋接種菌懸液
用4.2.2.1.1製備的CAMHB肉湯將初始接種物1:100倍稀釋(微量肉湯稀釋法)或1:150倍(宏量肉湯稀釋法)稀釋,混勻,菌液濃度約爲1×106CFU/mL。
4.2.2.2.3 接種菌懸液
a) 將稀釋後的接種物按順序依次吸取 0.05 mL 至 4.2.2.1.2 步驟製備的含等量藥 96 孔微孔板或吸取 1 mL 至 4.2.2.1.2 步驟製備的含等量藥試管中(最終接種物濃度爲 5×105CFU/mL)。
b) 稀釋菌液在 15 min 內接種完畢。
c) 同時將稀釋後的接種物接種至不含抗菌藥物的非選擇性瓊脂平皿,以檢測接種菌懸液的純度。
d) 微量肉湯稀釋法:將稀釋後的菌懸液接種至不含抗菌藥物微孔作爲生長對照,同時設置不加接種菌懸液的含藥孔。
e) 宏量肉湯稀釋法:設置每一株菌的初始接種物的不含藥的生長對照管。
4.2.2.2.4 孵育
a) 接種好的菌液和抗菌藥物混合液置於 35 ℃±2 ℃孵箱中孵育 16 h~20 h。
b) 苛養菌的孵育條件和時間見附錄 A。
4.2.2.2.5 接種菌懸液的菌落計數
每一批試驗應同時進行接種菌懸液的菌落計數,以保證微量肉湯稀釋法和宏量肉湯稀釋法的最終接種菌懸液濃度爲5×105CFU/mL,具體步驟:
a) 4.2.2.2.3 步驟接種完畢後,立即從質控菌株大腸埃希菌 ATCC 25922 的生長對照孔或生長對照管吸取 0.01 mL。
b) 置於 10 mL 無菌生理鹽水中(1:1000 倍稀釋)。
c) 混勻後,吸取 0.1 mL 均勻塗布在不含抗菌藥物的瓊脂平皿上(根據不同細菌生長特性選取非選擇性營養瓊脂平皿)。
d) 置於 35 ℃±2 ℃孵箱中孵育 16 h~20 h 後觀測:若平皿生長菌落數爲 50 CFU 左右,即爲最終接種細菌量爲 5×105CFU/mL。
4.2.2.2.6 結果判讀
b) 根據生長對照孔/管菌液生長量判定生長終點。革蘭陽性球菌檢測氯黴素、克林黴素、紅黴素、利奈唑胺和四環素時,易出現拖尾現象,讀取拖尾現象開始的第一個孔的 MIC 值,忽略微小菌膜。若存在多孔跳孔現象,需重新檢測。
5.4.3 4.3 紙片擴散法
5.4.3.1 4.3.1 材料
5.4.3.1.1 4.3.1.1 MHA 瓊脂
a) 按下列步驟製備 MHA 培養基:
1) 按產品介紹稱量 MHA 乾粉,103.4Kpa、121.3 ℃高壓蒸汽滅菌 15 min 後放至 40 ℃~50 ℃水浴。
2) 將無菌空平皿(內徑 9 cm 或 14 cm)置於超淨臺水平臺面上,晃動搖勻 MHA 後傾倒平皿,每塊平皿瓊脂厚度爲 3 mm~4 mm。
3) 平皿室溫冷卻後,2 ℃~8 ℃冰箱保存。
b) pH 值:紙片擴散法使用的培養基 pH 值在室溫下爲 7.2~7.4。
c) 水分:進行藥敏試驗時,MHA 瓊脂表面應溼潤,但不能有水滴,平皿蓋上不應有水珠。
5.4.3.1.2 4.3.1.2 抗菌藥物紙片
藥敏紙片爲直徑6.35 mm、吸水量爲0.02 mL的專用藥敏紙片。藥敏紙片使用前需室溫平衡1 h~2 h。紙片需密封貯存於-20 ℃冰箱內。開封后的紙片可置於含乾燥劑的螺口塑料或玻璃管中2 ℃~8 ℃保存,不超過1周。
5.4.3.1.3 4.3.1.3 標準比濁管
a) 用硫酸鋇比濁管(0.5 號麥氏單位標準比濁管)標定接種菌液濃度。
b) 比濁管制備方法:取 0.048 mol/L 氯化鋇(BaCl2)[1.175%(W/V)BaCl2.2H2O] 0.5 mL,加到99.5 mL 的 0.18 mol/L 硫酸(1%,V/V)溶液中,製成比濁管,用光徑爲 1 cm 的紫外分光光度計測定吸光度值來標定比濁管。0.5 號比濁管在 625 nm 波長的吸光度爲 0.08~0.13。選取管徑與製備菌液試管相同的螺口試管,每管分裝 4 mL~6 mL,密封,置於室溫避光環境。使用前漩渦震盪混勻。
5.4.3.2 4.3.2 操作步驟
5.4.3.2.1 4.3.2.1 製備接種菌懸液
a) 被測菌株和標準菌株接種於非選擇性培養基如血平皿,置於 35 ℃空氣培養 18 h~24 h(孵育條件參照附錄 A 進行)。
1) 直接菌落法:選取孵育 18 h~24 h 後的菌落形態一致的且生長較好的 3~5 個菌落;採用接種環或無菌拭子觸碰每個菌落頂部,轉移至含有 4 mL~5 mL 的胰大豆肉湯或無菌生理鹽水中。
2) 肉湯增菌法: 將單個菌落接種至肉湯培養基,置於 35 ℃±2 ℃孵育,至濁度接近規定的濃度(通常孵育 2 h~6 h)。
c) 採用生理鹽水或肉湯校正菌液濃度至 0.5 麥氏比濁管(約 1×108CFU/mL~2×108CFU/mL),也可用電子比濁儀。
5.4.3.2.2 4.3.2.2 接種平皿
a) 用無菌棉拭子蘸取菌液,在管內壁將多餘菌液旋轉擠去。
b) 在 MHA 平皿表面均勻塗布 3 次,每次旋轉平皿 60°,最後沿平皿內瓊脂邊緣塗抹一週。
c) 校正濃度後的菌液在 15 min 內接種完畢。
5.4.3.2.3 4.3.2.3 貼抗菌藥物紙片
a) 接種菌懸液後的 MHA 平皿置室溫下乾燥 3 min~5 min。
b) 用紙片分配器或無菌鑷子將抗菌藥物紙片緊密貼於平皿。各紙片中心相距≥24 mm。紙片貼上後不應再移動。
5.4.3.2.4 4.3.2.4 孵育
貼上紙片15 min內,須把平皿倒置放於35 ℃孵箱中孵育16 h~18 h。對於某些特殊抗菌藥物如苯唑西林或萬古黴素,孵育時間需延長至24 h。苛養菌等孵育環境和時間見附錄A。
5.4.3.2.5 4.3.2.5 結果判讀
a) 將平皿置於黑色背景下,利用反射光從平皿背面用遊標卡尺或直尺測量無明顯細菌生長區域的直徑(含紙片),即抑菌圈直徑,取整數位,單位爲 mm。
b) 培養基若加入血液,須打開平皿蓋,藉助反射光,從正面測量抑菌圈直徑。
c) 測量萬古黴素、利奈唑胺和苯唑西林等的抑菌圈時,使用透射光。
d) 測量甲氧苄啶和磺胺類藥物的抑菌圈時,可忽視輕微生長(20%或較少菌苔生長)而測量較明顯抑制的邊緣。
5.4.4 4.4 梯度擴散法
梯度擴散法是一種結合稀釋法和紙片擴散法原理對抗菌藥物敏感性直接定量的藥敏試驗方法。
5.4.4.1 4.4.1 材料
5.4.4.1.1 4.4.1.1 梯度擴散法條
商品化梯度擴散法條是一條5 mm × 50 mm的無孔試劑載體,一面固定有一系列預先製備的、濃度呈連續指數增長的抗菌藥物,另一面有讀數和判別刻度。梯度擴散法條抗菌藥物濃度梯度可覆蓋有20個MIC對倍稀釋濃度的寬度範圍。
5.4.4.1.2 4.4.1.2 培養基
同紙片擴散法。
5.4.4.2 4.4.2 操作步驟
b) 待平皿乾燥後,用鑷子將梯度擴散法條有 MIC 刻度面朝上,貼在已接種被測菌株的平皿表面,梯度擴散法條全長與瓊脂表面緊密接觸,試條貼好後不應移動。
c) 置於 35 ℃±2 ℃孵箱中孵育 16 h~18 h。
5.4.4.3 4.4.3 結果判讀
讀取橢圓形抑菌圈與梯度擴散法條交界點的讀值,即爲待測抗菌藥物的MIC值。
5.4.5 4.5 自動化儀器法
0.5麥氏濁度單位菌懸液的配製方法同紙片擴散法,按照各儀器介紹對菌懸液進行稀釋。不同種屬細菌稀釋後的菌懸液,加入對應的商品化試驗板條,上機進行檢測。
5.5 5 各種屬細菌藥敏試驗
5.5.1 5.1 各種屬細菌藥敏試驗方法和試驗條件
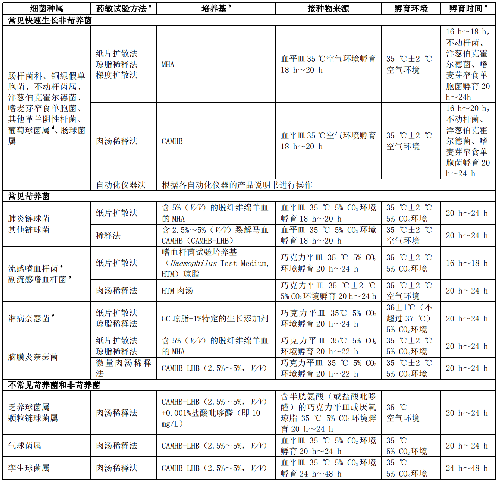
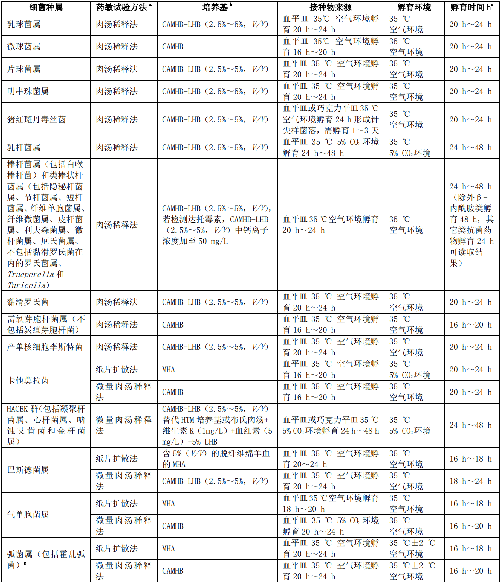
臨牀常見快速生長非苛養菌、常見苛養菌、不常見菌、潛在生物恐怖病原菌、諾卡菌屬和其他需氧放線菌、厭氧菌的藥敏試驗方法和試驗條件見附錄A。常見菌各種屬細菌藥敏折點參照參考文獻[1]。
5.5.2 5.2 常見菌特殊耐藥表型檢測
5.5.2.1 5.2.1 β-內酰胺酶表型檢測
臨牀報告葡萄球菌屬、流感嗜血桿菌、卡他莫拉菌、淋病奈瑟菌和一些厭氧菌對青黴素的敏感性前,應進行β-內酰胺酶的補充藥敏試驗(方法見表1)。青黴素可用於預測上述種屬對青黴素酶不穩定的青黴素類的敏感性,包括青黴素、阿莫西林、氨苄西林、羧苄西林、替卡西林、阿洛西林和哌拉西林等。
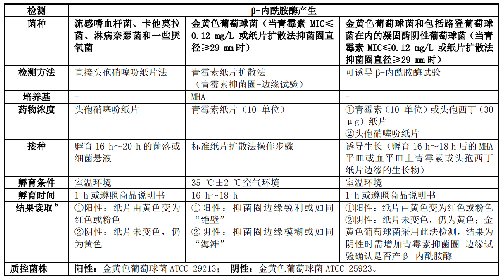
5.5.2.2 5.2.2 葡萄球菌屬對苯唑西林耐藥性檢測
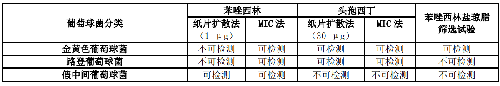
檢測葡萄球菌屬對苯唑西林敏感性的方法見表 2。苯唑西林或頭孢西丁的藥敏結果適用於其他對青黴素酶穩定的青黴素類如氯唑西林、雙氯西林、氟氯西林、甲氧西林和萘夫西林。苯唑西林或頭孢西丁藥敏試驗結果爲敏感,即對 β-內酰胺酶抑制劑複合物、頭孢菌素類和碳青黴烯類敏感。一旦檢測爲苯唑西林耐藥,即對所有 β-內酰胺類(頭孢洛林除外)藥物耐藥。
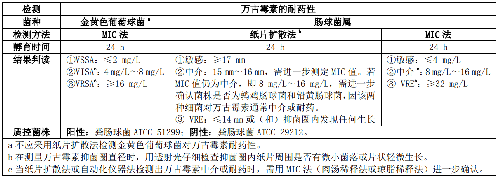
5.5.2.3 5.2.3 萬古黴素中介的金黃色葡萄球菌(Vancomycin intermediate S. aureus,VISA)、萬古黴素耐藥的金黃色葡萄球菌(Vancomycin resistant S. aureus,VRSA)和萬古黴素耐藥腸球菌(Vancomycin resistant Enterococcus, VRE)表型檢測,見表 3。
5.5.2.4 5.2.4 誘導克林黴素耐藥性檢測
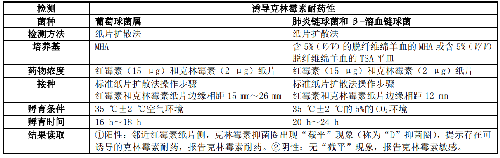
當葡萄球菌屬、肺炎鏈球菌和β-溶血鏈球菌對大環內酯類如紅黴素耐藥,而對克林黴素中介或敏感時,宜進行誘導克林黴素耐藥性檢測,包括紙片擴散法(D試驗,表4)、微量肉湯稀釋法和自動化儀器法。微量肉湯稀釋法是將4 mg/L的紅黴素和0.5 mg/L的克林黴素置於同一孔裏,35 ℃±2 ℃空氣環境孵育18 h~24 h檢測後,檢測菌株是否生長。生長即爲陽性,不生長爲陰性。
表4 葡萄球菌屬、肺炎鏈球菌和 β-溶血鏈球菌的誘導克林黴素耐藥性檢測方法
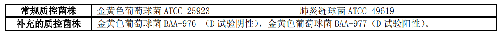
5.5.2.5 5.2.5 腸球菌屬氨基糖苷類高水平耐藥(High-level aminoglycoside resistance, HLAR)表型檢測腸球菌屬氨基糖苷類高水平耐藥表型檢測見表 5。
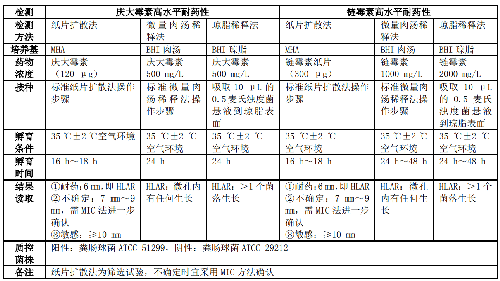
5.5.2.6 5.2.6 產超廣譜β-內酰胺酶(Extended-spectrum β-lactamases, ESBLs)表型檢測
ESBLs檢測適用菌種爲大腸埃希菌、肺炎克雷伯菌、產酸克雷伯菌和奇異變形桿菌。ESBLs確證試驗包括紙片擴散法、MIC法(稀釋法或梯度擴散法)。
紙片擴散法:使用每片含30 μg頭孢他啶、頭孢噻肟紙片和頭孢他啶/克拉維酸(30 μg/10 μg)、頭孢噻肟/克拉維酸(30 μg/10 μg)複合物紙片進行檢測,當任何一種複合物紙片抑菌圈直徑比其單獨藥敏紙片抑菌圈直徑大於或等於5 mm,可確證該菌株產ESBLs。
稀釋法:使用頭孢他啶(0.25 mg/L~128 mg/L)、頭孢他啶/克拉維酸(0.25/4 mg/L~128/4 mg/L)、頭孢噻肟(0.25 mg/L~64 mg/L)、頭孢噻肟/克拉維酸(0.25/4 mg/L~64/4 mg/L)進行檢測,當與克拉維酸聯合藥物組的MIC小於或等於單獨藥物組MIC 3個倍比稀釋度時(或比值≥8),可確證該菌株產ESBLs。
5.5.2.7 5.2.7 碳青黴烯酶的表型檢測
5.5.2.7.1 5.2.7.1 適用條件
當腸桿菌科細菌和銅綠假單胞菌對厄他培南(銅綠假單胞菌不適用)、亞胺培南或美羅培南中任何一種藥物中介或耐藥時,需進行復核,並檢測該菌株是否產碳青黴烯酶,以便採取感染控制措施。碳青黴烯酶表型檢測方法爲改良碳青黴烯類滅活試驗(Modified carbapenem inactivation method,mCIM)等。銅綠假單胞菌碳僅採用 mCIM 試驗,腸桿菌科細菌宜同時執行 mCIM 試驗和 EDTA-mCIM(eCIM)試驗。
5.5.2.7.2 5.2.7.2 具體步驟
a) 血平皿過夜孵育待測菌。
b) 用 1 μL 接種環重懸腸桿菌科細菌(銅綠假單胞菌採用 10 μL 接種環)於 2 mL 胰大豆肉湯(TSB)管中。當檢測腸桿菌科細菌產酶株時,再另取一新的接種環重懸待測菌株於另一 2 mL TSB 管中,並吸取 20 μL 0.5 M EDTA(終濃度爲 5 mM)置於該管中。
c) 渦旋震盪 10 s~15 s。
d) 分別取 10 μg 美羅培南紙片各一片置於 b)步驟含和不含 EDTA 的 TSB 菌液管中,確保整個紙片浸沒在菌懸液中。
e) 35 ℃±2 ℃空氣孵育 4 h±15 min。
f) 待孵育時間接近 4 h 時,採用生理鹽水製備大腸埃希菌 ATCC 25922 的 0.5 麥氏單位菌懸液,15 min 內按照常規紙片擴散法步驟將其塗布於 MHA 平皿上,乾燥 3 min~10 min。
g) 採用 10 μL 接種環從 TSB-美羅培南紙片懸液中取出美羅培南紙片,排出過多液體,將其貼在已接種好大腸埃希菌 ATCC 25922 的 MHA 平皿上,反轉平皿,35 ℃±2 ℃空氣孵育 18 h~24 h後,測量美羅培南抑菌圈直徑。
h) mCIM 結果判讀:①陽性:當抑菌圈直徑 6 mm~15 mm 或在 16 mm~18 mm 抑菌圈內存在大腸埃希菌 ATCC 25922 菌落時,報告產碳青黴烯酶;②陰性:當抑菌圈邊緣清晰可見,且其直徑≥19mm 時,報告不產碳青黴烯酶;③不確定:當抑菌圈直徑爲 16 mm~18 mm 或抑菌圈直徑在≥19 mm抑菌圈內存在大腸埃希菌 ATCC 25922 菌落時,不能確定待測菌株是否產碳青黴烯酶,宜用分子方法確認。
i) eCIM 結果判讀:僅在 mCIM 陽性才解讀 eCIM 結果。若抑菌圈內存在菌落,測量 eCIM 抑菌圈時可忽略不計,直接量取抑菌圈邊緣。①陽性:eCIM 抑菌圈直徑-mCIM 抑菌圈直徑≥5 mm,報告產金屬酶;②陰性:eCIM 抑菌圈直徑-mCIM 抑菌圈直徑≤4 mm,報告不產金屬酶,產絲氨酸類碳青黴烯酶。
注:若菌株共產絲氨酸類碳青黴烯酶和金屬酶,eCIM 試驗爲假陰性,此時不能區分二者。
5.5.3 5.3 不常見苛養菌和非苛養菌藥敏試驗
5.5.3.1 5.3.1 乏養球菌屬和顆粒鏈球菌屬
乏養球菌屬和顆粒鏈球菌屬屬於苛養菌,是感染性心內膜炎的重要致病菌。檢測藥物爲青黴素、頭孢噻肟或頭孢曲松和萬古黴素。來自呼吸道或傷口的分離株不必進行藥敏試驗,來自無菌部位如血液、深部組織或植入的假體裝置,特別是免疫缺陷患者,宜進行藥敏試驗。藥敏試驗折點見附錄B表B.1。
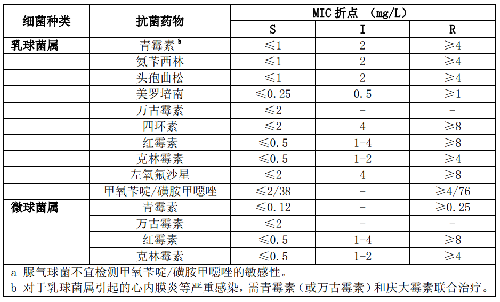
5.5.3.2 5.3.2 氣球菌屬、孿生球菌屬、乳球菌屬和微球菌屬
氣球菌屬常規檢測藥物爲青黴素、頭孢曲松和萬古黴素。孿生球菌屬檢測藥物爲青黴素、頭孢噻肟或頭孢曲松和萬古黴素。乳球菌屬的檢測藥物則爲青黴素或氨苄西林、頭孢曲松、萬古黴素、克林黴素和紅黴素。格氏乳球菌對克林黴素天然耐藥。
微球菌屬常爲污染菌,多次血培養陽性或植入假體裝置分離的菌株可進行藥敏試驗。其檢測藥物爲青黴素和萬古黴素。這些菌屬藥敏試驗折點見附錄B表B.2。
5.5.3.3 5.3.3 對糖肽類藥物天然耐藥的革蘭陽性菌
5.5.3.3.1 5.3.3.1 明串珠菌屬和片球菌屬
明串珠菌屬和片球菌屬爲苛養菌,對萬古黴素天然耐藥。分離自無菌部位如血培養或深部組織的菌株,尤其是免疫缺陷患者無菌部位分離的菌株可進行藥敏試驗。檢測藥物爲青黴素或氨苄西林。
5.5.3.3.2 5.3.3.2 豬紅斑丹毒絲菌
豬紅斑丹毒絲菌爲苛養菌,對萬古黴素和氨基糖苷類天然耐藥。豬紅斑丹毒絲菌常規不必進行藥敏試驗;但因其引起心內膜炎時,宜立即進行藥敏試驗。檢測藥物爲青黴素或氨苄西林。對青黴素過敏患者,需檢測紅黴素和克林黴素的敏感性。
5.5.3.3.3 5.3.3.3 乳桿菌屬
乳桿菌屬通常屬於苛養菌。分離自無菌部位如血培養或深部組織等的菌株,尤其是免疫缺陷患者無菌部位分離的菌株需進行藥敏試驗。檢測抗菌藥物爲青黴素或氨苄西林。乾酪乳桿菌、發酵乳桿菌、植物乳桿菌、羅伊氏乳桿菌、鼠李糖乳桿菌、唾液乳桿菌、陰道乳桿菌和玉米乳桿菌對萬古黴素天然耐藥;而嗜酸乳桿菌、捲曲乳桿菌、加氏乳桿菌、惰性乳桿菌、詹氏乳桿菌、約氏乳桿菌和乳酸乳桿菌對萬古黴素敏感。
5.5.3.4 5.3.4 棒桿菌屬、類棒狀桿菌屬和黏滑羅氏菌
棒桿菌屬、類棒狀桿菌屬(包括隱祕桿菌屬、節桿菌屬、短桿菌屬、纖維單胞菌屬、纖維微菌屬、皮桿菌屬、利夫森菌屬、微桿菌屬和厄氏菌屬等)和黏滑羅氏菌通常爲污染菌或定植菌。分離自無菌部位如深部組織、腦脊液或血培養(多瓶培養陽性)的菌株,尤其是有植入假體裝置或免疫缺陷患者無菌部位分離的菌株需進行藥敏試驗。其檢測藥物和藥敏試驗折點詳見附錄B表B.3。
5.5.3.5 5.3.5 需氧芽胞桿菌屬
需氧芽胞桿菌屬通常爲污染菌,明確爲污染菌時,不應進行藥敏試驗。分離自無菌部位如深部組織、腦脊液或血培養(多瓶培養陽性)的菌株,尤其是有植入假體裝置、免疫缺陷或靜脈吸毒史患者無菌部位分離的菌株可進行藥敏試驗。需氧芽胞桿菌屬(不包括炭疽芽胞桿菌)檢測藥物爲萬古黴素、氟喹諾酮類和克林黴素。該菌屬通常對萬古黴素、大環內酯類、氨基糖苷類和喹諾酮類藥物敏感。蠟樣芽胞桿菌和蘇雲金芽胞桿菌產廣譜β-內酰胺酶,通常對青黴素類和頭孢菌素類耐藥。
5.5.3.6 5.3.6 產單核細胞李斯特菌
產單核細胞李斯特菌對頭孢菌素類天然耐藥。因該菌通常對氨苄西林或青黴素敏感,因此常規不必藥敏試驗。其藥敏試驗僅限於治療失敗或者對青黴素過敏的患者。檢測藥物爲青黴素或氨苄西林、甲氧苄啶/磺胺甲噁唑和美羅培南。這四個藥物的敏感性折點分別爲≤2 mg/L, ≤2 mg/L, ≤0.5/9.5 mg/L、≤0.25 mg/L,目前尚無中介和耐藥的折點。
5.5.3.7 5.3.7 卡他莫拉菌
大部分卡他莫拉菌菌株因產β-內酰胺酶對不耐酶的青黴素(如青黴素、氨苄西林和阿莫西林)類耐藥。檢測藥物包括阿莫西林/克拉維酸、頭孢呋辛和甲氧苄啶/磺胺甲噁唑。流行病學調查或重症感染患者分離的菌株宜進行藥敏試驗,藥敏試驗折點詳見附錄B表B.4。
5.5.3.8 5.3.8 HACEK 細菌羣和巴斯德菌屬
HACEK細菌羣包括凝聚桿菌屬、心桿菌屬、齧蝕艾肯菌和金桿菌屬。HACEK羣爲苛養菌,檢測抗菌藥物爲青黴素、氨苄西林、阿莫西林/克拉維酸、頭孢噻肟或頭孢曲松、亞胺培南、環丙沙星或左氧氟沙星和甲氧苄啶/磺胺甲噁唑。分離自咬傷部位的艾肯菌屬對阿莫西林/克拉維酸高度敏感,不必進行藥敏試驗。
巴斯德菌屬通常對苯唑西林、頭孢氨苄和克林黴素耐藥,而對氨苄西林、阿莫西林和青黴素的MIC值很少超過0.5 mg/L。檢測藥物爲青黴素類、阿莫西林/克拉維酸、頭孢曲松、氟喹諾酮類、大環內酯類、四環素和甲氧苄啶/磺胺甲噁唑。藥敏試驗折點詳見附錄B表B.5。
5.5.3.9 5.3.9 氣單胞菌屬和弧菌屬(不包括霍亂弧菌)
氣單胞菌屬對氨苄西林、阿莫西林/克拉維酸和頭孢唑啉均耐藥。氣單胞菌屬檢測藥物爲第三代、四代頭孢菌素、氟喹諾酮類和甲氧苄啶/磺胺甲噁唑。採用β-內酰胺類藥物治療氣單胞菌屬時,該菌可產生誘導性β-內酰胺酶而對超廣譜頭孢菌素類產生耐藥。
弧菌屬屬於嗜鹽菌,嗜鹽弧菌屬常對磺胺類、青黴素類、頭孢噻吩和頭孢呋辛耐藥。霍亂弧菌檢測藥物包括氨苄西林、阿奇黴素、氯黴素、磺胺類、四環素或多西環素和甲氧苄啶/磺胺甲噁唑。其他弧菌屬檢測抗菌藥物包括頭孢噻肟、頭孢他啶、氟喹諾酮類和四環素或多西環素。
氣單胞菌屬和弧菌屬的藥敏試驗常限於腸道外分離的菌株。藥敏試驗折點詳見附錄B表B.6。
5.5.3.10 5.3.10 諾卡菌屬和其他需氧放線菌
諾卡菌屬和其他需氧放線菌(馬紅球菌及其他紅球菌屬細菌、戈登菌屬和鏈黴菌屬等)屬於專性需氧菌,繁殖速度緩慢。諾卡菌屬檢測的藥物及其折點見附錄B表B.7。萬古黴素和利福平是治療馬紅球菌引起臨牀感染的重要藥物,因此馬紅球菌藥敏需包括這兩個藥物。其他需氧放線菌如馬紅球菌、馬杜拉放線菌屬和戈登菌屬僅報告MIC值,尚無藥敏折點。
5.6 6 質量控制(Quality control, QC)
實驗室宜遵照行業標準建立本實驗室藥敏試驗的質量管理體系,包括質控菌株、質控頻率和質控範圍等,同時定期參加實驗室室間比對項目。
5.6.1 6.1 質控菌株
質控菌株可從ATCC或參考實驗室以及商業機構獲得。保存其來源和傳代等記錄,並有證據表明質控菌株性能滿足要求。
5.6.2 6.2 質控頻率
5.6.2.1 6.2.1 日質控
可按 20 天或 30 天重複方案和 15-重複方案中任意一種執行日質控。
5.6.2.1.1 6.2.1.1 20 天或 30 天重複方案(見表 6)
表6 20 天或 30 天重複方案中可接受標準和推薦措施
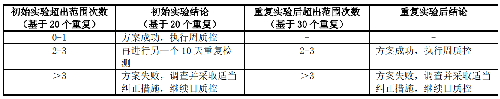
a) 連續檢測 20 天或 30 天,記錄藥物的 MIC 值或抑菌圈直徑。
b) 根據檢測結果是否在控,決定是否轉周質控;若實驗室常規每天檢測質控菌株,期望將日質控轉爲周質控,可回顧性分析過去兩年連續檢測的質控結果,前提是檢測系統一致。
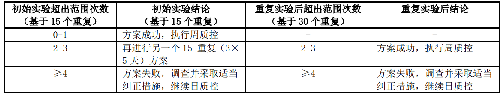
5.6.2.1.2 6.2.1.2 15-重複方案(見表 7)
a) 每天重複測定 3 次,每次單獨製備接種物,連續測定 5 天,記錄藥物的 MIC 值或抑菌圈直徑。
b) 根據檢測結果是否在控,決定是否轉周質控。
表7 15-重複方案中可接受標準和推薦措施
5.6.2.2 6.2.2 周質控:即每週檢測 1 次。
當使用同一廠商新批號的培養基時,應執行周質控。若周質控失控,應採取適當糾正措施。對於某些不穩定易降解的抗菌藥物,質控頻率可增加,不侷限於一週一次。
5.6.3 6.3 質控結果失控原因分析和糾正措施
失控原因可分爲隨機誤差、可確認的誤差和系統誤差。隨機誤差和可確認的誤差可通過簡單重複進行質控予以糾正;而系統誤差不可通過簡單重複進行質控予以糾正。
5.6.3.1 6.3.1 失控原因是可確認的誤差(即誤差原因易發現和誤差易於糾正)
若在失控當天通過重複檢測相同質控菌株/抗菌藥物組合,其結果在控,可不必進一步糾錯。可確認的誤差產生的失控原因包括但不侷限於以下幾方面:
a) 質控菌株:①使用誤差的質控菌株;②不當的儲存方式;③維護不足(如相同的傳代產物超過1 個月);④污染,菌株失活;⑤菌株性能改變(如突變或質粒丟失等)。
b) 檢測試劑:①不當的儲存和運輸環境;②污染;③試管或微孔內肉湯量不足;④板條、瓊脂平皿或藥敏卡等損壞(如破裂或泄露等);⑤試劑失效。
c) 檢測過程:①接種物菌懸液配製方法不當或濁度調節方法不當;②配製接種物使用的細菌孵育時長不當;③配製接種物使用的細菌來源於選擇性培養基、含抗菌藥物或細菌生長抑制複合物的平皿;④孵育溫度或孵育條件不當;⑤使用誤差的試劑及配套設備;⑥藥敏結果讀取方法或結果解釋不當;⑦書寫誤差。
d) 儀器:儀器故障或定標不通過(如微量分液器)。
5.6.3.2 6.3.2 日質控檢測,失控爲不可確認的誤差
執行糾正措施:失控當天採用相同的質控菌株/抗菌藥物組合重複進行檢測,若在控,繼續執行日
質控;若不在控,執行糾正措施,見6.3.4所述。
5.6.3.3 6.3.3 周質控檢測,失控爲不可確認的誤差
執行糾正措施:失控當天重複檢測相同的質控菌株/抗菌藥物組合,若重複檢測的結果在控,且已找到失控的原因,連續五天重複使用同一批號的試劑檢測所有抗菌藥物/質控菌株組合的質控結果,若:
①5次檢測結果均可控,可繼續執行周質控;②3次檢測結果在控,繼續執行連續2天重複檢測直至5次結果在控。
5.6.3.4 6.3.4 糾正措施,包括:
a) 若重複檢測仍不在控,執行糾正措施。
b) 繼續執行日質控直至找到失控原因。
c) 選用新的質控菌株或新的試劑批號或新的品牌。
d) 在尋找失控原因過程中,可採用替代性檢測試驗。
5.7 7 商品化藥敏試驗檢測系統的性能驗證
5.7.1 7.1 受試菌株的選擇
選擇適用於待驗證系統中藥物檢測的臨牀菌株,且兼顧藥敏板的類型(如驗證葡萄球菌專用藥敏板時選擇葡萄球菌)、每種藥物的抗菌譜(如驗證糖肽類時只選革蘭陽性菌)、檢測的範圍(如尿液分離株)。敏感和耐藥菌株的數量宜均衡。如可能,宜使用已知耐藥表型的菌株,或所在地區具有特殊臨牀意義的耐藥菌株(如碳青黴烯耐藥腸桿菌科)。產品介紹中未列出的菌種不列入驗證範圍,可不驗證罕見耐藥菌(如萬古黴素耐藥的金黃色葡萄球菌),但實驗室應審閱製造商的數據或相關文獻。
推薦使用非凍存的、新鮮的臨牀分離株。爲增加菌種的多樣性和耐藥表型的數量,也可使用凍存菌株、室間質評或其他來源的菌株。檢測前,凍存菌株傳代2次,且傳代後 24 h 內使用。
5.7.2 7.2 受試菌株的數量
每種藥敏板至少需要測試30株菌,這樣每個藥會產生30個藥敏結果。對於未達到30個結果的藥物,需檢測其他菌株或使用質控株的結果以保證每種藥物至少有30個藥敏結果,但質控株的結果不能超過50%。儘可能選擇大量的臨牀菌株,包括特殊或少見耐藥表型菌株。
5.7.3 7.3 對照方法的選擇
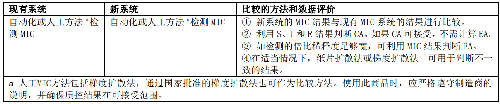
引入新的藥敏檢測系統時,需與現有的且驗證過的藥敏系統進行比較。如果實驗室目前無藥敏系統,可在新的藥敏系統上使用已知藥敏結果的貯存菌株進行驗證;或與通過權威機構認可的實驗室聯繫,將檢測結果與該實驗室驗證過的藥敏系統進行比對;實驗室也可通過與參考方法(如微量肉湯稀釋法)的比較,驗證新的藥敏系統(表8)。

5.7.4 7.4 性能驗證期間的質量控制
5.7.4.1 7.4.1 新藥敏檢測系統
藥敏系統驗證期間的每一天,應在新系統內進行質量控制。使用合適的針對藥敏板的質控菌株。實驗室如希望將質控頻率從日變到周,需實施質量控制計劃,評審質控數據是否支持這種轉變。
5.7.4.2 7.4.2 改良的藥敏檢測系統
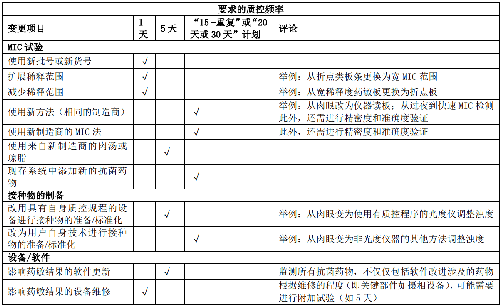
當實驗室改良已有的藥敏檢測系統或採用個性化藥敏檢測系統時,需對變更項目實施個性化質量控制,質量控制方案詳見表9。
5.7.5 7.5 精密度
指採用相同分析方法對同一菌株連續檢測結果的一致性。藥敏檢測系統精密度評估應考慮正常變異,如抗細菌藥物結果差異爲±1個倍比稀釋度,抗真菌藥物結果差異爲±2個倍比稀釋度時,認爲結果相同。
評估時,至少使用5個代表性的質控和臨牀菌株,每株檢測三次。檢測可以在一天或多天內進行。
現有系統通常不需進行精密度分析,但是當某一臨牀菌株在新系統中的結果不可重複時,需在現有檢測系統中重新檢測。如果現有檢測系統的結果仍然不可重複,換一菌株。
評估精密度,至少95%的結果符合EA。此外,至少95%質控菌株的結果在控。
5.7.6 7.6 準確度
指待評估藥敏檢測系統的結果和對照方法之間結果的一致性。使用相同菌株同時在新系統和對照系統中檢測。推薦使用臨牀菌株。
評估準確度包括在不同檢測系統中評估CA和EA,可接受標準爲:CA≥90%和EA≥90%。
5.7.7 7.7 藥敏試驗的數據分析
分析驗證數據時,應當只包括抗菌藥物適用的臨牀菌株的結果。如頭孢菌素類不用於腸球菌藥敏的分析。分析藥敏檢測系統的結果至少包括CA。如果CA可接受,不需評估EA。如果檢測的倍比稀釋度有限(如2-3個),不需評估EA;如果倍比稀釋度大於4個,且報告的MIC值可用於指導治療時,評估EA。爲及早發現問題,應在評估中而不是評估後分析數據。分類錯誤或MIC差異超過一個倍比稀釋度時,保存菌株並補充可能的附加試驗。
5.7.8 7.8 矛盾結果的解決
商品化藥敏檢測系統之間不一致的結果稱爲“差異”(discrepancies),而商品化藥敏檢測系統與參考方法的差異稱爲“誤差”(errors)。實驗室應重新檢測具有主要分類差異的菌株(如在一個系統中爲耐藥,但在另一個系統爲敏感)。如可能,重複試驗最好使用相同的接種物同時在兩個系統上檢測,並重復三次。如重複試驗結果仍不一致,使用第三種方法,優選是參考方法。此參考方法爲該產品開發時所用的方法(見產品介紹上)。
實驗室記錄參考方法檢測的結果,比較新系統與參考方法結果間的相關性。如結果一致,不需要附加檢測;如不一致,實驗室宜向製造商諮詢。製造商可能要求提供這些菌株用於附加試驗。檢測結果不一致的菌株,應在故障排除後和/或完成製造商建議的糾正措施後重新檢測。
5.7.9 7.9 可接受標準
雖然商品化檢測系統在獲批前已建立了嚴格標準(包括EA和生長不足等),但是實驗室仍有必要分析自己的數據以確保檢測系統正常運行。“差異”[重大差異(major discrepancy, MD) 和 極重大差異(very major discrepancy,VMD)]指不同藥敏試驗檢測系統之間結果的差別,“誤差”(ME和VME)指藥敏試驗檢測系統與參考方法(如微量肉湯稀釋法和瓊脂稀釋法)結果的不同。不是所有的藥敏檢測系統都使用相同的參考方法。
當符合以下條件時,針對特定藥物/臨牀菌株組合的藥敏檢測系統,認爲通過驗證:
a) 與現有系統相比較,CA≥90%和 EA≥90% (如果報告 MIC)。
b) 所有耐藥菌株的 VMD 或 VME<3%。
c) 所有敏感菌株的 MD 或 ME<3%。
6 附錄A(資料性附錄)臨牀各種屬細菌的藥敏試驗方法和試驗條件
臨牀常見快速生長非苛養菌、常見苛養菌、不常見菌、潛在生物恐怖病原菌、諾卡菌屬和其他需氧放線菌、厭氧菌的藥敏試驗方法和試驗條件見表A.1。
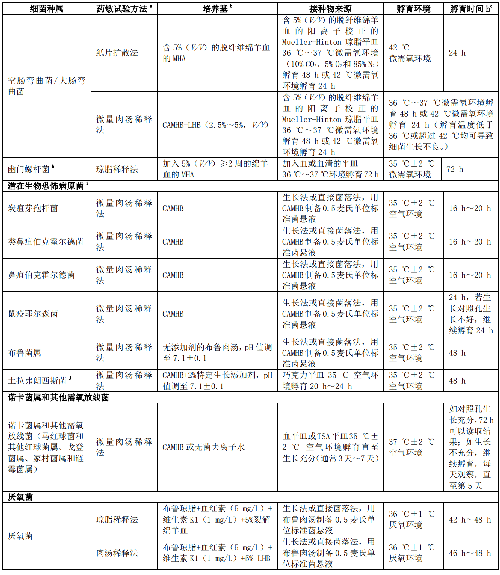

a 採用自動化儀器法和梯度擴散法等進行藥敏試驗需遵照廠家介紹。自動化儀器法通常只能用於常見細菌,而梯度擴散法可用於苛養菌和少見菌的藥敏試驗,但需要獲得相關管理部門的批件。
b 檢測達託黴素時,培養基加入 50 mg/L 的鈣離子;檢測磷黴素時,加入 25 mg/L 的 6-磷酸葡萄糖;檢測達巴萬星和奧利萬星時,加入 0.002%的聚山梨醇酯-80。
c 紙片擴散法、瓊脂稀釋法和肉湯稀釋法檢測苯唑西林和萬古黴素的敏感性宜孵育 24 h。紙片擴散法檢測頭孢西丁的敏感性和凝固酶陰性葡萄球菌對所有抗菌藥物的敏感性孵育 24 h。
d 檢測葡萄球菌屬對苯唑西林的敏感性,須在 CAMHB 加入 2%NaCl。
e 嗜血桿菌屬若檢測甲氧苄啶或磺胺甲噁唑,培養基中加入 0.2 IU 胸苷磷酸化酶。HTM 肉湯爲 CAMHB 中加入 15 mg/L 的β-NAD、15 mg/L 的牛血紅素或豬血紅素、5 g/L 的酵母提取物。
f 淋病奈瑟菌可採用 CAMHB 或 pH7.0 的 0.9%的磷酸鹽緩衝液配製菌懸液。紙片擴散法 1%的特定生長添加劑不宜含半胱氨酸;瓊脂稀釋法檢測碳青黴烯類和克拉維酸時宜含半胱氨酸;檢測其他抗菌藥物,是否含有半胱氨酸對檢測結果影響不大。特定生長添加劑配
制方法如下:將 1.1 g 左旋胱氨酸、0.03 g 鹽酸鳥嘌呤、0.003 g 鹽酸硫胺素、0.013 g 對氨基苯甲酸、0.01 g 維生素 B12、0.1 g焦磷酸硫胺素、0.25 g NAD、1 g 腺嘌呤、10 g 左旋谷氨醯胺、100 g 葡萄糖、0.02 g 硝酸鐵和 25.9 g 左旋半胱氨酸溶於 1L 無菌去離子水中,攪拌混勻。
g 嗜鹽弧菌屬採用 0.85% NaCl 溶液製備 0.5 麥氏單位標準菌懸液。
h 幽門螺桿菌採用 0.85% NaCl 溶液配製成 2.0 麥氏濁度單位菌懸液。
i 潛在生物恐怖病原菌送至生物安全 II 級 BSL-2 以上的實驗室進行操作。對極易產生氣溶膠的操作在 BSL-3 實驗室進行。
j 土拉弗朗西斯菌:特定生長添加劑配製方法如下,將 25.9 g 左旋鹽酸半胱氨酸、1.1 g 左旋半胱氨酸、1 g 腺嘌呤、0.03 g 鹽酸鳥嘌呤、0.01 g 維生素 B12、0.1 g 焦磷酸硫胺素、0.25 g 煙酰胺腺嘌呤二核苷酸、10 g 左旋谷氨醯胺、0.02 g 硝酸鐵、100 g葡萄糖、3 mg 鹽酸硫胺素和 13 mg 對氨基苯甲酸溶於 1L 無菌去離子水中,攪拌混勻。
7 附錄B(資料性附錄)不常見苛養菌和非苛養菌藥敏試驗折點
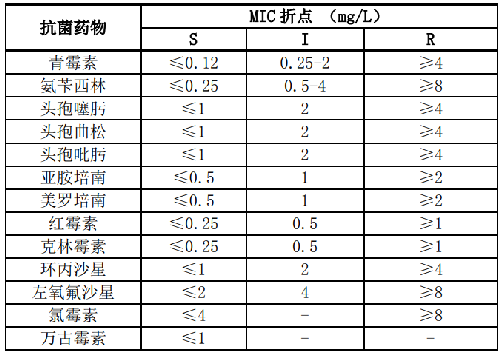
7.1 B.1 乏養球菌屬和顆粒鏈球菌屬的藥敏試驗折點見表B.1。
7.2 B.2 氣球菌屬、孿生球菌屬、乳球菌屬和微球菌屬的藥敏試驗折點見表B.2。
表B.2 氣球菌屬、孿生球菌屬、乳球菌屬和微球菌屬的藥敏試驗折點

7.3 B.3 棒桿菌屬和類棒狀桿菌屬的藥敏試驗折點見表B.3。
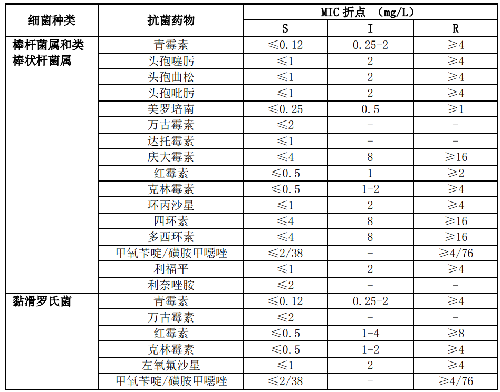
7.4 B.4 卡他莫拉菌的藥敏試驗折點見表B.4。
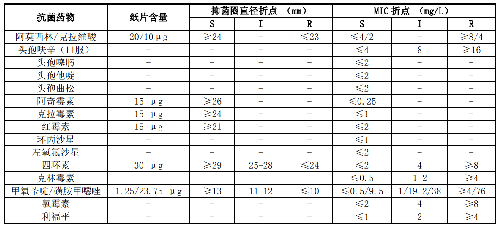
B.5 HACEK羣細菌和巴斯德菌屬的藥敏試驗折點見表B.5。
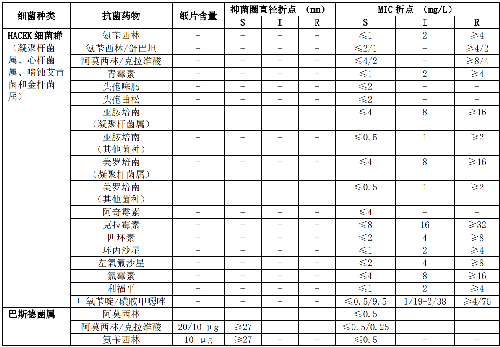
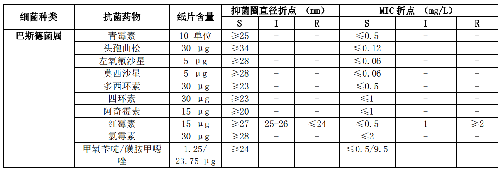
7.5 B.6 氣單胞菌屬和弧菌屬的藥敏試驗折點見表B.6。
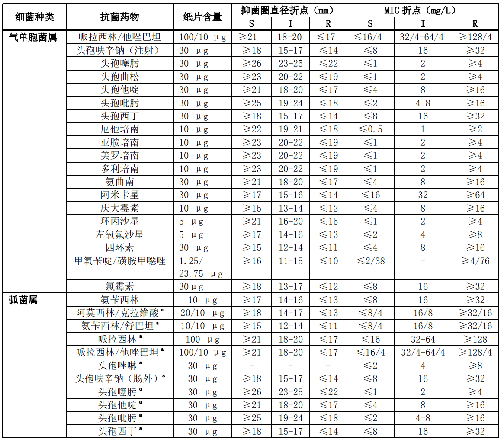
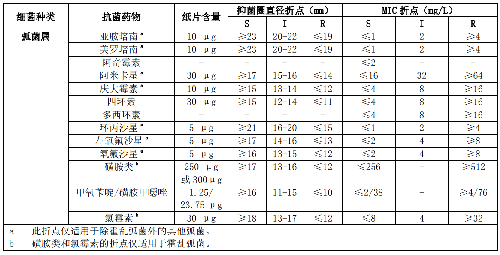
7.6 B.7 諾卡菌屬的藥敏試驗折點見表B.7。
8 參考文獻
[1] CLSI M100. Performance standards for antimicrobial susceptibility testing.(http://www.clsi.org).
[2] CLSI M45, 3rd Edition. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria, 3rd edition.(2016)
[3] CLSI M02-A12. Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved Standard—Twelfth Edition.(2015)
[4] CLSI M24-A2. Susceptibility Testing of Mycobacteria, Nocardiae, and Other Aerobic Actinomycetes; Approved Standard—2nd Edition.(2011)
[5] CLSI M07-A10. Methods for dilution antimicrobial ausceptibility tests for bacteria that grow aerobically;approved standard-10th edition.(2015)
[6] CLSI M11-A8. Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria; approved standard-8th edition.(2012)
[7] CLSI M23, 4th Edition. Development of in vitro susceptibility testing criteria and quality control parameters, 4th edition.(2016)
[8] CLSI M52,1st Edition. Verification of commercial microbial identification and antimicrobial susceptibility testing systems, 1st edition.(2015)
[9] The European Committee on Antimicrobial Susceptibility Testing(EUCAST) Breakpoint tables for interpretation of MICs and Zone Diameters. Version 7.1, http://www.eucast.org/clinical_breakpoints/).(2017)
[10] 中國合格評定國家認可委員會 CNAS-CL42 醫學實驗室質量和能力認可準則(ISO15189:2012,IDT)
[11] 中國合格評定國家認可委員會 CNAS-GL41 臨牀微生物檢驗程序驗證指南(2016)
[12] 王輝, 任健康, 王明貴. 臨牀微生物學檢驗. 北京:人民衛生出版社, 2015.
[13] 王輝, 寧永忠, 陳宏斌, 等. 常見細菌藥物敏感性試驗報告規範中國專家共識. 中華檢驗醫學雜誌. 2016, 39(1): 18-22.
[14] 王輝, 俞雲松, 王明貴, 等. 替加環素體外藥敏試驗操作規程專家共識. 中華檢驗醫學雜誌. 2013, 36(7): 584-587.