3 基本信息
ICS 11.020
C 61
中華人民共和國衛生行業標準WS/T 632—2018《巴貝蟲檢測血塗片鏡檢法》(Detection of Babesia spp.——Blood smear microscopy examinationmethod)由中華人民共和國國家衛生健康委員會於2018年09月26日《關於發佈〈土源性線蟲病的傳播控制與阻斷〉等6項推薦性衛生行業標準的通告》(國衛通〔2018〕21號)發佈,自2019年04月01日起實施。
4 發佈通知
關於發佈《土源性線蟲病的傳播控制與阻斷》等6項推薦性衛生行業標準的通告
國衛通〔2018〕21號
現發佈《土源性線蟲病的傳播控制與阻斷》等6項推薦性衛生行業標準,編號和名稱如下:
WS/T 630—2018 日本血吸蟲抗體檢測 間接紅細胞凝集試驗
WS/T 631—2018 日本血吸蟲毛蚴檢測 尼龍絹袋集卵孵化法
上述標準自2019年4月1日起施行。
特此通告。
國家衛生健康委員會
2018年9月26日
5 前言
本標準按照 GB/T 1.1—2009 給出的規則起草。
本標準起草單位:中國疾病預防控制中心寄生蟲病預防控制所、第二軍醫大學、中國農業科學院上海獸醫研究所。
本標準起草人:張儀、周曉農、劉琴、陳韶紅、朱淮民、周金林。
6 標準正文
6.1 1 範圍
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅所注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
WS/T 564 巴貝蟲病診斷
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
巴貝蟲 Babesia spp.
一類寄生於人和脊椎動物紅細胞內的原蟲,可引起巴貝蟲病(Babesiosis)。感染人體的巴貝蟲有田鼠巴貝蟲(Babesia microti)、分歧巴貝蟲(B. divergens)、鄧肯巴貝蟲(B. duncani)和獵戶巴貝蟲(B. venatorum)等。
3.2
血塗片 blood smears
將血液塗制於載玻片上製成的塗片, 分爲厚血膜塗片和薄血膜塗片。
6.4 4 儀器和器材
4.2 血塗片染色架
4.4 玻片盒
4.5 染色盤和染色缸
4.6 計數器
6.5 5 試劑和材料
5.1 吉氏染色原液(Giemsa)
5.3 標準級載玻片(潔淨載玻片,或表面帶正電荷的粘附玻片)
5.6 二甲苯 (分析純)
5.7 甘油
6.6 6 檢測步驟
6.6.1 6.1 血塗片的製作
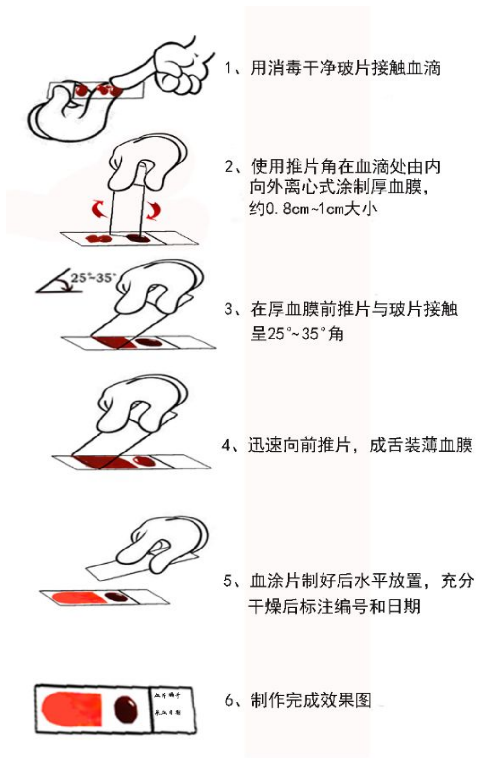
6.6.1.1 6.1.1 採血部位及取血方法
末梢(無名指指尖或耳垂)取血。用75%酒精棉球消毒取血部位,待酒精揮發後,用拇指和食指緊捏耳垂上方或無名指指尖,另一隻手手持一次性採血針迅速刺入皮膚,輕輕擠壓出血。嬰兒可從拇趾或足跟扎刺取血。
6.6.1.2 6.1.2 厚血膜製作
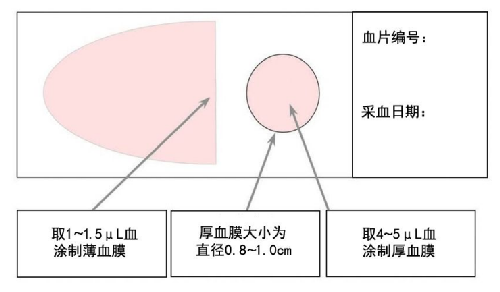
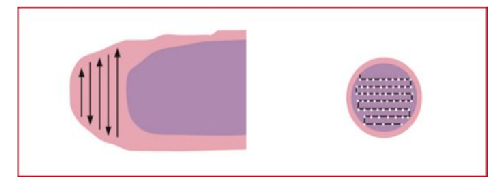
取 1張已消毒的載玻片(或粘附玻片)作推片,用推片的一角,取 4µL~5 µL的血量,使血與另1張平置的載玻片(或粘附玻片)中央偏右的位置接觸,由裏向外旋轉,畫 2 圈~4 圈,塗成直徑0.8cm~1 cm大小圓形厚血膜(見附錄A)。
6.6.1.3 6.1.3 薄血膜製作
幹棉球抹淨推片下角的血漬,用同一張推片中部取約 1 µL~ 1.5µL的血量。將血置於離厚血膜左邊緣約 0.3 cm 的位置,推片的邊緣緊貼載玻片,上下輕輕移動,使血沿推片的邊緣散開至2cm寬,使兩張玻片保持 25°~35°角,從右向左迅速推動推片向前,推成舌狀薄血膜(見附錄A)。
6.6.1.4 6.1.4 編號
血塗片制好後水平放置,充分乾燥後,在玻片一側毛玻璃上或在靠近厚血膜一端邊上標註編號和日期。
6.6.2 6.2 固定與溶血
6.6.2.1 6.2.1 薄血膜固定
將薄血膜一端朝下呈 45°角,用一次性吸管吸取甲醇溶液,均勻輕抹於薄血膜表面,避免碰觸厚血膜。
6.6.2.2 6.2.2 厚血膜溶血
在乾燥的厚血膜上滴加蒸餾水數滴,完全覆蓋血膜,溶血數分鐘,待血膜呈淺灰色,傾去溶血血液。
6.6.3 6.3 吉氏染色
6.6.3.1 6.3.1 吉氏染液的配製
常用的吉氏染液工作液包括 2%、3%、10% 三種濃度,分別由吉氏染液原液和pH7.2磷酸鹽緩衝液(PBS)按比例配製,也可購買商品化吉氏染液原液加實驗用純水按比例配製(見附錄B)。
6.6.3.2 6.3.2 吉氏染色
染色方法見附錄B
6.6.4 6.4 顯微鏡檢查
在染色後的血塗片上加 1滴香柏油或專用浸油,用 100×(倍)油鏡、10×(倍)目鏡的光學顯微鏡檢查。觀察血片路線順序爲薄血膜從尾部舌尖部分開始,厚血膜從上端或下端開始(見附錄A)。
6.6.5 6.5 結果判定
6.6.5.1 6.5.1 巴貝蟲檢測陽性
6.6.5.2 6.5.2 巴貝蟲染蟲率計數
6.5.2.1 薄血膜的巴貝蟲染蟲率計數法
顯微鏡下檢查薄血膜,計數每個視野中的染蟲紅細胞和紅細胞總數2 000 個以上。用下式計算巴貝蟲染蟲率。
6.5.2.2 厚血膜的巴貝蟲染蟲率計數法
若染蟲率低於 0.1%時,顯微鏡下檢查整張厚血膜片,計數整張厚血膜片的巴貝蟲蟲體數和紅細胞總數。用下式計算巴貝蟲染蟲率。
8 附錄B(規範性附錄)試劑配製與血塗片染色、保存方法
8.1 B.1吉氏染色原液配製
將 5.0 g 吉氏粉置於研鉢中,加入少量甘油充分研磨,然後邊加邊磨,至250 mL 甘油加完爲止,倒入 500 mL 有塞深色玻璃瓶中。在研鉢中加入少量甲醇,洗掉剩餘部分,倒入瓶內,再次加甲醇,洗後再倒入瓶中,至 250 mL 甲醇洗淨研鉢中甘油爲止。置室溫內,避免陽光直射。塞緊瓶塞,避免蒸發和高溼造成的氧化。每天用力搖動溶液 5 min,3 d 後即可使用,儲存時間越久染色效果越佳。根據日常的需求,用乾燥吸管吸取少量的染色原液到密閉的分裝瓶中(大約 25 mL)。切勿向原液中加入水。
8.2 B.2 pH 7.2 磷酸鹽緩衝液(PBS)的配製
稱量 8.0 g NaCl,0.2 g KCl,0.24 g KH2PO4(或者 1.44g Na2HPO4)和1.8 g K2HPO4,溶於800 ml 蒸餾水中,用HCl調節溶液的 pH值至 7.2,最後加蒸餾水定容至1 L。保存於4℃冰箱中備用。
8.3 B.3吉氏染色工作液配製
B.3.1 2% 吉氏染液工作液的配製
在 98 mL pH 7.2 磷酸鹽緩衝液中加入 2 mL吉氏染色原液並混勻,或98 mL實驗用純水中加入2mL商品吉氏染色原液並混勻。
B.3.2 3%吉氏染液工作液的配製
在 97 mL pH 7.2 磷酸鹽緩衝液中加入 3 mL吉氏染色原液並混勻,或97 mL實驗用純水中加入3mL商品吉氏染液原液並混勻。
B.3.3 10%吉氏染液工作液的配製
在 90 mL pH 7.2 磷酸鹽緩衝液中加入 10 mL吉氏染色原液並混勻,或90 mL實驗用純水中加入10 mL商品吉氏染液原液並混勻。
B.3.4 注意事項
吸取吉氏染色原液時切勿搖晃盛染色原液瓶子。吉氏染色工作液應現用現配,切勿將未用完的吉氏染色工作液倒回原液瓶中。
8.4 B.4 單張血塗片染色法
單張血塗片吉氏染色常用於臨牀巴貝蟲病患者的巴貝蟲顯微鏡檢測。採用3%吉氏染液染色30min或更長時間。該染色法染色的血塗片可長期保存。也可採用 10%吉氏染液染色8 min~10min,但該染色法染色的血塗片不適合長期保存。
8.4.1 B.4.1 3%吉氏染液染色法
B.4.1.1. 把經甲醇固定的薄血膜塗片充分乾燥後,血膜面朝上水平放置在染色盤中。
B.4.1.2. 用吸管吸取新配製的 3%吉氏染液 3 mL 左右,滴加於厚、薄血膜上,至染液均勻覆蓋血膜,不溢出爲止。
B.4.1.3. 靜置染色約 30 min。
B.4.1.4. 將染色盤移至沖水池,用緩慢流水沿血塗片上緣沖洗 1 min。B.4.1.5. 將染色後的血塗片血膜面朝下插入血片乾燥架,晾乾。
8.4.2 B.4.2 10%吉氏染液快速染色法
B.4.2.1. 把經甲醇固定的薄血膜塗片充分乾燥後,血膜面朝上水平放置在染色盤上。
B.4.2.2. 用吸管吸取新配製的 10%吉氏染液約 3 mL,滴加於厚、薄血膜上,至染液均勻覆蓋血膜,不溢出爲止。
B.4.2.3. 靜置染色 8 min ~10 min。
B.4.2.4. 將染色盤移至沖水池,沿血塗片上緣用緩慢流水沖洗 1 min。
B.4.2.5. 將染色後的血塗片血膜面朝下插入血片乾燥架,晾乾。
8.5 B.5 成批血塗片染色
成批血塗片染色常用於人羣流行病學調查中的巴貝蟲顯微鏡檢測,一般採用2%吉氏染液進行批量血塗片染色。
B.5.1. 將每張血塗片的血膜朝一個方向插入染色缸中,或將每對血塗片的血膜朝外插入染色缸中。
B.5.2. 倒入新配製的 2%吉氏染液浸沒厚、薄血膜。
B.5.3. 靜置染色 30 min以上。
B.5.4. 向染色缸中注入自來水至溢出,除去染液表面浮渣,將染色缸中殘餘的染液傾出,加入自來水,緩慢沖洗 2次 ~3 次。
8.6 B.6 血塗片保存
用吸水紙吸去已檢血塗片血膜表面的香柏油,在血膜上滴加 2 滴~3 滴二甲苯,然後用吸水紙吸乾。置血塗片於玻片盒內,避光、乾燥和陰涼保存,以備複覈。注意:專用浸油無需用二甲苯清洗,可直接用吸水紙吸乾。
9 附錄C(資料性附錄)形態學
9.1 C.1 形態
巴貝蟲在紅細胞內寄生時形態具有多樣性。常見蟲體形態有環形、圓形、杆形、點狀、梨形、阿米巴形等。典型形態爲梨形,往往在一個紅細胞內有多個蟲體寄生,以 1個~4個蟲體居多,可形成三聯體或四聯體型,即馬爾他十字形,且可爲不同發育時期的蟲體。經吉氏染色後,胞漿呈藍色,核呈紫紅色。

圖C.1 薄血膜片中田鼠巴貝蟲
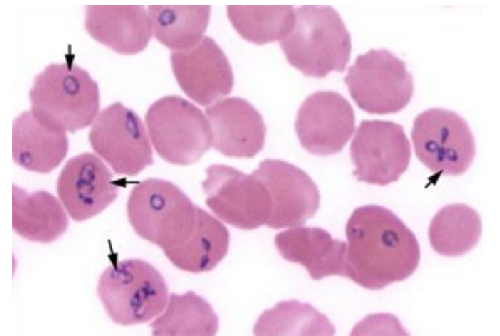
圖C.2 薄血膜片中分歧巴貝蟲(引自Mørch K, Holmaas G, Frolander, et al. Severe humanBabesiadivergens infection in Norway. Int J Infect Dis, 2015, 33:37-38)
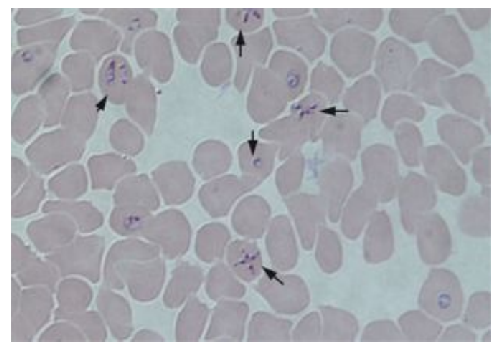
圖C.3 薄血膜片中鄧肯巴貝蟲
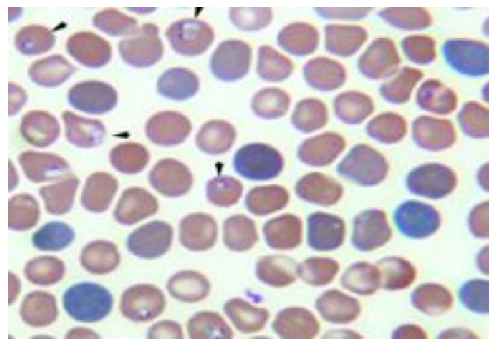
圖C.4 薄血膜片中獵戶巴貝蟲(引自Sun Y, Li SG, Jiang JF, et al. Babesia venatorum Infectionin Child, China. Emerg Infect Dis, 2014, 20(5):896-897)
10 參考文獻
[1] 劉恩勇,趙俊龍. 巴貝斯蟲病(第一版)[M].武漢:湖北人民出版社2001,21-30.
[2] 吳觀陵.人體寄生蟲學(第4版)[M].北京:人民衛生出版社,2013,233-237.
[4] Zhou X, Xia S, Huang JL, et al. Human babesiosis, an emerging tick-borne disease in the People’sRepublic of China[J].Parasites & Vectors 2014, 7:509.
[5] Mørch K, Holmaas G, Frolander, et al. Severe human Babesia divergens infection in Norway[J].Int JInfect Dis, 2015, 33:37-38.
[6] Sun Y, Li SG, Jiang JF, et al. Babesia venatorum Infection in Child, China[J].Emerg Infect Dis, 2014, 20(5):896-897.
[7] WS/T 564 巴貝蟲病診斷.