1 拼音
W S / T 6 3 0 — 2 0 1 8 rì běn xuè xī chóng kàng tǐ jiǎn cè jiàn jiē hóng xì bāo níng jí shì yàn
3 基本信息
ICS 11.020
C 61
中華人民共和國衛生行業標準WS/T 630—2018《日本血吸蟲抗體檢測 間接紅細胞凝集試驗》(Detection of antibody against Schistosoma japonicum—Indirect haemagglutination test)由中華人民共和國國家衛生健康委員會於2018年09月26日《關於發佈〈土源性線蟲病的傳播控制與阻斷〉等6項推薦性衛生行業標準的通告》(國衛通〔2018〕21號)發佈,自2019年04月01日起實施。
4 發佈通知
關於發佈《土源性線蟲病的傳播控制與阻斷》等6項推薦性衛生行業標準的通告
國衛通〔2018〕21號
現發佈《土源性線蟲病的傳播控制與阻斷》等6項推薦性衛生行業標準,編號和名稱如下:
WS/T 630—2018 日本血吸蟲抗體檢測 間接紅細胞凝集試驗
WS/T 631—2018 日本血吸蟲毛蚴檢測 尼龍絹袋集卵孵化法
上述標準自2019年4月1日起施行。
特此通告。
國家衛生健康委員會
2018年9月26日
5 前言
本標準按照GB/T 1.1—2009給出的規則起草。
本標準起草單位:安徽省血吸蟲病防治研究所、中國疾病預防控制中心寄生蟲病預防控制所、浙江省醫學科學院寄生蟲病研究所、江蘇省血吸蟲病防治研究所、江西省寄生蟲病防治研究所。
本標準主要起草人:張世清、汪天平、許靜、聞禮永、章樂生、鄭彬、熊彥紅、梁幼生、林丹丹。
6 標準正文
6.1 1 範圍
本標準適用於各級疾病預防控制機構和醫療機構對人體血清中日本血吸蟲抗體的檢測。
6.2 2 術語和定義
下列術語和定義適用於本文件。
2.1
血吸蟲病 schistosomiasis
由血吸蟲寄生於人和其他哺乳動物所引起的疾病,在我國特指日本血吸蟲病(schistosomiasisjaponica)。
注:改寫GB 15976—2015,定義3.1
2.2
間接紅細胞凝集試驗 indirect haemagglutination test
將抗原包被於紅細胞表面,成爲致敏的載體,然後與相應的抗體結合,通過抗體橋聯,出現肉眼可見的凝集現象,以檢測樣本中的相應抗體。最常用的紅細胞爲健康人“O”型紅細胞。
2.3
可溶性蟲卵抗原 soluble egg antigen
血吸蟲蟲卵經勻漿和超聲破碎等處理後離心收集的上清液,含蛋白質、糖蛋白、多糖等多種成分複合物。
6.3 3 儀器設備
3.1 臺式低速離心機
最高轉速≥2 500 r/min,或最大相對離心力≥800 g。
3.2 平板微量振盪器
3.3 電熱恆溫水浴箱
控溫範圍室溫+5 ℃~99.9 ℃,溫度分辨率/波動度0.1 ℃/±0.5 ℃。
=3.4 微量移液器
量程範圍10 μL~100 μL,增量1 μL;量程範圍100 μL~1 000 μL,增量5 μL。
6.4 4 試劑材料
4.1 凍幹致敏紅細胞
主要組成成分爲日本血吸蟲可溶性蟲卵抗原、健康人“O”型紅細胞和蔗糖,製備方法參見附錄A。
正常兔混合血清,參見附錄A。
4.4 稀釋液
4.5 血凝反應板
6.5 5 檢測步驟
6.5.1 5.1 樣本準備
採集末梢血100 μL或靜脈血2 mL,室溫下放置至血塊收縮後,800 g 離心5 min,分離出血清後進行檢測,參見附錄B。
6.5.2 5.2 樣本檢測
5.2.1 待測樣本編號,從左到右按 1~n 號依次排列。
5.2.2 陰性對照血清、陽性對照血清各加 100 μL 稀釋液,使其充分溶解,移液器吹打數次混勻後備用。
5.2.3 取血凝反應板,橫向平放縱向使用。於第 1 列第 1 孔加稀釋液 100 μL,第1 列的第3、4孔各加稀釋液 25 μL,第 2 孔不加稀釋液。
5.2.4 於第 1 列第 1 孔加 1 號待測樣本 25 μL,充分混勻後吸出 25 μL 至第2 孔,再從第1 孔吸出25μL至第 3 孔,充分混勻後吸出 25 μL 至第 4 孔,充分混勻後吸出 25 μL 棄去。
5.2.5 同上操作,依次進行第 2~n 號樣本、陰性對照血清、陽性對照血清的倍比稀釋,血凝反應板縱向 4 孔的血清稀釋度依次爲 1:5、1:5、1:10、1:20。
5.2.6 每支凍幹致敏紅細胞加 1 mL 稀釋液,充分混勻後備用。
5.2.7 除每列第 1 孔血清稀釋孔外,其餘血清稀釋孔各加致敏紅細胞懸液25 μL,血凝反應板置微量振盪器震搖 1 min~2 min,封板並置 37 ℃電熱恆溫水浴箱 30 min,在白色背景下觀察結果,參見附錄B。
6.6 6 結果判定
7 附錄A(資料性附錄)主要試劑材料製備方法
7.1 A.1 凍幹致敏紅細胞
7.1.1 A.1.1 可溶性蟲卵抗原
取凍幹蟲卵, 0.01%硫柳汞生理鹽水配製懸液,組織勻漿器研磨並置﹣20 ℃反覆凍融3次,10000g離心30 min,取上清液。測定蛋白含量後,用硫柳汞生理鹽水稀釋至0.75 mg/mL,分裝到西林瓶,置﹣20 ℃保存備用。
7.1.2 A.1.2 醛化紅細胞
A.1.2.1 取健康人“O”型紅細胞,用生理鹽水洗滌3次,移入刻度離心管,800 g 離心10 min,記錄壓積紅細胞體積。
A.1.2.2 取壓積紅細胞,每1 mL加 pH 7.2PBS 25 mL混勻,再緩慢滴加2.5%戊二醛2 mL,邊滴邊搖。室溫搖盪1 h,PBS洗滌3次,再用蒸餾水洗滌2次。最後用0.01%硫柳汞生理鹽水配成10%醛化紅細胞懸液,置2 ℃~8 ℃備用。
7.1.3 A.1.3 鞣化紅細胞
A.1.3.1 配製含0.01%鞣酸的生理鹽水,與等量的0.1 mol/L pH 7.2PBS混勻。A.1.3.2 取壓積醛化紅細胞倒入上述溶液中配成1%濃度,置37 ℃恆溫水浴振盪器中振搖15min,用 pH 7.2PBS洗滌3次。
A.1.3.3 將洗滌後的紅細胞倒入0.1 mol/L pH 6.4PBS溶液中配成1%濃度,充分混勻,即爲鞣化紅細胞。
7.1.4 A.1.4 致敏紅細胞懸液
A.1.4.1 鞣化紅細胞懸液中加入終濃度爲0.25%的可溶性蟲卵抗原,充分混勻,置37 ℃恆溫水浴振盪器中振搖45 min致敏。
A.1.4.2 離心沉澱棄去上清液,以含1%正常兔血清(經56 ℃滅活30 min後的血清)的pH7.2PBS洗滌沉澱以去除未結合的可溶性抗原,再以含1%正常兔血清的 pH 7.2PBS配製4%濃度致敏紅細胞懸液。
7.1.5 A.1.5 凍幹致敏紅細胞
在致敏紅細胞懸液中加入蔗糖(10%終濃度)和正常兔血清(2%終濃度)。搖勻後分裝於2mL的安瓿瓶內,每支0.5 mL。將分裝後的致敏紅細胞放入冷凍乾燥機內進行凍幹,並用封口機進行封口。凍幹致敏紅細胞外觀爲褐色或淡紅色疏鬆體,間接血凝法測定陽性對照血清效價不低於1:640,測定陰性對照血清效價不高於1:5。
7.2 A.2 陽性對照血清
WS/T 630—20185選擇體重2.5 kg~3.0 kg的健康家兔,每隻感染800條~1 000條日本血吸蟲尾蚴,飼養60 d後,抽取心臟全血,分離血清,混合後按每支0.1 mL分裝於微量離心管凍幹,作爲陽性對照血清。陽性對照血清檢測效價不低於1:640。
7.3 A.3 陰性對照血清
選擇體重2.5 kg~3.0 kg的健康家兔,抽取心臟全血,分離血清,選出沒有溶血的血清滅活補體(56℃滅活30 min),混合後按每支0.1 mL分裝微量離心管凍幹,作爲陰性對照血清。陰性對照血清檢測效價不高於1:5。
7.4 A.4 稀釋液
稱取十二水合磷酸氫二鈉35.8 g,氯化鈉8.5 g,加去離子水(或蒸餾水)至1 000 mL,稱A液;稱取磷酸二氫鉀6.8 g,氯化鈉8.5 g,加去離子水(或蒸餾水)至1 000 mL,稱B液。按A液:B液爲72:28的比例混合,即爲pH 7.2磷酸鹽緩衝液。
8 附錄B(資料性附錄)操作程序
8.1 B.1 操作步驟示意圖見圖B.1。
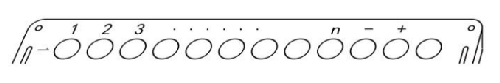
a) 樣本編號

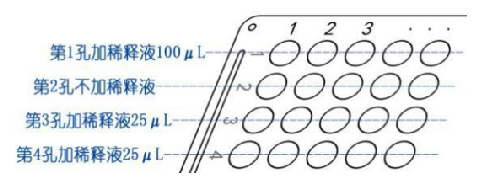
c) 血凝板加稀釋液

d) 待測樣本稀釋
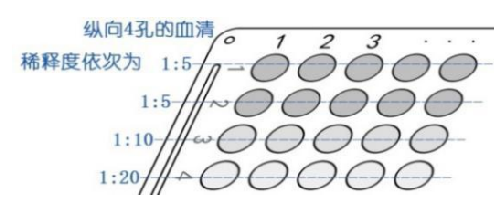
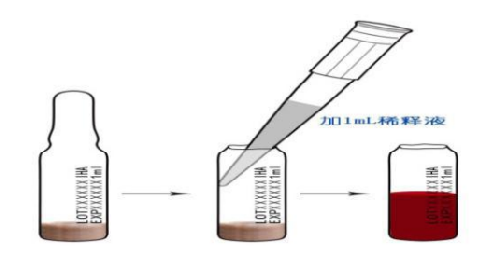
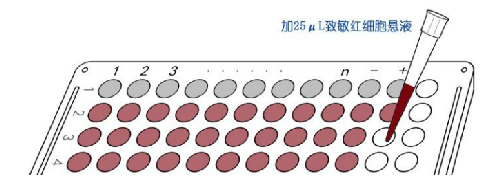
圖B.1 操作步驟示意圖
8.2 B.2 操作注意事項
B.2.1 樣本採集與保存:末梢血一般採用聚乙烯塑料管採集,塑料管孔徑2 mm,長度10 cm。靜脈血一般採用一次性真空採血管採集。全血採集後應在4 h內進行血清分離。血清樣本不能混有紅細胞或被細菌污染,血清量應不少於25 μL。血清樣本若不能及時檢測,可在2 ℃~8 ℃保存3 d~5 d,長時間保存應置於﹣20 ℃以下冷凍保存。
B.2.2 試劑準備:檢測試劑如果從冰箱取出,應放在室溫條件下平衡30 min以上再行使用。
B.2.3 加樣:使用移液器加樣,每檢測一個樣本應更換吸頭,在倍比稀釋待檢血清中,混勻時應避免產生氣泡(混勻吸打都在第一檔位進行)而影響吸液量的準確性。
B.2.4 致敏紅細胞懸液:配置好的紅細胞懸液使用前需充分混勻,多樣本操作時需在加懸液過程中不時混勻懸液,以免懸液中的紅細胞沉底而影響結果的準確性。
B.2.5 加樣後的血凝反應板應封板(加蓋玻璃板或一次性封口膜,或放置密閉溼盒內)後,方可置37℃電熱恆溫水浴箱。
B.2.6 結果觀察:應在10 min內完成結果觀察;觀察結果時不宜震搖反應板,以免凝集分散,影響結果判斷。
B.2.7 血凝反應板的清洗:血凝反應板應使用96孔“V”型有機玻璃板,使用後應及時清洗。清洗時不可用銳物擦洗或用酸鹼溶液浸泡,可使用清洗器或高壓自來水沖洗乾淨,再用蒸餾水清洗1次~2次,甩幹後倒置於37 ℃溫箱烘乾備用。
9 附錄C(規範性附錄)結果判定標準
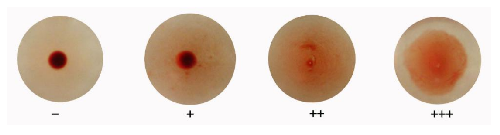
C.1 陰性反應:紅細胞全部下沉在孔底,形成緊密、邊緣光滑的小圓點。以“-”表示反應強度。
C.2 陽性反應:紅細胞出現程度不同的凝集反應。以“+” “++”和“+++”表示反應強度。“+”紅細胞大部分沉集於孔底,形成一圓點,周圍有少量凝集的紅細胞,肉眼見周邊模糊(或中間出現較爲明顯的空白點)。
“++”紅細胞多數在孔底周圍形成薄層凝集,孔底中心可見少量紅細胞下沉的小圓點。“+++”紅細胞形成薄層凝集,佈滿整個孔底,邊緣呈現不規則的皺褶。
10 參考文獻
[1] Kagan I G. Hemagglutination after Immunization with Schistosome Antigens.[J]. Science,1955,122(122):376-377.
[2] 楊贊元,蘇瑞雲. 致敏凍幹血球微量間接血凝試驗診斷血吸蟲病的研究[J]. 中國寄生蟲學與寄生蟲病雜誌,1985(1):17-19.
[3] 吳福東,謝治民,袁斯姣,等. 間接血凝試驗診斷血吸蟲病的研究[J]. 中國血吸蟲病防治雜誌,1991,(3):138-141.
[4] 衛生部疾控司.血吸蟲病防治手冊[M]. 上海科學技術出版社,2000.第三版.
[5] 許靜,馮婷,郭家鋼,等. 我國幾種日本血吸蟲病免疫診斷試劑的綜合測評[J]. 中國血吸蟲病防治雜誌,2005,17(2):116-119.
[6] WS 261-2006,血吸蟲病診斷標準[S]. 北京:人民衛生出版社,2006.
[7] 王恩木,許強,張世清,等. 檢測日本血吸蟲抗體標準化間接血凝試劑盒的研製[J]. 中國病原生物學雜誌,2007, 2(6):421-423.
[8] 姜唯聲,陳年高,黃美嬌,等. 日本血吸蟲抗體檢測試劑盒(IHA法)的研製與應用[J]. 中國血吸蟲病防治雜誌,2013,25(6):594-597.
[9] 章樂生,王恩木,張世清,等. 日本血吸蟲間接血凝法抗體檢測試劑盒稀釋液的改進[J]. 熱帶病與寄生蟲學,2014,12(4):224-226.
[10] 張聰,王暉,李博,等. 湖北省日本血吸蟲病抗體檢測試劑盒的質量評價[J]. 公共衛生與預防醫學,2015, 26(3):53-55.