1 拼音
W S / T 6 1 7 — 2 0 1 8 tiān mén dōng ān suān ān jī zhuǎn yí méi cuī huà huó xìng nóng dù cān kǎo cè liáng chéng xù
2 英文參考
Reference procedure for the measurement of catalytic activity concentration of aspartate aminotransferase
3 基本信息
CS 11.020
C 50
中華人民共和國衛生行業標準WS/T 617—2018《天門冬氨酸氨基轉移酶催化活性濃度參考測量程序》(Reference procedure for the measurement of catalytic activity concentration of aspartate aminotransferase)由中華人民共和國國家衛生健康委員會於2018年08月20日《關於發佈〈臨牀實驗室定量檢驗結果的自動審覈〉等兩項推薦性衛生行業標準的通告》(國衛通〔2018〕16號)發佈,自2019年03月01日起實施。
4 發佈通知
關於發佈《臨牀實驗室定量檢驗結果的自動審覈》等兩項推薦性衛生行業標準的通告
國衛通〔2018〕16號
現發佈《臨牀實驗室定量檢驗結果的自動審覈》等兩項推薦性衛生行業標準,編號和名稱如下:
WS/T 616—2018 臨牀實驗室定量檢驗結果的自動審覈
WS/T 617—2018 天門冬氨酸氨基轉移酶催化活性濃度參考測量程序
上述標準自2019年3月1日起施行。
特此通告。
國家衛生健康委員會
2018年8月20日
6 標準正文
6.1 1 範圍
本標準規定了在臨牀醫學應用中,測量天門冬氨酸氨基轉移酶催化活性濃度的參考測量程序。
本標準主要適用於參考實驗室,作爲天門冬氨酸氨基轉移酶催化活性濃度測量的溯源,也可作爲與酶催化活性濃度檢驗有關的儀器和試劑生產企業的溯源,可供有關認可監督管理單位及質量管理部門應用。此參考測量程序可用於我國臨牀常規方法測量結果的溯源。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
ISO 15193 體外診斷器具-生物源樣本中量的測量-參考測量程序的表述
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
實驗室樣品 laboratory sample
準備送到實驗室或實驗室接收的用於測定的原始樣品或原始樣品的分樣品。
3.2
3.3
分析部分 analytical portion
注:如果不需預處理,分析部分直接從原始樣品或實驗室樣品中取出。某些情況下,需將分析部分溶解成分析溶液再上機測定。
3.4
分析溶液 analytical solution
將分析部分溶解在氣體、液體或固體中而製備的溶液,溶解過程中可以有反應發生或無反應發生。
3.5
(某一物質系統的)基質 matrix(of a material system)
3.6
參考測量程序 reference measurement procedure
參考程序 reference procedure
在校準或參考物質定值時,爲提供測量結果所採用的測量程序,它用於評價由同類量的其他測量程序獲得的被測量的量值的測量正確度。
3.7
測量系統的靈敏度 sensitivity of a measuring system
靈敏度 sensitivity
3.8
分析特異性 analytical specificity
3.9
由一個影響量引起的系統測量誤差,該影響量自身在測量系統中不產生信號,但它會引起示值的增高或降低。
3.10
影響量 influence quantity
3.11
檢出限 detection limit;limit of detection
由給定測量程序獲得的測得值,其聲稱的物質成分不存在的誤判概率爲β,聲稱物質成分存在的誤判概率爲α。
注 1:國際理論和應用化學聯合會(IUPAC)推薦α和β的默認值爲 0.05。
注 2:有時使用縮寫詞 LOD。
3.12
校準品 calibrator
6.4 4 縮略語
下列縮略語適用於本文件。
AST:天門冬氨酸氨基轉移酶(Aspartate Aminotransferase)
GUM:測量不確定度表達指南(Guide to the expression of Uncertainty in Measurement)
IFCC:國際臨牀化學與檢驗醫學聯合會(International Federation of Clinical Chemistry and Laboratory Medicine)
LD:乳酸脫氫酶(Lactate Dehydrogenase)
MD:蘋果酸脫氫酶(Malate Dehydrogenase)
NAD:氧化型β-煙酰胺腺嘌呤二核苷酸(β-Nicotinamide-Adenine-Dinucleotide, oxidized form)
NADH:還原型β-煙酰胺腺嘌呤二核苷酸(β-Nicotinamide-Adenine-Dinucleotide, reduced form)
P-5-P:5′-磷酸吡哆醛(Pyridoxal-5-Phosphoric acid)
QUAM:化學測量中不確定度的評定(Quantifying Uncertainty In Analytical Measurement)
SOP:標準操作程序(Standard Operation Procedure)
6.5 5 測量原理和方法
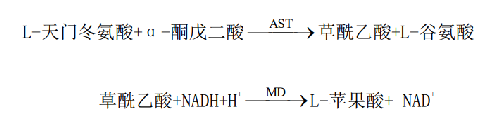
在339 nm下,監測NADH的氧化速率,吸光度的下降速率與AST催化活性濃度呈正比。
6.6 6 測量前試劑準備
6.6.1 6.1 試劑列表
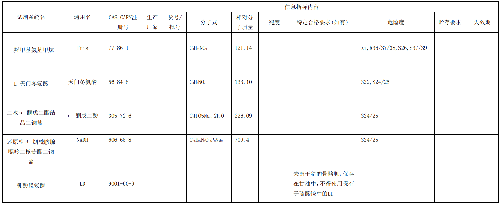
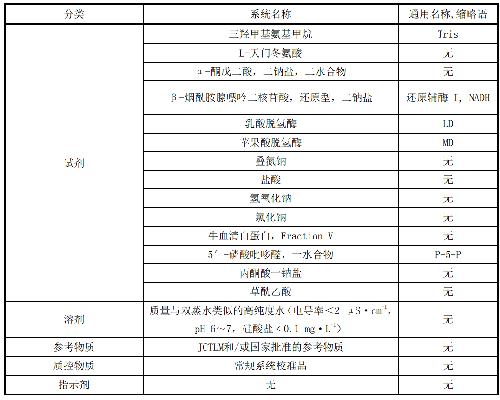
將所用試劑按表1列出。
表1 試劑列表
6.6.2 6.2 試劑原料信息
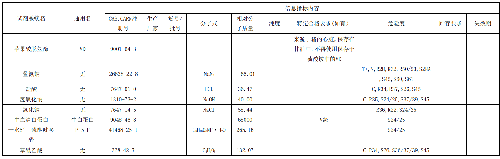
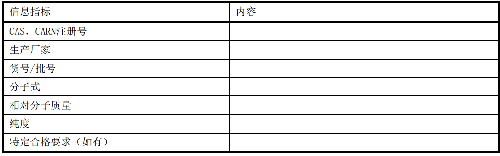
按表2填寫試劑原料詳細信息。
表 2 試劑原料詳細信息

AST測定所用每個試劑原料詳細信息見附錄A。宜使用最高純度的試劑。試劑的質量應由供應商提供分析證明。如果懷疑某一種化學物質中含有影響AST催化活性的不純物,應進行進一步的檢測,例如,比較不同廠家和不同批號的產品。建議使用在對比試驗中已經鑑定或認可的試劑。以下三種試劑需要注意安全:
鹽酸、氫氧化鈉和疊氮鈉對人體有傷害作用,操作人員應經過專門培訓,嚴格遵守操作規程,根據需要可以佩戴自吸過濾式防毒面具(全面罩)或頭罩型電動送風過濾式防塵呼吸器,戴化學安全防護眼鏡,穿橡膠耐酸鹼材料製成的防護服以及戴橡膠耐酸鹼手套等,做好安全防護工作。
6.6.3 6.3 試劑溶液配製
6.6.3.1 6.3.1 一般要求
製備溶液時各成分給出的質量是指100%含量。如果化學物質的含量低於100%[例如y(%)],則應用因子:Fcontent=100/y,計算出與給出質量相當的某化學物質的質量。溶液的製備應使用質量與雙蒸水類似的高純度水(電導率<2 μS·cm-1,pH 6~7,硅酸鹽<0.1 mg·L-1)。
每次稱重的擴展不確定度(k=2)(包括物質純度的不確定度)(正態分佈),應≤1.5%。
6.6.3.2 6.3.2 溶液 1
稱量1.17 g Tris、4.02 g天門冬氨酸(遊離酸)、0.052 g疊氮鈉,將上述物質按以下步驟處理:
——溶在約 80 mL 水中;
——加 4.2 mL~4.4 mL 5.00 mol·L-1的氫氧化鈉溶液;
——攪拌直到試劑完全溶解;
——混合液的pH值應比pH靶值低(約0.3 pH~0.9 pH);
——在 37℃用 2 mol·L-1氫氧化鈉溶液調節 pH 到 7.65;
——轉移至 100 mL 容量瓶中;
——將容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶的刻度線。
最終配製的溶液中 Tris 濃度爲 96.92 mmol·L-1,天門冬氨酸濃度爲 302.4 mmol·L-1,疊氮鈉濃度爲 8.00 mmol·L-1。該溶液 2℃~8℃穩定性爲 3 個月。
注: 加水之後天門冬氨酸不溶解,必須先加氫氧化鈉溶液,以5 mol·L-1代替2 mol·L-1氫氧化鈉溶液可減少所需用量,精確調整pH值時需用2 mol·L-1氫氧化鈉溶液。
6.6.3.3 6.3.3 溶液 2
稱量1.17 g Tris、0.052 g疊氮鈉,將上述物質按以下步驟處理:
——將上述 2 種試劑溶在約 80 mL 水中;
——在 37℃用 1 mol·L-1鹽酸調 pH 值到 7.65;
——轉移至 100 mL 容量瓶;
——將容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶刻度線。
最終配製的溶液中 Tris 濃度爲 96.92 mmol·L-1,疊氮鈉濃度爲 8.00 mmol·L-1。該溶液在 2℃~8℃穩定性爲 3 個月。
6.6.3.4 6.3.4 溶液 3
——將 16.7 mg P-5-P 一水化合物用 6mL 溶液 2 溶解;
——轉移至 10 mL 容量瓶;
——加溶液 2(20℃)到容量瓶刻度線;
——避光保存(如棕色瓶)。
最終配製的溶液中 P-5-P 濃度爲 6.30 mmol·L-1。此溶液在 2℃~8℃穩定性爲 1 周。
6.6.3.5 6.3.5 溶液 4
稱量16.1 mg NADH二鈉鹽,按以下步驟處理:
——溶於 2.00 mL 溶液 2 中;
——避光保存(如棕色瓶)。
最終配製的溶液中NADH濃度爲11.34 mmol·L-1。此溶液在2℃~8℃穩定性爲1周。
6.6.3.6 6.3.6 酶試劑的稀釋液
稱量1.20 g牛血清白蛋白、0.90 g氯化鈉,將上述物質按以下步驟處理:
——將上述 2 種試劑溶於約 80 mL 水中;
——轉移至 100 mL 容量瓶;
——將容量瓶和水平衡至 20℃;
——加水(20℃)至容量瓶刻度線。
最終配製的溶液中氯化鈉濃度爲154 mmol·L-1。此溶液在2℃~8℃穩定性至少1個月。
6.6.3.7 6.3.7 溶液 5
按以下步驟配製:
——用6.3.6中的酶試劑稀釋液稀釋LD儲存液,使LD催化活性濃度在37℃時爲3.78 mkat·L-1(226.8kU·L-1)。按式(1)計算稀釋LD儲存液所需酶試劑稀釋液體積。
Vdiluent= VLDSTOCK×(LDSTOCK-226.8)/226.8 ……(1)
式中:
Vdiluent——稀釋LD儲存液所需酶試劑稀釋液體積,單位爲毫升(mL);
VLDSTOCK——LD儲存液體積,單位爲毫升(mL);
LDSTOCK——LD儲存液中LD催化活性濃度,單位爲毫凱塔爾每升(mkat·L-1)或千單位每升(kU·L-1)。
示例1:見附錄B。
——用6.3.6中的酶試劑稀釋液稀釋MD儲存液,使MD催化濃度在37℃時爲2.52 mkat·L-1(151.2 kU·L-1)。
按式(2)計算稀釋MD儲存液所需酶試劑稀釋液體積。
Vdiluent= VMDSTOCK×(MDSTOCK-151.2)/151.2 ……(2)
式中:
Vdiluent——稀釋MD儲存液所需酶試劑稀釋液體積,單位爲毫升(mL);
VMDSTOCK——MD儲存液體積,單位爲毫升(mL);
MDSTOCK——MD儲存液中MD催化活性濃度,單位爲毫凱塔爾每升(mkat·L-1)或千單位每升(kU·L-1)。
示例2:見附錄C。
最終配製的溶液中LD催化活性濃度在37℃時爲1.89 mkat·L-1(113.4 kU·L-1)、MD催化活性濃度在37℃時爲1.26 mkat·L-1(75.6 kU·L-1)。該溶液2℃~8℃穩定性爲2 d。
6.6.3.8 6.3.8 反應溶液
分別移取10.000 mL溶液1、0.200 mL溶液3、0.200 mL溶液4、0.100 mL溶液5,將上述溶液充分混勻,避光保存。此溶液在2℃~8℃穩定性爲1 d。
6.6.3.9 6.3.9 起始試劑溶液
稱量0.326 g α-酮戊二酸二鈉二水化合物,按以下步驟處理:
——溶於約 6 mL 水中;
——轉移至 10 mL 容量瓶;
——將容量瓶和水平衡至 20℃;
——加水(20℃)至刻度線。
最終配製的溶液中α-酮戊二酸二鈉濃度爲 144.0 mmol·L-1。此溶液在 2℃~8℃穩定性爲 1 周。
6.6.3.10 6.4 溫度對緩衝溶液 pH 的影響
當溫度偏離 37℃ 時,調節 pH 值的方法:將溫度計與 pH 電極同時浸入混合液中。然後將溶液邊攪拌邊滴定至表中列舉在當前測定溫度下的 pH 值。在校準、控制和調節 pH 的過程中,攪拌速度要一致。
pH 電極必須位於被攪拌溶液的中心。
配製溶液 1、溶液 2 時,需根據不同溫度調整 pH 值,分別按照附錄 D 中 D.1 和 D.2 調節溶液 pH 值。
爲此,接近靶值時應重新控制溫度,同樣的方法也適用於 pH 計的溫度補償調節。
6.7 7 測量前儀器準備
6.7.1 7.1 儀器列表
實驗室應在表3登記主要測量儀器(分光光度計)和主要輔助儀器(點式溫度計、天平、pH計、恆溫水浴箱、稀釋配液儀、移液器等)。
表 3 測量儀器和輔助儀器列表

6.7.2 7.2 儀器性能要求
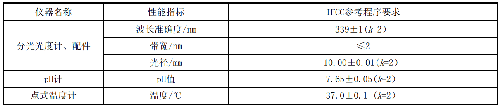
分光光度計及輔助儀器主要性能的要求,見表4。
表 4 分光光度計及輔助儀器主要性能的要求
6.7.3 7.3 分光光度計準備
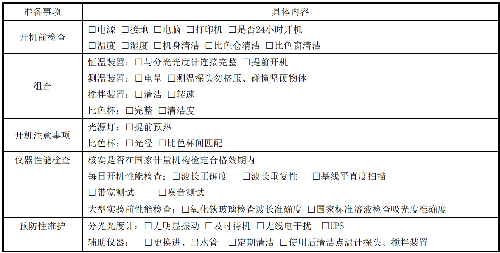
測量工作前,按已制定的SOP文件對分光光度計進行檢查,填入表5。
表 5 分光光度計準備
各實驗室可根據具體情況制定本實驗室分光光度計準備流程圖。
6.7.4 7.4 點式溫度計準備
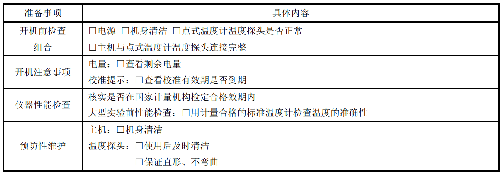
測量工作前,按已制定的SOP文件對點式溫度計進行檢查,填入表6。
表 6 點式溫度計準備
各實驗室可根據具體情況制定本實驗室點式溫度計準備流程圖。
6.7.5 7.5 恆溫水浴箱準備
測量工作前,按已制定的SOP文件對恆溫水浴箱進行檢查,填入表7。
表 7 恆溫水浴箱的準備
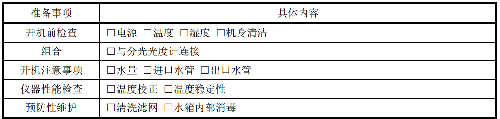
各實驗室可根據具體情況制定本實驗室恆溫水浴箱準備流程圖。
6.7.6 7.6 稀釋配液儀準備(實驗室若有)
測量工作前,按已制定的SOP文件對稀釋配液儀進行檢查,填入表8。
表 8 稀釋配液儀的準備
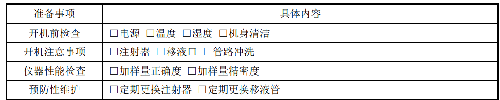
各實驗室可根據具體情況制定本實驗室稀釋配液儀準備流程圖。
6.7.7 7.7 移液器準備
測量工作前,按已制定的SOP文件對移液器進行檢查,填入表9。
表 9 移液器的準備

各實驗室可根據具體情況制定本實驗室移液器準備流程圖。
6.7.8 7.8 天平準備
測量工作前,按已制定的SOP文件對天平進行檢查,填入表10。
表 10 天平準備


各實驗室可根據具體情況制定本實驗室天平準備流程圖。
6.7.9 7.9 pH 計準備
測量工作前,按已制定的SOP文件對pH計進行檢查,填入表11。
表 11 pH 計準備
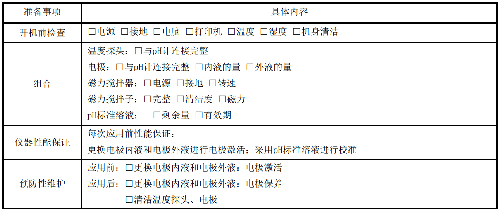
各實驗室可根據具體情況制定本實驗室pH計準備流程圖。
6.8 8 測量前採樣和樣品準備
6.8.1 8.1 樣品接受信息
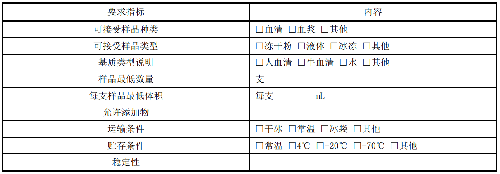
宜以表格形式記錄樣品接收的詳細信息,見表12。對不符合樣品接收要求的樣品應及時與委託方聯繫。
表 12 AST 樣品接收要求

6.8.2 8.2 分析樣品的類型
——參考物質(RM);
——質控物質;
——其他標本。
6.8.3 8.3 分析樣品的順序
——參考物質(RM);
——質控物質;
——被分析的“未知”物質。
上述分析樣品重複測量可減小測量結果不確定度。從一個分析樣品到下一個分析樣品的攜帶污染應小於 0.5%。
6.8.4 8.4 分析樣品的處理過程
——AST參考程序測量的分析樣品多爲凍乾粉或深低溫的冰凍樣品,測量前需處理爲均勻的液體狀態,分析部分應取自該液體分析樣品進行測量。
——對每一類型實驗室樣品應制定詳盡的樣品處理SOP文件,並有記錄證實操作達到預期要求。實驗室樣品若爲凍乾粉或乾粉,應使用質量與雙蒸水類似的高純度水(電導率<2 μS·cm-1,pH 6~7,硅酸鹽<0.1 mg·L-1)溶解;若爲冷凍液體如冰凍血清等,應按SOP文件在嚴格控制的條件下融解。
——應有處理參考物質的SOP和記錄。
6.9 9 測量過程
6.9.1 9.1 測量條件
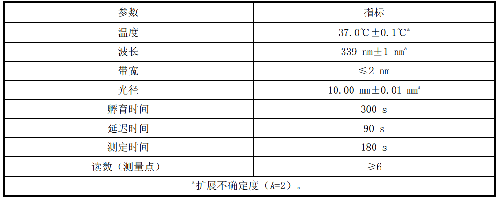
AST 催化活性濃度測量條件見表 13。
表 13 AST 催化活性濃度測量條件
6.9.2 9.2 測量步驟
9.2.1 監測比色杯內溫度,達到要求時開始準備試劑和分析溶液。
9.2.2 將實驗所需的反應溶液進行脫氣處理。可採用的脫氣的方法是:採用溫度爲35℃的真空爐或將溶液加熱至35℃,在真空乾燥器中儲存1h,同時進行磁力攪拌。如果脫氣溶液當天不能用完,下次使用前應再次脫氣。
9.2.3 將一份適當體積(約 0.400 mL)起始試劑溶液在 37℃下平衡,剩餘的起始試劑應保存在 2℃~8℃。
9.2.4 將 6.3 中所列試劑體積按表 14 的順序加入到反應杯中。
表 14 總體轉換率測量的分析系統(AST 催化反應速率和空白率)
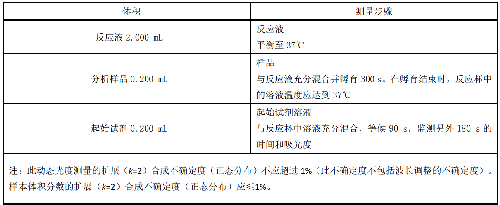
注:此動態光度測量的擴展(k=2)合成不確定度(正態分佈)不應超過 1%(此不確定度不包括波長調整的不確定度)。
樣本體積分數的擴展(k=2)合成不確定度(正態分佈)應≤1%。
9.2.5詳細的測量流程見圖1

6.9.3 9.3 最終完全反應混和物的濃度
AST 催化活性濃度測定最終完全反應混合物的濃度見表 15。

6.9.4 9.4 試劑空白率測量
爲了測量試劑空白率,用9 g·L-1(154 mmol·L-1)NaCl溶液代替分析樣品,測量方法同9.2。
注1:試劑空白的反應呈非線性動力學,試劑空白吸光度的絕對變化值如大於0.002 min-1,相關試劑應丟棄。
注2:由於動力學的非線性,試劑空白重複性較差。建議重複測量3次,採用3次測量的平均值參與計算。
6.9.5 9.5 分析樣品空白率測量
採用9 g•L-1(154 mmol•L-1)氯化鈉溶液代替起始試劑溶液測量分析樣品空白率。按上述步驟進行操作。
注:分析樣品空白率可被測量和記錄,但在計算質控血清和校準品中 AST 催化活性時不考慮。一旦分析樣品空白率超過AST 總催化活性的 1%,則警告有關物質不適宜作校準用。
6.10 10 測量結果處理
6.10.1 10.1 測量結果計算
通過迴歸分析(最小二乘法)計算吸光度隨時間改變的變化率。減去試劑空白率後,即校正後的分析樣品吸光度變化率。按式(3)計算 AST 催化活性濃度:
式中:
bAST——AST的催化活性濃度,單位爲微凱塔爾每升(μkat·L-1)或單位每升(U·L-1);
F ——係數,等於 1905[在 339nm 波長測量時,ε339(NADH)=630 ㎡·mol-1,爲 IFCC 與 IRMM 推
薦];
(ΔA/Δt)AST——經過試劑空白率校正後的分析樣品吸光度變化率,單位爲每秒(s-1)或每分(min-1)。
6.10.2 10.2 數據處理
對於計算的 AST 催化活性濃度,要進行數據處理:
——數據剔除:必要時,每個實驗室應建立適當的數據剔除規則;
——計算每批次測量值的均值、標準差,必要時應檢查數據分佈類型,計算均值的標準差(標準誤);
——根據 GUM 和 QUAM 原則計算測量結果的不確定度。
6.10.3 10.3 酶活性單位及換算關係
酶催化活性常用單位爲kat·L-1,使用時常出現多位小數,目前常以μkat·L-1或 nkat·L-1表示,但臨牀醫學中仍習慣於使用U·L-1。換算關係如下:
以U·L-1單位表示的催化濃度可通過乘以係數(f=0.01667)轉化成μkat·L-1。
6.10.4 10.4 測量不確定度的評定
6.10.4.1 10.4.1 定義被測量
應至少從下面幾個方面定義被測量:
——催化活性單位:kat·L-1或U·L-1;
——應考慮到血清中可能存在線粒體型AST(mAST)和細胞漿型AST(sAST);
——溶血時sAST可顯著升高;
6.10.4.2 10.4.2 建立數學模型
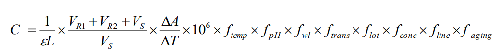
C爲輸出量,爲AST測量的催化活性濃度。影響測量的直接因素有: ⊿A/⊿T爲吸光度變化率; 爲摩爾吸光係數;L爲比色杯光徑;VR1爲反應液體積;VR2爲起始試劑體積;VS爲樣品體積。影響測量的間接因素有:temp爲溫度;pH;wl爲波長;trans爲透光度;lot爲試劑廠家與批號;conc爲試劑濃度;line爲方法線性;aging爲試劑老化。
6.10.4.3 10.4.3 不確定度分量的定量
應至少從下面幾個方面對不確定度的分量進行定量:
——測量結果的不精密度:一般將同一分析樣品分4天測量,每天連續測量3次,計算均值、標準差與變異係數。
——摩爾消光係數的不確定度:根據文獻摩爾消光係數的不確定度爲1%,可考慮爲三角形分佈。
——比色杯光徑的不確定度:比色杯光徑應經有資質的計量院所檢定或校準,引用證書上的不確定度,可考慮爲正態分佈。
——體積的不確定度:在重大測量前應對加反應液(VR1)、起始試劑(VR2)、分析樣品(VS)的加樣器或相應加樣設備進行校準,校準過程中產生的不精密度即爲加樣的不確定度,分別爲uVR1、uVR2、uVS,計算體積項[(VR1+VR2+VS)/ VS]不確定度,先計算分子項不確定度,![]() ,其相對值% u分子=u分子/(VR1+VR2+VS),分母項相對不確定度%u分母= us/Vs,則體積項的相對不確定度
,其相對值% u分子=u分子/(VR1+VR2+VS),分母項相對不確定度%u分母= us/Vs,則體積項的相對不確定度![]() ;應注意計算分母項不確定度時,計算不確定度的絕對值,而不是相對值。
;應注意計算分母項不確定度時,計算不確定度的絕對值,而不是相對值。
——⊿A/⊿t的不確定度:吸光度(A)與透光度和波長的不確定度有關,測量時間(t)的不確定度一般不考慮,因儀器計時器的精度一般都能達到十萬分之一,因此可忽略不計。
——透光度的不確定度:根據檢定證書上透光度的示值誤差計算,一般考慮爲矩形分佈。
——波長的不確定度:根據檢定證書上波長的示值誤差和重複性,計算波長的不確定度,一般考慮爲矩形分佈。
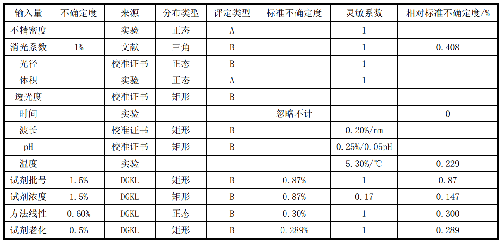
——pH的不確定度:根據pH計檢定證書或校準證書上儀器的示值誤差和重複性,計算pH計的不確定度,一般考慮爲矩形分佈。與pH有關的不確定度還應包括pH校準液的不確定度。同時應考慮pH的靈敏係數,可引用德國臨牀化學學會(DGKL)參考實驗室數據(18%)。
——溫度的不確定度:根據數字溫度計(點溫度計)檢定證書或校準證書上儀器的示值誤差和重複性,計算溫度計的不確定度。由於在測量酶催化活性時,對溫度的影響不僅來源於溫度計,更主要的來源於測量系統的溫控,應以實驗瞭解溫控系統的變化,計算出溫度影響的不確定度。同時應考慮溫度影響的靈敏係數,可引用德國臨牀化學學會(DGKL)參考實驗室數據(5.30%/℃)。
——試劑廠家與批號的不確定度:有關不同廠家與不同批號的試劑所引起的不確定度可自行進行實驗,也可引用DGKL的數據(1.5%),一般考慮爲矩形分佈。
——試劑濃度的不確定度:試劑濃度或純度導致的不確定度,可自行進行實驗 ,也可引用DGKL的數據(1.5%),其靈敏係數爲17%,一般考慮爲矩形分佈。
——方法線性的不確定度:方法線性引起的不確定度,可自行進行實驗 ,也可引用DGKL的數據(0.6%),一般考慮爲矩形分佈。
——試劑老化的不確定度:試劑老化所導致的不確定度,可自行進行實驗 ,也可引用DGKL的數據(0.5%),一般考慮爲矩形分佈。
6.10.4.4 10.4.4 建立不確定度預估表
表16 不確定度分量預估表
6.10.4.5 10.4.5 合成標準不確定度
根據不確定度傳播律,將上述12個不確定度分量進行合成,即爲相對合成標準不確定度uc。
6.10.4.6 10.4.6 擴展不確定度
擴展不確定度相對值:
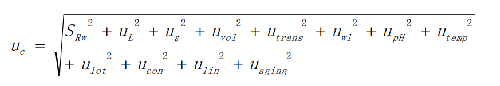
擴展不確定度的相對值乘以測量結果的均值,可得到擴展不確定的絕對值。
6.10.5 10.5 結果確認
6.10.5.1 10.5.1 實驗室內結果正確度評估
在進行重要測量前(如給參考物質/校準品賦值、測量室間比對樣品等),應先測定JCTLM或國家批准的參考物質,測量結果應在“靶值±不確定度”範圍內,否則應確認測量程序的正確度。
6.10.5.2 10.5.2 實驗室間比對進行結果確認
AST催化活性濃度參考測量程序由檢驗醫學國際權威學術組織IFCC提出,經多個參考實驗室認真評估後經JCTLM批准。30℃參考測量程序和37℃參考測量程序的比較參見附錄E。
實驗室應有 SOP 文件和記錄證實此活動。
6.11 11 結果報告
應設計適宜的測量結果報告格式,包括但不限於以下內容:
——測量所使用的參考程序:IFCC 在 37℃下測量 AST 催化活性濃度的原級參考測量程序;
測量單位:μkat·L-1或U·L-1;
6.12 12 分析可靠性
6.12.1 12.1 概念、價值及其應用
應依據不確定度、精密度、線性範圍、檢出限等來評估AST參考測量程序的分析可靠性。相關文獻及參考測量實驗室的有關數據表明本參考測量程序的分析性能優於臨牀酶活性濃度測量的常規方法,適合於臨牀常規測量程序的溯源。
6.12.2 12.2 測量不確定度
應根據GUM和QUAM原則計算測量不確定度。按照10.4不確定度計算方法,並結合比對實驗室數據,本參考程序的測量結果的相對合成標準不確定度在濃度4.07 μkat·L-1(244 U·L-1)時宜小於2.0%。
6.12.3 12.3 測量精密度
選擇2個濃度水平的質控物質,每天測量2次(2次間隔不少於2 h),每次測量均做雙份,連續測量20 d,按CLSI EP5-A3文件進行評價。應根據本實驗室測量條件評估本參考程序的重複性、期間精密度。
結合比對實驗室結果,本參考程序重複性CV宜小於1.5%,期間精密度CV宜小於2.0%。
6.12.4 12.4 檢出限
與分光光度計的最小分析信號有關。國際純粹與應用化學聯合會(IUPAC)對檢出限的規定,按照AST參考測量程序的操作步驟,測定試劑空白五次,用生理鹽水爲零值樣本,測定20次,計算![]() 與s,以
與s,以![]() +3s爲檢測限。結合比對實驗室數據,本參考程序測量的檢出限爲0.13 μkat·L-1(7.8 U·L-1)。
+3s爲檢測限。結合比對實驗室數據,本參考程序測量的檢出限爲0.13 μkat·L-1(7.8 U·L-1)。
6.12.5 12.5 線性範圍
參考CLSI EP6-A文件,設定實驗室的重複性和線性的允許誤差範圍分別爲1%和5%,選擇覆蓋IFCC文件提供線性範圍20%~30%的高(H)、低(L)濃度水平混合血清,按比例配製成9個系列濃度樣本,每個樣本重複測量2次,將所得數據進行多項式迴歸統計,結合比對實驗室數據,線性範圍檢測上限:<4.13μkat·L-1(247.7 U·L-1)。
6.12.6 12.6 誤差的來源
誤差主要包括以下幾個來源:
——AST 測量的線性範圍較窄。在孵育過程中,分析樣品中高濃度丙酮酸將導致大量消耗 NADH,這樣會減少線性範圍的上限,並顯著降低測量結果。偏離了參考程序中規定的延遲時間和測量時間,導致測量結果與原參考測量程序結果不一致。
——當質控物質和校準品 pH 值與參考程序中描述的 pH 值差別較大時,可導致 AST 測量不確定度增加。
——空氣中的 CO2會改變反應液的 pH 值,因此反應液容器應密封。溶液 1 和溶液 2 應至少每週監測一次 pH 值。
6.13 13 質量保證
6.13.1 13.1 實驗室環境
結合比對實驗室經驗,控制室內溫度20℃~30℃,溼度30%~70%。
6.13.2 13.2 室內質量控制
每個工作日開始正式測量分析樣品前均測量定值的質控物質,質控結果在質控物質靶值±2倍標準差以內,若失控,查找原因直至在可控範圍內方可進行實驗。應建立包括質控規則、操作步驟的室內質控SOP文件及記錄。
6.13.3 13.3 室間質量評價/能力驗證
JCTLM在2003年的國際參考實驗室能力比對計劃(RELA)中將本酶列爲比對項目之一。定期參加IFCC和國內權威機構組織的有關參考實驗室的室間質量評價計劃/能力驗證活動,結果應符合要求。當出現不符合情況時,應認真查找原因,建立失控及失控跟蹤記錄。
6.13.4 13.4 質量日誌
每個工作日完成工作日誌及環境控制等質量記錄。
8 附錄B(資料性附錄)測定酶儲存溶液中 LD 催化活性濃度
8.1 B.1 測量試劑
8.1.1 B.1.1輔助試劑
8.1.2 B.1.2 試劑製備
8.1.2.1 B.1.2.1測定LD催化活性濃度的反應液的組成:
——10.000 mL 溶液 1;
——0.200 mL 溶液 3;
——0.200 mL 溶液 4;
——0.100 mL 水;
——充分混勻,避光保存。
8.1.2.2 B.1.2.2 測量LD催化活性濃度的起始試劑溶液:
——0.0990 g(36.00 mmol·L-1)丙酮酸一鈉鹽;
——溶於約 6 mL 水中;
——轉移至 25 mL 容量瓶中;
——將容量瓶和水平衡至 20℃;
——加水至容量瓶的校準刻度線(20℃)。
最終配製的溶液中丙酮酸濃度爲 36.00 mmol·L-1。此溶液置 2℃~8℃穩定性爲 1 d。
8.1.2.3 B.1.2.3 LD儲存溶液的稀釋 (使用前進行):
——在10.000 mL酶試劑稀釋液中加入0.050 mL LD原液,充分混勻;第一步的稀釋比例是1∶201;
——將經以上稀釋的0.050 mL溶液加入到10.000 mL酶試劑稀釋液中,充分混勻;第二步的稀釋比例是1∶201;第一步和第二步總稀釋比例是1∶40401。
注:所用LD酶儲存溶液的催化濃度不同於上述步驟時,稀釋度不同,需要對稀釋因子(F稀釋)進行各自調整。
8.2 B.2 測定條件
8.2.1 B.2.1 最終完全反應混合物的濃度,見表B.1。
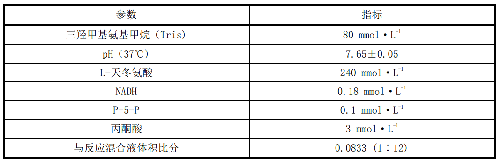
與反應混合液體積比分 0.0833 (1∶12)
8.2.2 B.2.2 LD催化活性濃度測定條件,見表B.2。
表 B.2 LD 催化活性濃度測量條件
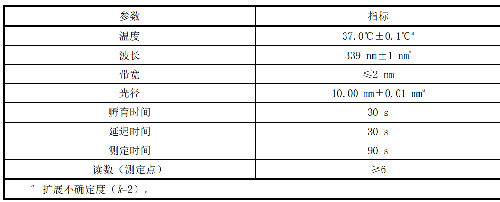
8.3 B.3 測定步驟
8.3.1 B.3.1 試劑準備
將一份適當體積(約0.400 mL)的起始試劑在37℃下平衡,爲測量做準備。剩餘的起始試劑保存在2℃~8℃。
8.3.2 B.3.2 測量程序
在比色杯中加入2.000 mL反應液,平衡到37℃。加入0.200 mL按照B.1.2.3製備的LD溶液充分混勻,孵育30 s。孵育結束時,比色杯中溶液溫度應達到37℃。再加入0.200 mL起始試劑溶液,充分混勻,等待30 s後,再連續監測90 s的吸光度。
8.3.3 B.3.3 試劑空白
用9 g·L-1(154mmol·L-1)NaCl溶液代替LD溶液測定試劑空白,按上述方法進行操作。
8.4 B.4 計算
計算方法與AST催化濃度的計算方法相同,此結果是稀釋後的最後溶液中的催化LD濃度。
按式(B.1)計算儲存酶溶液中LD催化活性濃度:
LDstock=F×Fdilution×∆A/∆tLD···. ························(B.1)
式中:
LDstock——LD催化活性濃度,單位U·L-1除以1000可得kU·L-1;
F ——係數,等於 1905[在 339 nm 波長測定時,ε339(NADH)=630 ㎡·mol-1];
Fdilution——LD儲存液的稀釋因子,本例中爲40401;
9 附錄C(資料性附錄)測量酶儲存溶液中MD催化活性濃度
9.1 C.1 測量試劑
9.1.1 C.1.1 輔助試劑
9.1.2 C.1.2 試劑製備
9.1.2.1 C.1.2.1 測定MD催化活性濃度的反應溶液:
——10.000 mL 溶液 1;
——0.200 mL 溶液 3;
——0.200 mL 溶液 4;
——0.100 mL 水;
——充分混勻,避光保存。
9.1.2.2 C.1.2.2 測定MD催化活性濃度的起始試劑溶液:
——0.0317 g(4.8 mmol·L-1)草酰乙酸;
——溶於約 40 mL 水中;
——轉移至 50 mL 容量瓶中;
——將容量瓶和水平衡至 20℃;
——加水至容量瓶的校準刻度線(20℃);
——將溶液在冰上冷卻。
最終配製的溶液中草酰乙酸濃度爲 4.8 mmol.L-1。此溶液置 2℃~8℃穩定性爲 30 min。
9.1.2.3 C.1.2.3 MD儲存溶液的稀釋 (用前臨時製備):
——取0.050 mL MD貯存溶液至10.000 mL酶試劑稀釋液中,並充分混勻;第一步的稀釋比例是1∶201;
——取經以上稀釋的0.050 mL溶液加至10.000 mL酶試劑稀釋液中,並充分混勻;第二步的稀釋比例是1∶201;第一步和第二步總稀釋比例是1∶40401。
注:所用MD酶儲存溶液的催化濃度不同於上述步驟時,稀釋度不同,需要對稀釋因子(F稀釋)進行各自調整。
9.2 C.2 測量條件
9.2.1 C.2.1 最終完全反應混合物的濃度,見表C.1。

9.2.2 C.2.2 MD催化活性濃度測量條件,見表C.2。
表 C.2 MD 催化活性濃度測量條件
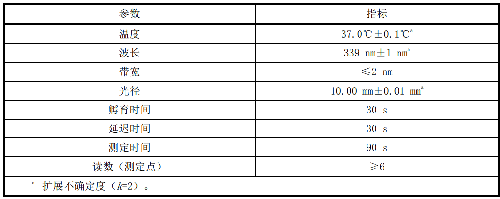
9.3 C.3 測量步驟
9.3.1 C.3.1 試劑準備
將一份適當體積(約0.400 mL)的起始試劑在37℃下平衡,爲測定做準備。剩餘的起始試劑必須保存在2℃~8℃。
9.3.2 C.3.2 測量程序
在比色杯中加入2.000 mL反應液,平衡到37℃。加入0.2000 mL按照C.1.2.3製備的MD溶液充分混勻,孵育30 s。孵育結束時,比色杯中溶液溫度應達到37℃。再加入0.2000 mL起始試劑溶液,充分混勻,等待30 s後,再連續監測90 s的吸光度。
9.3.3 C.3.3 試劑空白
採用9 g·L-1(154 mmol·L-1)NaCl溶液代替被稀釋的MD原液測定試劑空白,按上述方法進行操作。
9.4 C.4 計算
計算與AST催化濃度的計算相同,此結果是稀釋後的最後溶液中的催化MD濃度。按式(C.1)計算儲存酶溶液中LD催化活性濃度:
MDstock=F×Fdilution×∆A/∆tLD···················(C. 1)
式中:
MDstock——MD催化活性濃度,單位U/L除以1000可得kU·L-1;
F ——係數,等於 1905[在 339 nm 波長測定時,ε339(NADH)=630 ㎡·mol-1];
Fdilution——MD儲存液的稀釋因子,本例中爲40401;
10 附錄D(資料性附錄)不同溫度下溶液的pH值
D.1 不同溫度下溶液 1 的 pH 值,見表 D.1。
表 D.1 不同溫度下溶液 1 的 pH 值
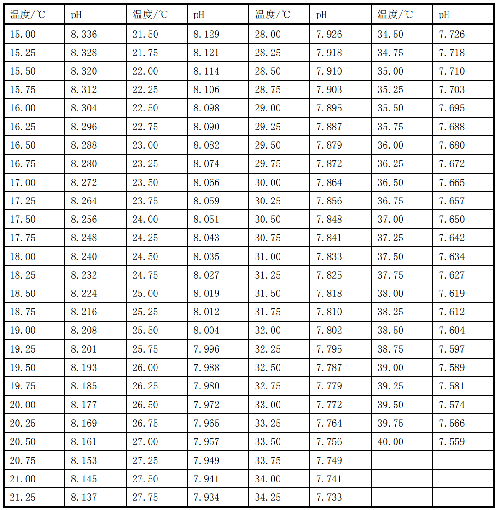
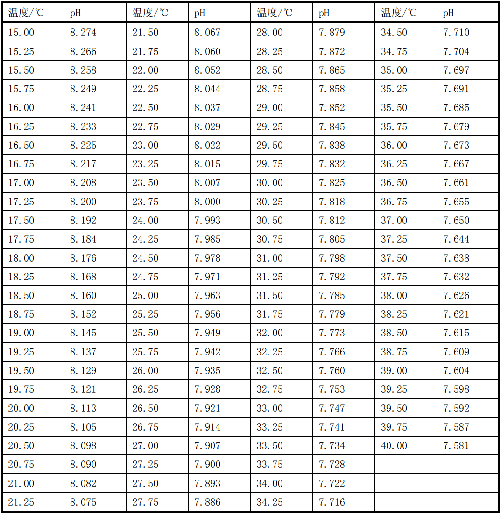
10.1 D.2 不同溫度下溶液 2 的 pH,見表 D.2。
表 D.2 不同溫度下溶液 2 的 pH 值
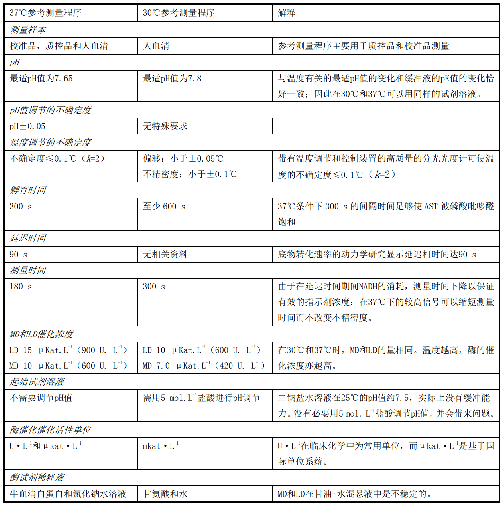
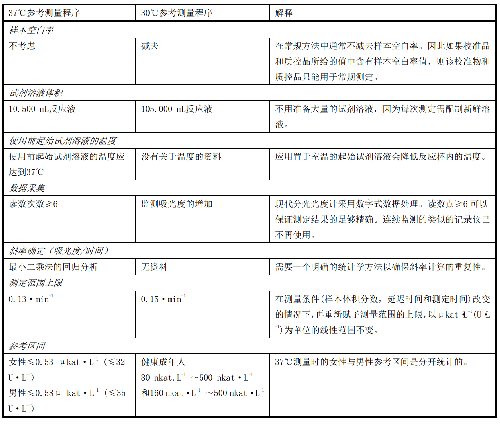
11 附錄E(資料性附錄)AST IFCC 37℃參考測量程序與 30℃參考測量程序的比較
E.1 目前的SOP源自IFCC參考測量程序,該參考測量程序爲AST的催化活性濃度的測量提供了最佳條件。由37℃取代30℃作爲測量溫度,只需對某些測量參數進行微小改變即可保留最適的測量條件。
E.2 附錄中列出了由37℃取代30℃作爲測量溫度時應對測量中的相關項做必要修改並必要時對其相關項進行解釋,見表E.1。
表E.1 測量溫度分別爲37℃和30℃時的參考測量程序的比較
12 參考文獻
[1]ISO 15193 : 2009 In vitro diagnostic medical devices – Measurement of quantities in samples of biological origin –Presentation of reference measurement procedures
[2]JCTLM;IFCC reference measurement procedure(37℃)for AST.2002
[3] BIPM/IEC/IFCC/ISO/IUPAC/IUPAP/OIML;Guide to the expression of uncertainty in measurement. GUM 2008.
[4] EURACHE/CITAC;Quantifing Uncertainty in Analytical Measurement. QUAM 2012