3 基本信息
ICS 11.020
C 59
中華人民共和國衛生行業標準WS 269—2019《布魯氏菌病診斷》(Diagnosis for brucellosis)由中華人民共和國國家衛生健康委員會於2019年01月02日發佈,自2019年07月01日《關於發佈〈淋病診斷〉等4項強制性衛生行業標準的通告》(國衛通〔2019〕1號)起實施。本標準代替 WS 269—2007。
4 發佈通知
國衛通〔2019〕1號
現發佈《淋病診斷》等4項強制性衛生行業標準,編號和名稱如下:
WS 268—2019 淋病診斷(代替WS 268—2007 )
WS 269—2019 布魯氏菌病診斷(代替WS 269—2007 )
WS 293—2019 艾滋病和艾滋病病毒感染診斷(代替WS 293—2008 )
WS 295—2019 流行性腦脊髓膜炎診斷(代替WS 295—2008)
上述標準自2019年7月1日起施行,WS 268—2007、WS 269—2007、WS 293—2008、WS 295—2008 同時廢止。
特此通告。
國家衛生健康委員會
2019年1月2日
5 前言
本標準第6章爲強制性條款,其餘爲推薦性條款。
本標準按照 GB/T 1.1—2009 給出的規則起草。
本標準代替 WS 269—2007《布魯氏菌病診斷標準》。
本標準與 WS 269—2007 相比,主要技術變化如下:
——增加了規範性引用文件(見第2章);
——增加了縮略語(見第3章);
——增加了膠體金免疫層析試驗(見4.3.1.2、附錄C.2);
——增加了酶聯免疫吸附試驗(見4.3.1.3、附錄C.3);
——增加了布魯氏菌培養物塗片革蘭染色檢出疑似布魯氏菌(見4.3.1.4);
——修訂了診斷原則,增加了臨牀診斷(見第5章和6.2);
——增加了布魯氏菌的培養,血培養儀培養布魯氏菌的方法(見D.1和D.1.1);
——修訂了布魯氏菌的培養中雙相血培養瓶培養布魯氏菌方法(見D.1.2);
——修訂了布魯氏菌的培養中病理材料培養布魯氏菌培養方法(見D.1.3);
——增加了布魯氏菌的核酸檢測及BCSP31聚合酶鏈式反應(見D.2.5和D.2.5.1);
——增加了AMOS聚合酶鏈式反應(見D.2.5.2);
——增加了布魯氏菌基因組DNA提取操作方法(見D.2.6);
——增加了布魯氏菌實驗生物安全要求(見 D.3);
——刪除了平板凝集試驗(PAT)(見2007年版的C.1.1);
——刪除了皮膚過敏試驗(見2007年版的C.2);
——刪除了布魯氏菌培養的接種未受精雞卵法(見2007年版的C.3.1.2);
——刪除了布魯氏菌培養的尿液培養法(見2007年版的C.3.2);
——刪除了血培養的生物學分離布氏菌法(見2007年版的C.3.4)。
本標準起草單位:中國疾病預防控制中心傳染病預防控制所、北京地壇醫院、中國疾病預防控制中心鼠疫布氏菌病預防控制基地、山西省疾病預防控制中心、遼寧省疾病預防控制中心、湖北省疾病預防控制中心、內蒙古自治區綜合疾病預防控制中心、杭州市疾病預防控制中心、青海省地方病預防控制所。
本標準主要起草人:崔步雲、李興旺、王大力、姜海、張秋香、毛玲玲、程均福、米景川、徐衛民、徐立青、田國忠、劉熹。
本標準所代替標準的歷次版本發佈情況爲:
——WS 269—2007。
6 標準正文
布魯氏菌病診斷
6.1 1 範圍
本標準規定了人間布魯氏菌病的診斷依據、診斷原則、診斷和鑑別診斷。
本標準適用於全國各級各類醫療衛生機構及其醫務人員對布魯氏菌病的診斷。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
可感染人類的高致病性病原微生物菌(毒)種或樣本運輸管理規定 衛生部令第45號 2005年
人間傳染的病原微生物名錄 衛生部(衛科教發〔2006〕15號)
危險品航空安全運輸技術細則 國際民航組織(Doc 9284號文件)
6.3 3 縮略語
下列縮略語適用於本文件。
CFT:補體結合試驗(complement fixation test)
DNA:脫氧核糖核酸(deoxyribonucleic acid)
dNTPs:脫氧核苷三磷酸(deoxy-ribonucleoside triphosphate)
ELISA:酶聯免疫吸附試驗(enzyme linked immunosorbent assay)
GICA:膠體金免疫層析試驗(gold immunochromatography assay)
PBS:磷酸鹽緩衝液(phosphate buffer saline)
PCR:聚合酶鏈式反應(polymerase chain reaction)
RBT:虎紅平板凝集試驗(rose bengal plate agglutination test)
RTD:常規試驗稀釋度(routine test dilution)
SAT:試管凝集試驗(serum agglutination test)
6.4 4 診斷依據
6.4.1 4.1 流行病學史
發病前病人與疑似布魯氏菌感染的家畜、畜產品有密切接觸史,或生食過牛、羊乳及肉製品,或生活在布魯氏菌病疫區;或從事布魯氏菌培養、檢測或布魯氏菌疫苗生產、使用等工作。其他流行病學參見附錄 A。
6.4.2 4.2 臨牀表現
4.2.1 出現持續數日乃至數週發熱(包括低熱),多汗,乏力,肌肉和關節疼痛等。
4.2.2 部分患者淋巴結、肝、脾和睾丸腫大,少數患者可出現各種各樣的皮疹和黃疸;急慢性期患者可以表現爲骨關節系統損害。具體臨牀表現參見附錄 B。
6.4.3 4.3 實驗室檢查(實驗方法見附錄 C、附錄 D)
6.4.3.1 4.3.1 實驗室初篩
4.3.1.4 布魯氏菌培養物塗片革蘭染色檢出疑似布魯氏菌。
6.4.3.2 4.3.2 實驗室確診
4.3.2.1 從病人血液、骨髓、其他體液及排泄物等任一種病理材料培養物中分離到布魯氏菌。
4.3.2.2 試管凝集試驗(SAT)滴度爲 1:100++及以上,或者患者病程持續一年以上且仍有臨牀症狀者滴度爲 1:50++及以上。
4.3.2.3 補體結合試驗(CFT)滴度爲 1:10++及以上。
4.3.2.4 抗人免疫球蛋白試驗(Coomb’s)滴度爲 1:400++及以上。
6.5 5 診斷原則
布魯氏菌病的發生、發展和轉歸比較複雜,其臨牀表現多種多樣,很難以某一種症狀來確定診斷。對布魯氏菌病的診斷,應結合病人流行病學接觸史、臨牀表現和實驗室檢查等情況綜合判斷。
6.6 6 診斷
6.6.1 6.1 疑似病例
符合4.1,並同時符合4.2。
6.6.2 6.2 臨牀診斷病例
符合疑似病例並同時符合4.3.1中任一項。
6.6.3 6.3 確診病例
符合疑似或臨牀診斷病例並同時符合4.3.2中任一項。
6.6.4 6.4 隱性感染
符合4.1,並同時符合4.3.2中任一項,且不符合4.2。
6.7 7 鑑別診斷
7 附錄A(資料性附錄)布魯氏菌病流行病學
7.1 A.1 布魯氏菌病
布魯氏菌病是由布魯氏菌屬的細菌侵入機體,引起的人獸共患的傳染-變態反應性疾病。
7.2 A.2 貯存宿主及傳染源
布魯氏菌的貯存宿主很多,已知有60多種動物(家畜、家禽、野生動物、馴化動物)可以作爲布魯氏菌貯存宿主。布魯氏菌病往往先在家畜或野生動物中傳播,隨後波及人類,是人畜共患的傳染病。疫畜是布魯氏菌病的主要傳染源,我國大部分地區以羊作爲主要傳染源,有些地方牛是傳染源,南方個別省份的豬可作爲傳染源。鹿和犬等經濟動物也可成爲傳染源。
7.3 A.3 傳播途徑及傳播因子
病原體可以通過體表皮膚黏膜、消化道、呼吸道侵入機體。人的感染途徑與職業、飲食、生活習慣有關。
含有布魯氏菌的各種污染物及食物均可成爲傳播媒介,主要有病畜流產物、病畜的乳、肉、內臟,被布魯氏菌污染的皮毛、水、土壤、塵埃等。
7.4 A.4 易感人羣
人類對布魯氏菌普遍易感。人羣布魯氏菌病感染率與傳染源和傳播媒介密切接觸的機會、程度有關。布魯氏菌病患者可以重複感染布魯氏菌。
7.5 A.5 分佈
7.5.1 A.5.1 職業
有明顯的職業性,凡與病畜、染菌畜產品接觸多者發病率高。農民、牧民、獸醫、皮毛和乳、肉加工人員及相關實驗人員感染率比一般人高。
7.5.2 A.5.2 性別
人對布魯氏菌易感,無性別差異,主要取決於接觸機會多少。
7.5.3 A.5.3 年齡
各年齡組均可感染發病。由於青壯年是主要勞動力,接觸病畜頻繁,因而感染率比其他年齡組高。
7.5.4 A.5.4 季節
一年四季各月均可發病。羊種布魯氏菌流行區有明顯的季節性高峯。我國北方農牧區人羣發病高峯在4月~5月,夏季剪羊毛和乳肉食品增多,也可出現一個小的發病高峯。牛種、豬種布魯氏菌的布魯氏菌病季節性不明顯。
7.5.5 A.5.5 地區
布魯氏菌病感染率在農牧區高於城鎮,農牧區人與家畜接觸頻繁,感染機會多,城市病人則多集中在一些皮毛乳肉加工企業。
7.6 A.6 不同疫區的流行特點
7.6.1 A.6.1 羊種布魯氏菌疫區
羊種布魯氏菌疫區的主要傳染源是病羊。羊種布魯氏菌1、2、3生物型對人、畜均有較強的侵襲力和致病力,易引起人、畜間布魯氏菌病暴發流行,疫情重。大多出現典型的臨牀症狀和體徵。
7.6.2 A.6.2 牛種布魯氏菌疫區
牛種布魯氏菌疫區的主要傳染源是病牛。牛種布魯氏菌生物型較多,毒力不一。就總體而言,牛種布魯氏菌毒力較弱,但有較強的侵襲力,即使是弱毒株,也可使牛發生暴發性流產或不孕,嚴重影響畜牧業發展。但對人致病較輕,感染率高而發病率低,呈散發性。臨牀症狀和體徵多不典型,病程短,後遺症較少。
7.6.3 A.6.3 豬種布魯氏菌疫區
豬種布魯氏菌疫區主要傳染源是病豬。通常由豬種1型和豬種3型布魯氏菌致病,毒力介於羊種布魯氏菌和牛種布魯氏菌之間。同一生物型菌株,既有強毒株,也有弱毒株。豬種布魯氏菌對豬致病力強,對羊、牛致病力較弱。對人致病力比牛種布魯氏菌強,除少數病例病情較重外,大多數無急性期臨牀表現。
7.6.4 A.6.4 犬種布魯氏菌疫區
犬種布魯氏菌疫區主要傳染源是病犬。犬種布魯氏菌除了侵襲犬,引起犬流產外,也可使貓、牛、豬、兔、梅花鹿、鼠等動物感染,產生抗犬種布魯氏菌抗體。人也可被感染,鮮有發病。
7.6.5 A.6.5 混合型布魯氏菌疫區
2種或2種以上布魯氏菌同時在一個疫區存在,這與羊、牛同在一個牧場放牧或圈舍鄰近有關。由於彼此接觸密切,不同菌種可以發生轉移,從羊種布魯氏菌轉移到牛多見,也有羊種布魯氏菌轉移到豬;豬種、牛種布魯氏菌也可轉移到羊。混合型疫區流行特點取決於當地存在的主要菌種。
8 附錄B(資料性附錄)布魯氏菌病臨牀表現
8.1 B.1 主要症狀
8.1.1 B.1.1 發熱
是布魯氏菌病常見的臨牀表現,典型病例表現爲波狀熱,常伴有寒戰等症狀,可見於各期患者。部分病例可表現爲低熱和不規則熱型,且多發生在午後或夜間。
布魯氏菌病患者在高熱時神志清醒,痛苦較小,但體溫下降時自覺症狀加重,這種高熱與病況相矛盾的現象爲布魯氏菌病所特有。
8.1.2 B.1.2 多汗
是布魯氏菌病常見的臨牀表現,急性期病例出汗尤重,體溫下降時加重,可溼透衣褲、被褥,使患者感到緊張和煩躁。
8.1.3 B.1.3 肌肉和關節疼痛
是布魯氏菌病常見的臨牀表現,爲全身肌肉和多發性、遊走性大關節疼痛。一些病例還可有脊柱(腰椎爲主)骨關節受累,表現爲疼痛、畸形和功能障礙等。
8.1.4 B.1.4 乏力
幾乎全部病例都有乏力疲勞的表現。
8.1.5 B.1.5 其他
8.2 B.2 主要體徵
8.2.1 B.2.1 肝、脾及淋巴結腫大
多見於急性期病例,肝、脾腫大的患者恢復較慢。
8.2.2 B.2.2 其他
男性病例可伴有睾丸炎,女性病例可見卵巢炎。急性期患者可以出現各種各樣的皮疹,一些患者可以出現黃疸,慢性期患者表現爲骨關節系統的損害。
8.3 B.3 臨牀分期
8.3.1 B.3.1 急性期
具有上述臨牀表現,病程在3個月以內,出現確診的血清學陽性反應。
8.3.2 B.3.2 亞急性期
具有上述臨牀表現,病程在3個月~6個月之間,出現確診的血清學陽性反應。
8.3.3 B.3.3 慢性期
病程超過6個月仍未痊癒,有布魯氏菌病的症狀和體徵,並出現確診的血清學陽性反應。
8.4 B.4 潛伏期
9 附錄C(規範性附錄)
9.1 C.1 虎紅平板凝集試驗(RBT)
9.1.1 C.1.1 器材與試劑
C.1.1.1 器材:清潔玻片、微量加樣器、木籤、計時器。
C.1.1.2 試劑:虎紅平板凝集抗原、已知的陰性和陽性血清、待檢血清。
9.1.2 C.1.2 操作方法
在玻片上加30 μL待檢血清,然後加入虎紅平板凝集抗原30 μL,搖勻或用木籤充分混勻,在5 min內觀察結果。每批次實驗同時用陰性、陽性血清各一份作對照。
9.1.3 C.1.3 結果判定
出現肉眼可見的凝集反應判爲陽性;液體均勻混濁、未見到凝集反應判爲陰性。
9.2 C.2 膠體金免疫層析試驗(GICA)
9.2.1 C.2.1 器材及試劑
C.2.1.1 器材:測試卡包被可溶性布魯氏菌菌體抗原、人IgG的硝酸纖維素膜和膠體金標記結合物。0.1mL吸管或微量加樣器。
9.2.2 C.2.2 操作方法
在測試卡加樣孔內加入10 μL待檢血清,待滲入。
在加樣孔內加入生理鹽水100 μL,待滲入。3 min~20 min 內觀察結果。
9.2.3 C.2.3 結果判定
測試卡質控區(C)顯示紅色線條,爲此試驗結果可信;未顯示紅色線條,此次試驗失敗。
測試區(T)顯示紅色線條,試驗結果爲陽性,只有質控區出現一條紅色線條爲陰性。
注:膠體金免疫層析試驗可能有不同測試卡,實驗方法可能有差別,具體實驗參照介紹檢測和作出實驗診斷。
9.3 C.3 酶聯免疫吸附試驗(ELISA)
9.3.1 C.3.1 試劑盒及器材
9.3.1.1 C.3.1.1 試劑盒組成
試劑盒組成詳見表C.1。
表C.1 ELISA 試劑盒組成
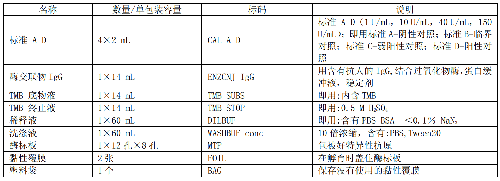
9.3.1.2 C.3.1.2 器材
酶標儀(吸收波長450 nm,參考波長600 nm~650 nm)、洗板機、移液器、8道移液器、1 mL移液管、計時器、吸水紙巾、吸頭、稀釋板、加樣槽、記號筆、雙蒸餾水或去離子水。
9.3.1.3 C.3.1.3 檢測前準備
按照介紹配製洗滌液、稀釋液。
按照介紹稀釋待檢血清。
9.3.2 C.3.2 操作方法
步驟如下:
a) 吸取 100 μL 的各陰陽性對照液和稀釋的樣品,分別加入到相應酶標板孔中。
b) 用黏性覆膜蓋住酶標板,在 18 ℃~25 ℃孵育 60 min。
c) 移去覆膜,棄去酶標板液體。每孔加入稀釋好的稀釋液 300 μL,洗板 3 次,將板倒置在紙巾上除去剩餘液體。
d) 使用移液器加入 100 μL 酶交聯物;取新的覆膜蓋住酶標板,在 18 ℃~25 ℃孵育 30 min;
e) 重複 C.3.2.c)。
f) 使用移液器加底物液和終止液,加底物液和終止液的間隔時間應一樣,加樣時應避免產生氣泡。
g) 每孔加 100 μL 的 TMB 底物液,取新的黏性覆膜蓋住酶標板,在 18 ℃~25 ℃孵育 20 min 後,每孔加入 100 μL TMB 終止液終止酶促反應,輕蕩酶標板使其混勻,顏色由藍變黃爲止。
h) 在加入終止液的 60 min 內,在 450 nm 處檢測吸光度。
9.3.3 C.3.3 質量控制
C.3.3.1 陰性、陽性標準品的OD值在質控要求的範圍內。
C.3.3.2 試驗用儀器、加樣器必需經過嚴格的校驗或標定。
C.3.3.3 試劑應在規定的儲存條件下存儲,在有效期內使用。
9.3.4 C.3.4 結果判定
參照介紹使用酶標儀讀取樣品的OD值。以標準的OD值爲y軸,標準品的濃度爲x軸,在對數座標紙上做一條標準曲線。然後在曲線上讀取相應樣品的濃度值。結果判定情況如下:
a) >12 U/mL 爲實驗陽性;
b) 8 U/mL~12 U/mL 爲實驗可疑;
c) <8 U/mL 爲實驗陰性。
酶聯免疫吸附試驗可以檢測IgM(IgM-ELISA)、IgG(IgG-ELISA)等免疫球蛋白,實驗原理、方法可能有差別,具體實驗參照試劑盒介紹檢測和作出實驗診斷。
9.4 C.4 試管凝集試驗(SAT)
9.4.1 C.4.1 器材及試劑
試管凝集抗原、已知的陰性和陽性血清、待檢血清、生理鹽水、1 mL吸管、血清凝集試管、試管架、37℃溫箱等。
9.4.2 C.4.2 操作方法
步驟如下:
a) 待檢血清的稀釋。在一般情況下,每份血清用 5 支試管,第一管加入 2.3 mL 生理鹽水,第二管不加,第三、四、五管各加 0.5 mL。用吸管吸取待檢血清 0.2 mL 加入第一隻試管中,混勻。混勻後,以吸管吸取第一管中血清加入第二和第三管各 0.5 mL,以吸管將第三管混勻,並吸0.5 mL 加入第四管,混勻。從第四管吸取 0.5 mL 加入第五管,混勻。再從第五管吸取 0.5 mL棄去。如此稀釋後,從第二管到第五管血清稀釋度分別爲 1:12.5、1:25、1:50 和 1:100。
b) 加入抗原。先以生理鹽水將抗原原液作適當稀釋成抗原應用液(按照介紹操作,一般作 1:10稀釋),稀釋後的抗原應用液加入各稀釋的血清管(第一管不加,作爲血清對照),每管加0.5 mL,混勻。加入抗原應用液後第二管至第五管,每管總量 1 mL,血清稀釋度從第二管到第五管分別爲 1:25、1:50、1:100 和 1:200。從第一管再吸出 0.5 mL 棄去,剩 1 mL。
c) 對照。陰性血清對照,血清稀釋後加抗原應用液(與待檢血清對照相似);陽性血清對照,其血清稀釋到原有滴度,再加抗原應用液;抗原對照,適當稀釋的抗原加生理鹽水。
9.4.3 C.4.3 結果判定
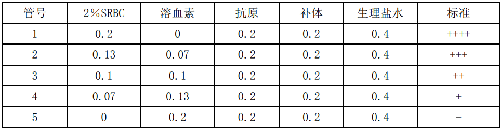
C.4.3.1 製備參照比濁管:每次試驗須配置參照比濁管作爲判定的依據。配置方法是:取試驗用抗原液,加入生理鹽水稀釋成抗原應用液,按表C.2配置比濁管。
表C.2 試管凝集試驗判定比濁管配製
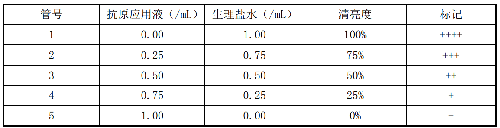
C.4.3.2 判定結果:全部試驗管,對照管及參照比濁管充分振盪後置37 ℃溫箱中反應20 h~22 h,取出後放室溫2 h,然後參照比濁管爲標準判定結果。
C.4.3.3 記錄結果:根據各管中上層液體的清亮度記錄結果。特別是50%清亮度(++)對判定結果關係較大,一定要與比濁管對比判定。
++++:完全凝集,上層液100%清亮。
+++:幾乎完全凝集,上層液75%清亮。
++:顯著凝集,液體50%清亮。
+:有微量凝集,液體25%清亮。
-:無凝集,液體不清亮。
確定每份血清滴度是以出現“++”及以上的凝集現象的最高血清稀釋度。
注:爲了獲得待檢標本的最終陽性滴度效價,可以參考其他試驗結果,增加更多的稀釋度。
9.5 C.5 補體結合試驗(CFT)
9.5.1 C.5.1 試劑及器材
C.5.1.1 試劑:生理鹽水、補體(豚鼠血清或凍幹補體)、2%綿羊紅細胞懸液、溶血素、布魯氏菌補體結合抗原、陰性和陽性血清、被檢血清。
C.5.1.2 器材:37 ℃水浴箱、普通離心機、普通冰箱、0.1 mL、1 mL和10 mL吸管、血清凝集管和試管架。
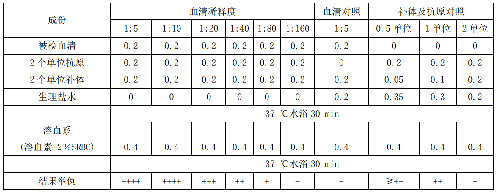
9.5.2 C.5.2 五種成分的處理和滴定
9.5.2.1 C.5.2.1 補體
真空乾燥補體可保持較長時間活性。亦可以選取數只健康豚鼠,取血分離血清,混合血清後即爲所需補體。在CFT試驗前需要進行補體滴定,確定試驗用的補體稀釋度。滴定步驟參照表C.3,如下操作:
a) 將補體稀釋爲1:20,在10支凝集管中分別依次加入不同量的1:20補體稀釋液0.02 mL~0.2mL;
b) 各管加 2 個單位的抗原液 0.2 mL;
c) 用生理鹽水把各管補至 0.6 mL;
d) 混勻後放 37 ℃水浴 30 min;
e) 加 0.2 mL 溶血素(2 個單位);
f) 加 2%的綿羊紅細胞 0.2 mL;
g) 混勻後放 37 ℃水浴 30 min,判定結果。


結果中產生完全溶血且含補體量最少管爲第 8 管,定爲 1 個恰定單位,它前 1 管即第 7 管爲 1 個完全單位,在正式試驗時採用 2 個完全單位的補體量,按下列公式計算出補體的稀釋倍數 x。
20:2y(y=1 個完全單位的補體量)=x:0.2 x=20×0.2/2y=2/y。
因爲 y=0.08 所以即補體作 1:25 稀釋。
9.5.2.2 C.5.2.2 溶血素
a) 首先製備依次遞增的溶血素稀釋度:
1:10 即 0.1 mL 溶血素+0.9 mL 生理鹽水;
1:100 即 0.1 mL(1:10)+0.9 mL 生理鹽水;
1:1 000 即 0.5 mL(1:100) +4.5 mL 生理鹽水;
1:2 000 即 0.5 mL(1:1 000)+0.5 mL 生理鹽水 ;
1:3 000 即 0.5 mL(1:1 000)+1.0 mL 生理鹽水;
1:4 000 即 0.5 mL(1:1 000)+1.5 mL 生理鹽水;
1:5 000 即 0.5 mL(1:1 000)+2.0 mL 生理鹽水;
1:6 000 即 0.5 mL(1:3 000)+0.5 mL 生理鹽水;
1:8 000 即 0.5 mL(1:4 000)+0.5 mL 生理鹽水;
1:10 000 即 0.5 mL(1:5 000)+0.5 mL 生理鹽水;
1:12 000 即 0.5 mL(1:6 000)+0.5 mL 生理鹽水;
1:16 000 即 0.5 mL(1:8 000)+0.5 mL 生理鹽水。
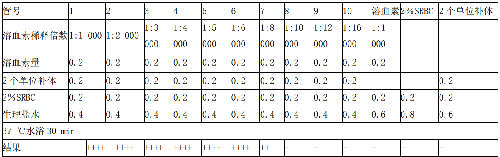
b) 稀釋完畢後,取 10 支凝集管,參照表 C.4 順序加入以下各稀釋度溶血素 0.2 mL,2 個單位補體 0.2 mL,2%綿羊紅細胞懸液 0.2 mL,並用生理鹽水補充至總量爲 1 mL。
d) 溶血素對照。1:1 000 溶血素 0.2 mL+2%綿羊紅細胞 0.2 mL+生理鹽水 0.6 mL。
e) 血球對照。2%綿羊紅細胞 0.2 mL+生理鹽水 0.8 mL。
f) 補體對照。2 個單位補體 0.2 mL+2%綿羊紅細胞 0.2 mL+鹽水 0.6 mL。
g) 放 37 ℃水浴 30 min,取出參照表 C.4 判定結果。以完全溶血的溶血素最高稀釋度爲 1 個溶血素單位,試驗時用 2 個單位。
9.5.2.3 C.5.2.3 綿羊紅細胞
一般用成年的健康公綿羊紅細胞,因母羊紅細胞抵抗力不穩定。將採集的血清按1:1放於阿氏液中保存於普通冰箱中,用時以生理鹽水離心洗滌3次,再將末壓實紅細胞配製成2%的紅細胞懸液。
9.5.2.4 C.5.2.4 布魯氏菌抗原
布魯氏菌補體結合抗原採用可溶性抗原。採用用棋盤式滴定法滴定抗原,步驟如下:
a) 將抗布魯氏菌陽性或標準血清滅活,並用生理鹽水稀釋成 1:5、1:10、„„、1:1 280;
b) 在每一行各管加同一稀釋度血清 0.2 mL,每一列各管加同一稀釋度抗原 0.2 mL;
c) 所有各管加 0.2 mL 2 個單位的補體;
d) 混勻後放 37 ℃水浴 30 min;
e) 取出後向各管加 0.4 mL 的溶血系(2 個單位的溶血素與 2%綿羊紅細胞懸液等量混勻);
f) 血清對照(不加抗原); 抗原對照(不加血清); 補體對照(不加抗原或不加血清); 溶血素對照(不加抗原和血清);
g) 放 37 ℃水浴 30 min,參照表 C.5 判定結果。
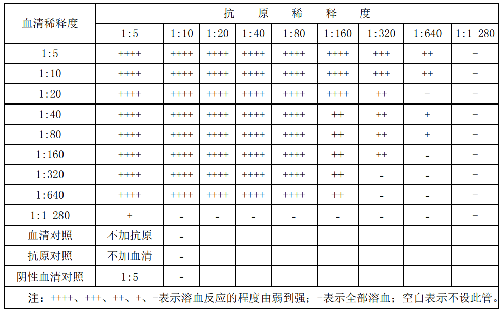
當所有對照管均發生溶血,滴定結果才能成立。在陽性血清最高稀釋度中能產生完全不溶血的最高抗原稀釋度爲 1 個抗原單位,試驗時採用 2 個抗原單位。在本例中,1 個抗原單位爲 1:80,2 個抗原單位爲 1:40。
9.5.2.5 C.5.2.5 待檢血清
在試驗中待查的人或動物血清,應予以滅活。不同動物血清滅活溫度如下:
a) 人、牛、駱駝和豬血清在 56℃~58℃ 30 min 滅活;
9.5.3 C.5.3 補體結合試驗
9.5.3.1 C.5.3.1 操作方法
步驟如下:
a) 取 6 支凝集管放於試管架上,將滅活的待檢血清從 1:5 開始作對倍稀釋直至 1:160 倍。
b) 另取 10 支凝集管放於試管架上,其中 6 支作爲反應管,4 支作爲對照管。取已稀釋好的各稀釋倍數血清 0.2 mL 分加於反應管中。
c) 每個反應管加 2 個單位抗原 0.2 mL,2 個單位補體 0.2 mL。
d) 血清對照管加 1:5 血清 0.2 mL+2 個單位補體 0.2 mL+生理鹽水 0.2 mL。
——2 個單位抗原 0.2 mL+2 個單位補體 0.05 mL+生理鹽水 0.35 mL;
——2 個單位抗原 0.2 mL+2 個單位補體 0.1 mL+生理鹽水 0.3 mL;
——2 個單位抗原 0.2 mL+2 個單位補體 0.2 mL+生理鹽水 0.2 mL。
f) 混勻,置 37 ℃水浴 30 min。
g) 取出各管加入 0.4 mL 溶血系,再放 37 ℃水浴 30 min,判定結果。
h) 判定結果如下:
+++ 25%溶血,有紅細胞沉於管底或爲懸液,上清有溶血顏色;
++ 50%溶血,少有紅細胞沉於管底或爲懸液,上清呈明顯溶血顏色;
+ 75%溶血,基本沒有紅細胞沉於管底或爲懸液,上清呈明顯溶血顏色,尚不透明;
i) 補體結合試驗參照表 C.6 程序操作,對照反應合於要求,被檢血清在 1:40 滴度處出現 50%溶
血,其滴度爲 1:40。爲防止判定的錯誤,可配製表 C.7 溶血標準管。
j)
9.5.3.2 C.5.3.2 診斷標準
C.5.3.2.1 人及所有動物血清溫熱補體結合試驗以1:10出現抑制溶血爲++++、+++、++者爲陽性;
C.5.3.2.2 影響因素
a) 進行同一試驗時應採用同一種抗原。抗原存放時間長或受污染等易出現抗補體現象。
b) 被檢血清應進行滅活,如果滅活不徹底也會影響結果。在試驗時儘量用新鮮血清,血清的污染及變性都可能出現抗補體現象。。
c) 補體與溶血素之間有定量關係。當溶血素的含量一定時,增加補體量,溶血增強,但到一定程度不變;補體量一定時,增加溶血素,溶血增強,到一定程度不變。因此在進行補體結合試驗時應確定補體當量,或進行補體滴定。
d) 鹽類影響血清反應是人們都知道的。如果在補體結合反應中 NaCl、巴比妥緩衝液的克分子濃度增加,補體活性下降。Mg2+缺乏易出現抗補體現象。
9.5.3.3 C.5.3.3 評價
補體結合試驗是人獸醫廣泛應用的診斷布病的手段,儘管操作繁瑣,影響因素多,其試驗價值及主要優缺點是:
a) 特異性較強。試驗結果不僅與布魯氏菌病臨牀表現及病期有較好的一致性,而且與牲畜的排菌、帶菌均有較高的一致性。
b) 試驗所查的布魯氏菌病抗體類別主要是 IgG 類,結合試管凝集實驗結果可以用於判斷 IgM、IgG的消長,用作布魯氏菌病鑑別自然感染和人工免疫的參考試驗之一。
c)
d) 試驗也可用於查布魯氏菌抗原。
e) 試驗雖然特異性較好,但敏感性較差,不適於大面積檢疫採用。
9.6 C.6 抗人免疫球蛋白試驗 (Coomb`s)
9.6.1 C.6.1 器材及試劑
除試管凝集試驗所需的一般器材及試劑外,還需抗人免疫球蛋白血清及普通離心機。
9.6.2 C.6.2 操作方法
抗人球蛋白反應階段:選取試管凝集試驗的可疑反應管及全部陰性反應管,記錄管號,經4 000 r/min離心15 min,用生理鹽水反覆洗滌、離心3次,然後向各管中加入生理鹽水0.5 mL、一定稀釋度(一般是1:20倍稀釋)的抗人免疫球蛋白血清0.5 mL,混勻,將反應管置37 ℃培養箱孵育20 h~22 h,取出放室溫2 h後判定結果。
9.6.3 C.6.3 判定標準
10 附錄D(規範性附錄)布魯氏菌的培養及鑑定
10.1 D.1 布魯氏菌的培養
10.1.1 D.1.1 血培養儀培養布魯氏菌
10.1.1.1 D.1.1.1 材料與儀器
用血培養儀培養布魯氏菌的培養瓶種類:標準成人需氧培養瓶(SA),成人需氧中和抗生素培養瓶(FA),成人厭氧中和抗生素培養瓶(FN),小兒需氧瓶(PF)。
10.1.1.2 D.1.1.2 操作程序
步驟如下:
a) 按照培養瓶需要量無菌採集血液或其他體液,注入培養瓶中。
b) 開機啓動系統進入初始監視屏幕,待溫度達到要求即可開始使用。
c) 培養瓶的裝載,按主屏幕上裝瓶鍵,出現裝瓶界面。可見每個抽屜底部顯示出當前有效單元數量,同時含有效單元的孵育箱指示燈會發出綠光。依次輸入培養瓶 ID、登錄號、檢驗號、醫院 ID、病人姓名等信息。
d) 打開孵育箱,空載單元會亮綠燈。將培養瓶瓶底插入亮燈單元。單元指示燈閃爍確認培養瓶已被加載。
e) 重複步驟 c)、d)加載培養瓶,關閉孵育抽屜,終止裝載過程,啓動培養系統。布魯氏菌一般培養 2 d~7 d。
10.1.1.3 D.1.1.3 陽性標本處理
血培養儀提示培養瓶有疑似菌生長,應取出培養瓶至符合相應生物安全條件的實驗室進行後續操作:
a) 取出顯示有細菌生長的培養瓶,用 75%的酒精消毒瓶口,顛倒混勻培養瓶數次。
d) 將無菌注射器針頭插入瓶口,抽取培養液 0.5 mL 接種於血平板、巧克力或布氏瓊脂平板上,37 ℃培養 24 h~48 h,取培養物進行布魯氏菌鑑定實驗。
e) 作爲快速診斷參考,抽取少量培養液塗布於玻片上作革蘭染色鏡檢,發現革蘭陰性沙粒狀微小細菌,結合相關實驗,可以報告檢出疑似布魯氏菌結果。
注:血培養儀有型號的不同,應按照操作說明進行操作。
10.1.2 D.1.2 雙相血培養瓶培養布魯氏菌
10.1.2.1 D.1.2.1 材料與儀器
D.1.2.1.1 材料:布魯氏菌的培養採用需氧雙相培養瓶。
D.1.2.1.2 儀器:細菌培養箱,設定37 ℃,培養物疑似牛種布魯氏菌等需要CO2時,純培養應採用CO2培養箱。CO2培養箱亦可以用於其他種布魯氏菌培養。
10.1.2.2 D.1.2.2 操作程序
操作程序如下:
b) 將接種的培養瓶放入培養箱,布魯氏菌一般培養 1 周~2 周,最長 4 周。
c) 陽性標本處理。取出在固相瓊脂上顯示有細菌生長的培養瓶,用 75%的酒精或酒精燈消毒瓶口,打開培養瓶蓋。接種環插入瓶口,挑取單個菌落接種於血平板、巧克力、布氏瓊脂平板上,37 ℃培養 18 h~24 h,取培養物進行布魯氏菌鑑定實驗。
10.1.3 D.1.3 病理材料培養布魯氏菌
從病人的血液、骨髓和其他病理材料直接接種或研磨後接種血平板、巧克力、布氏瓊脂平板上或中試管斜面,37 ℃培養1周~4周,取培養物進行布魯氏菌鑑定實驗。
從疑似病人無菌採血1 mL注入培養容器,使被檢血液均勻塗布在培養基上,置37 ℃培養箱中培養,3 d後觀察結果,如果沒有生長,再次使血液塗在培養基上,繼續培養,隔日觀察1次。如果有疑似布魯氏菌生長,則用接種環取出,純分離和進一步鑑定。如果培養物疑似牛種布魯氏菌等需要CO2時,應採用5%~10% CO2培養箱培養。
10.2 D.2 布魯氏菌的鑑定
10.2.1 D.2.1 布魯氏菌的血清凝集
10.2.1.1 D.2.1.1 玻片凝集試驗
在清潔玻片上各滴一滴A、M血清,在另一端再滴一滴生理鹽水,然後用接種環勾取少許待檢布魯氏菌48 h培養物,在生理鹽水中研磨製成菌懸液,用接種環勾取菌懸液分別加入A和M血清中混勻,在2 min內出現凝集顆粒爲陽性;否則爲陰性。
10.2.1.2 D.2.1.2血清凝集意義
待檢菌株可能出現與A凝集而與M不凝集,與M凝集而與A不凝集,與M和A均凝集或均不凝集四種情況,各情況意義如下:
a) 待檢菌在 A 血清中凝集,而在 M 血清中不凝集或 A 血清凝集滴度高於 M,可能是羊種 2 型布魯氏菌、牛種 1~3 型或牛種 6 型布魯氏菌、豬種 1~3 型布魯氏菌及沙林鼠種布魯氏菌。
b) 待檢菌在 M 血清中凝集,而在 A 血清中不凝集或 M 血清凝集滴度高於 A,可能是羊種 1 型或牛種 4、5、9 型布魯氏菌。
c) 待檢菌在 A 和 M 血清中均凝集或滴度相近似,可能是種羊 3 型、牛種 7 型或豬種 4 型布魯氏菌。
d) 待檢菌在 A 和 M 血清中均不凝集或滴度很低,可能是綿羊附睾種、犬種或其他粗糙型布魯氏菌及無凝集原性布魯氏菌。
e) 疑似粗糙型(R)菌,或者菌株疑似發生粗糙型變異,需要進行 R 血清凝集試驗。
10.2.2 D.2.2 布魯氏菌噬菌體裂解試驗
10.2.2.1 D.2.2.1 實驗方法
將增殖菌比濁成 10 億菌體/mL 或 OD 值爲 1.5 的菌液濃度,取 0.1 mL 此菌液加到溶化並在 52 ℃水浴保溫的布氏半固體培養基中,緩緩混勻,然後傾注到底層爲布氏瓊脂培養基上。菌液半固體凝固後,用加樣器分別吸取被測 1RTD 濃度或特定濃度噬菌體 8 μL,分別滴加在菌液半固體瓊脂表面的不同位置上,待噬菌體液幹後,置 37 ℃溫箱中培養,24 h~48 h 觀察試驗結果。
10.2.2.2 D.2.2.2 布魯氏菌噬菌體裂解試驗結果判定
在滴加噬菌體處出現透明的噬菌斑即爲裂解,否則爲不裂解。結果判定如下:
a) Bk 噬菌體在 RTD 下只裂解所有光滑型布魯氏菌,不裂解粗糙型布魯氏菌及其他種細菌。
b) Tb 噬菌體在 RTD 下只裂解光滑型牛種布魯氏菌,不裂解其他種布魯氏菌。在當濃度增大到 104×RTD 時,還會裂解光滑型豬種布魯氏菌,不裂解其他種布魯氏菌及其他種細菌。
c) Wb 噬菌體在 RTD 下只裂解光滑型牛種、豬種和沙林鼠種布魯氏菌,不裂解其他種布魯氏菌及其他種細菌。
10.2.3 D.2.3 布魯氏菌硫化氫產生量測定
10.2.3.1 D.2.3.1 實驗材料
無菌、沾有 10%醋酸鉛 8 cm×0.8 cm 普通濾紙條、pH 6.8 的瓊脂斜面試管培養基和 48 h 培養的待檢布魯氏菌菌株。
10.2.3.2 D.2.3.2 實驗方法
將待檢菌 48 h 培養物用滅菌生理鹽水製成 10 億菌體/mL 或 OD 值爲 1.5 的菌懸液,用加樣器吸取100 μL 菌液接種在 pH 6.8 的瓊脂斜面上,將醋酸鉛濾紙條夾於斜面與管壁之間,使濾紙條和斜面保持平行,以不接觸斜面爲宜。濾紙條留在管外約 1 cm,置 37 ℃溫箱培養,經 2 d、4 d、6 d 各觀察一次結果,以 cm 計算濾紙條變黑長度。每觀察一次更換一個濾紙條,3 次變黑長度總和爲最後結果,不變黑爲陰性。
10.2.3.3 D.2.3.3 實驗意義
豬種 1 型布魯氏菌產生硫化氫量最多,持續時間可達 10 d,濾紙條變黑部分可達 19 mm。
牛種布魯氏菌 1~4 型和 9 型布魯氏菌,沙林鼠種布魯氏菌均能產生中等量的硫化氫,濾紙條變黑部分 5 mm~8 mm。
牛種布魯氏菌 6 和 7 型的部分菌株也能產生少量的硫化氫。
其餘種型布魯氏菌不產生硫化氫。有時豬種3 型、羊種 1 布魯氏菌亦可產生微量硫化氫,使濾紙條下端呈現黑褐色一個小邊。該實驗需要有參考菌株進行對照。
10.2.4 D.2.4 生化鑑定儀鑑定布魯氏菌屬及布魯氏菌種
D.2.4.1 培養 18 h~24 h 分離純化布魯氏菌,配製布魯氏菌 0.85% NaCl 溶液菌懸液,並用比濁儀測定菌液濃度爲 0.5 McF~0.63 McF。
D.2.4.2 將革蘭陰性細菌鑑定卡片在室溫復溫,菌液加入鑑定卡中,按順序放在載卡架上,輸樣管插入到菌液管中。
D.2.4.3 鑑定卡片裝載入儀器孵育倉,輸入相應編號。儀器每隔一定時間自動閱讀孵育倉內所有卡片,電腦分析所有數據並給予結果,發放檢測報告。
D.2.4.4 布魯氏菌的鑑定時間一般爲 6 h~10 h。
a) 布魯氏菌屬爲 ProA、TyrA、URE、GlyA、1LATK、ELLM 陽性;
b) 牛種布魯氏菌爲 1LATK 、ProA、TyrA、URE、GlyA 陽性;
c) 羊種布魯氏菌爲 ProA、TyrA、URE、GlyA 陽性;
10.2.5 D.2.5 布魯氏菌核酸檢測
10.2.5.1 D.2.5.1 BCSP31聚合酶鏈式反應(BCSP31-PCR)
10.2.5.1.1 D.2.5.1.1 器材及試劑
器材:無菌0.2 mL PCR管、10 μL、20 μL、200 μL的移液器及移液器吸頭。
試劑:Taq DNA聚合酶、10×Buffer(不含MgCl2)、25 mM MgCl2、dNTPs、三蒸水、引物、瓊脂糖凝膠、待檢菌株核酸。
10.2.5.1.2 D.2.5.1.2 引物
Primer B4 5’-TGG CTC GGT TGC CAA TAT CAA-3’(789-809)
Primer B5 5’-CGC GCT TGC CTT TCA GGT CTG-3’(1012-992)
10.2.5.1.3 D.2.5.1.3 實驗方法
按照表D.1反應體系加入PCR管,參照表D.2設定擴增參數.
表 D.1 BCSP31-PCR 反應體系

10.2.5.1.4 D.2.5.1.4 設置參數
表D.2 BCSP31-PCR擴增參數

10.2.5.1.5 D.2.5.1.5 結果判定
PCR產物在1.5%瓊脂糖上電泳,紫外透射儀或凝膠成像系統中觀察到擴增目的片段長度爲224 bp判爲實驗陽性。
10.2.5.2 D.2.5.2 AMOS聚合酶鏈式反應(AMOS-PCR)
10.2.5.2.1 D.2.5.2.1 器材及試劑
器材:無菌0.2 mL PCR管、10 μL、20 μL、200 μL的移液器及移液器吸頭
試劑:Taq DNA聚合酶、10×Buffer(含Mg2+)、dNTPs、三蒸水、引物、瓊脂糖凝膠、待檢菌株核酸DNA。
10.2.5.2.2 D.2.5.2.2 引物
IS711: tgc cga tca ctt aag ggc ctt cat
A: gac gaa cgg aat ttt tcc aat ccc
M: aaa tcg cgt cct tgc tgg tct ga
O: cgg gtt ctg gca cea tcg tcg
S: gcg cgg ttt tct gaa ggt tca gg
10.2.5.2.3 D.2.5.2.3 實驗方法
AMOS-PCR反應體系:
25 µL體系:10×Buffer(含Mg2+)2.5μL ;dNTP(2.5 mmol/L)2μL;TaqDNA聚合酶(1 U/μL )1μL;
primerlS711(10 pmol)1μL ; primerA、M、O、S(10 pmol )各0.4μL ;待檢菌株核酸DNA lμL,補足三蒸水至15.9 μL。
10.2.5.2.4 D.2.5.2.4 擴增
擴增參數:94 ℃ 4 min;95 ℃ 1 min、60 ℃ 1 min、72 ℃ l min;30個循環;未循環72 ℃ 5 min。
10.2.5.2.5 D.2.5.2.5 結果判定
擴增PCR產物經1.5%瓊脂糖凝膠電泳檢測,以DL2000 DNA Ladder爲分子量標準,均在相應的位置出現預期大小的DNA條帶。AMOS—PCR根據條帶情況可鑑別布魯氏菌牛種1、2、4型(498 bp)、羊種布魯氏菌(731 bp)、豬種1型(285 bp)、綿羊附睾種(96l bp)。AMOS-PCR檢測4個種的一些生物型布魯氏菌是國內主要引起人感染的流行菌種(型)。
10.2.6 D.2.6 布魯氏菌基因組DNA提取操作方法
10.2.6.1 D.2.6.1 DNA試劑盒提取布魯氏菌基因組DNA
10.2.6.1.1 D.2.6.1.1 器材及試劑
細菌基因組DNA提取試劑盒(本操作以1種商品試劑爲例)、TE緩衝液、1.5 mL Eppendorf無菌管、200μL~1 000μL移液器、10 μL接種環、光密度儀、水浴鍋。
10.2.6.1.2 D.2.6.1.2 實驗方法
實驗操作方法如下:
a) 在實驗室生物安全櫃中,將 1.5 mL Eppendorf 管編號,並向編號的 Eppendorf 管中加入高壓過的生理鹽水 500 μL,用接種環挑取適量分離培養好的布魯氏菌至 Eppendorf 管制成 OD=3.0菌懸液。
b) 製成的菌懸液加蓋密閉,可移至生物安全櫃外,在實驗室內,置試管架上在水浴鍋 80 ℃,30min,滅活菌液。
c) 將滅活的菌懸液 12 000 r/min 離心 30 min,棄去上清。此操作在 BSL-2 實驗室內進行。
d) 向菌體沉澱中加入 200 μL 緩衝液 GA,使用旋渦混合器,振盪至菌體徹底懸浮。
f) 加入 220 μL 緩衝液 GB,旋渦混合器振盪 15 s,70 ℃放置 10 min,溶液應變清亮,瞬時離心以去除管蓋內壁的水珠。加入緩衝液 GB 時可能會產生白色沉澱,一般 70 ℃放置時會消失,不會影響後續實驗.如溶液未變清亮,說明細胞裂解不徹底,可能導致提取 DNA 量少和提取出的DNA 不純。
g) 加入 220 μL 無水乙醇,振盪混勻 15 s,此時可能會出現絮狀沉澱,瞬時離心以去除管蓋內壁的水珠。
h) 將上一步所得溶液和絮狀沉澱都加入一個吸附柱CB3中(吸附柱放入收集管中),12 000 r/min離心 30 s,棄掉廢液,吸附柱 CB3 放入收集管中。
i) 向吸附柱 CB3 中加入 500 μL 去蛋白液 GD(使用前請先檢查是否已加入無水乙醇),12 000r/min 離心 30 s,棄掉廢液,吸附柱放入收集管中。
j) 向吸附柱CB3中加入700 μL漂洗液PW(使用前請先檢查是否已加入無水乙醇),12 000 r/min離心 30 s,棄掉廢液,吸附柱放入收集管中。
k) 向吸附柱 CB3 中加入 500 μL 漂洗液 PW,12 000 r/min 離心 30 s,棄掉廢液,將吸附柱 CB3放入收集管中。
l) 將吸附柱 CB3 放入收集管中,12 000 r/min 離心 2 min,棄掉廢液,將吸附柱 CB3 開蓋置於室溫放置數分鐘,以徹底晾乾吸附材料中殘餘的漂洗液。這一步目的是將吸附柱中殘餘的漂洗液去除,漂洗液中乙醇的殘留會影響後續的酶反應(酶切、PCR 等)實驗。
m) 將吸附柱 CB3 轉入一個乾淨的離心管中,向吸附柱的中間部位懸空滴加 50 μL~200 μL 洗脫緩衝液 TE,室溫放置 2 min~5 min,12 000 r/min 離心 2 min,將提取的 DNA 溶液收集到離心管中。
n) 爲增加基因組 DNA 的獲得率,可將離心得到的溶液再加入吸附柱 CB3 中,室溫放置 2 min,12 000 r/min 離心 2 min。洗脫緩衝液體積不應少於 50 μL,體積過小影響回收效率。洗脫液的 pH 值對於洗脫效率有很大影響。
DNA產物應密閉保存在≤-20 ℃冰箱,以防DNA降解。
注:所有操作嚴格按照試劑盒介紹進行,如試劑或介紹有變動,則以介紹爲準。
10.2.6.2 D.2.6.2 煮沸裂解法提取布魯氏菌基因組DNA步驟如下:
a) 菌液準備。用生理鹽水將布魯氏菌製備成 OD=3.0 菌懸液,取 l mL 放入 1.5 mL 的 EP 管,13 000r/min 高速離心 1 min,棄掉上清液。
b) 菌體裂解。用 1 mL 的 TE 緩衝液將菌體懸浮混勻,置沸水中 10 min。
c) 菌體 DNA 製備。13 000 r/min 高速離心 10 min,取上清液即爲菌體 DNA。
d) 無菌試驗。吸取 1/10 體積的 DNA 溶液接種適宜培養基,放入 37 ℃培養箱中培養。72 h 後觀察確認無細菌生長後,爲實驗用 DNA。
10.3 D.3 布魯氏菌實驗生物安全要求
D.3.1 根據衛生部 2006 年發佈的《人間傳染的病原微生物名錄》,涉及抗原製備的大量活菌操作,或易產生氣溶膠的病原菌離心、凍幹以及活菌感染的動物等實驗需要在生物安全三級實驗室操作。布魯氏菌樣本的病原菌分離純化、藥物敏感性實驗、生化鑑定、免疫學實驗、PCR 核酸提取、塗片、顯微鏡觀察等初步檢測在生物安全二級實驗室操作。不含布魯氏菌致病性活菌材料的分子生物學、血清免疫學等實驗在生物安全一級實驗室操作。
D.3.2 運輸包裝分類:按衛生部2005年第45號令《可感染人類的高致病性病原微生物菌(毒)種或樣本運輸管理規定》和國際民航組織文件Doc 9284《危險品航空安全運輸技術細則》的分類包裝要求,布魯氏菌病原菌和標本應按A類UN 2814的要求包裝和空運;通過其他交通工具運輸的可參照標準包裝。
11 附錄E(資料性附錄)鑑別診斷
11.1 E.1 傷寒、副傷寒
傷寒、副傷寒患者以持續高熱、表情淡漠、相對脈緩、皮膚有玫瑰疹、肝脾腫大爲主要表現,而無肌肉、關節疼痛、多汗等布魯氏菌病表現。實驗室檢查血清肥達反應陽性,傷寒桿菌培養陽性,布魯氏菌病特異性檢查爲陰性或弱陽性。
11.2 E.2 風溼熱
布魯氏菌病與風溼熱均可出現發熱及遊走性關節痛,但風溼熱可見風溼性結節及紅斑,多合併心臟損害,而肝脾腫大、睾丸炎及神經系統損害極爲少見。實驗室檢查抗鏈球菌溶血素“O”爲陽性,布魯氏菌病特異性檢查爲陰性。
11.3 E.3 風溼性關節炎
慢性布魯氏菌病和風溼性關節炎均是關節疼痛嚴重,反覆發作、陰天加劇。風溼性關節炎多有風溼熱的病史,病變多見於大關節,關節腔積液少見,一般不發生關節畸形,常合併心臟損害,血清抗鏈球菌溶血素“O”滴度增高,布魯氏菌病特異性實驗室檢查陰性有助於鑑別。