2 概述
胰腺癌惡性程度高,不易早期發現,轉移早而快、預後差。近些年來胰腺癌的發病率在國內、外均有增高。據我國北京協和醫院以及湖南醫學院附屬醫院統計,近十幾年因胰腺癌住院病人比以前10年高3~4倍。在美國胰腺癌的發病率上升了3倍,佔腫瘤死亡率的第4位,僅次於肺癌、結直腸癌、乳腺癌,與前列腺癌相仿。在日本增加4倍。英國、德國增加了2倍。1986年美國診斷爲胰腺癌的新病例高達25550例,死於該病爲24000例。胰腺癌以男性多見,好發於40歲以上者,以胰頭發生率爲高佔70~80%,可爲多中心亦可爲胰內直接擴散。本病是消化道腫瘤中難以早期診斷的腫瘤,臨牀發現進展期胰腺癌僅有10~30%可以根治,經根治後生存率仍很低,5年生存率爲0.18~5%。若以胰頭癌而論,其3、5年生存率爲消化道癌中最低者。爲提高胰腺癌的生存率,關鍵是提高早期的臨牀檢出率。
3 診斷
隨着醫科技術的發展,用於胰腺癌的檢測手段日益增多,爲胰腺癌的早期發現提供了依據。鑑於胰腺癌開始症狀模糊,就醫時大部分已失去手術時間,且預後很差。因此,有條件的地區定做定期的體檢,如B超檢查、CT、MRI、ERCP、SAG等影像學的應用,胰液細胞學檢測、胰腺穿刺組織細胞學檢查,癌相關抗原測定以及ras基因檢查等,使胰腺癌的早期檢出率大爲提高。
4 治療措施
一、胰腺癌手術的治療的現狀
狀胰腺癌的治療迄今尚存在一系列問題。因此對其治療亦難以用某一治療方案統一起來。對治療的影響因素很多:胰腺癌的生物學特性與壺腹癌不同,轉移早,有一部分病例又系多中心性,有的病例是圍膽總管下段的圍管浸潤生長;胰腺癌的部位、大小、惡性程度等等均影響其手術的效果,如Laurent(1993)報道胰腺癌根治病例其療效受諸多因素制約(表1);手術方式急議較大,採取根治性Whipple手術?抑或全胰切除?抑或擴大胰頭癌切除未完全統一。根治性Whipple手術的廓清範圍不夠,還需擴大,而全胰切除其切除率、手術死亡率以及3、5年生存率並未見明顯優於Whipple,而且術後的內、外分泌將終身依賴外源性的,擴大性Whipple可以保留部分胰尾則內分泌可以維持,但胰癌周圍受侵的血管亦要切除,不但手術創傷大,1、3年治癒率尚需大宗病例佐證;深度黃疸者,術前是否要經PTCD引流減壓,亦未完全取得一致的看法。以上幾個問題一直在困惑着外科醫生,有時難以確定治療方案。
表1 根治性胰腺切除後1年、5年生存率及影響的因素
| 因 素 | 1年(%) | 5年(%) |
| 部位 | ||
| 胰 | 58.5 | 10.4 |
| 壺腹周圍 | 78.6 | 52.4 |
| 腫瘤分級 | ||
| Ⅰ或Ⅱ | 75.0 | 53.6 |
| Ⅲ或Ⅳ | 63.6 | 18.5 |
| 膽紅素 | ||
| <2 | 85.7 | 71.4 |
| >2 | 62.4 | 18.0 |
| 分化程度 | ||
| 好 | 90.0 | 20.2 |
| 中或不好 | 50.0 | 0.0 |
| 大小 | ||
| <4cm | 67.7 | 23.7 |
| >4cm | 61.4 | 40.9 |
| 十二指腸受侵 | ||
| 是 | 71.6 | 59.7 |
| 否 | 64.0 | 15.5 |
| 淋巴結陽性 | ||
| 沒有 | 53.2 | 44.4 |
| 一個或多個 | 78.6 | 26.6 |
| 放療 | ||
| 是 | 72.9 | 0.0 |
| 否 | 68.3 | 35.7 |
二、胰腺癌的手術治療
(一)胰腺癌是一消耗性極爲嚴重的疾病
對生理擾亂甚大。胰腺癌的主要病理生理改變爲:黃疸及其所致的凝血機能障礙;重度消瘦及營養不良所致的全身一系列改變;高血糖或低血糖等內分泌改變。
1.黃疸:進行性加重是胰腺癌的一個突出症狀。當膽胰管阻塞則影響脂類食物的消化、吸收,致而維生素缺乏以及依賴維生素K的一些凝血因子(凝血酶原、Ⅶ、Ⅸ、Ⅹ因子)缺乏。長期膽管梗阻導致肝功能損害,亦可導致其他不依賴維生素K的凝血因子缺乏(如Ⅴ因子),並容易發生纖維蛋白溶解現象,致使手術野廣泛滲血。注射維生素K後,凝血酶時間恢復至正常或接受正常時,再行手術時,則滲血可以明顯減少。嚴重的阻塞性黃疸的另一嚴重問題是在手術後容易出現急性腎功能不全。嚴重黃疸時急性腎功能不全的原因是多方面的:如腎臟灌注量和腎小球濾過率低;黃疸增加腎臟對低血壓、缺氧的易感性等。高膽紅質血癥本身即可造成腎小球、腎小管的嚴重損害。因此對診斷明確的乏特氏壺腹周圍癌,在經術前合理的糾正全身狀況後,應早期手術,術後要密切注意水、電解質的平衡。
2.消瘦:消瘦是胰腺癌的另一突出表現。消瘦的原因往往是因攝入量不足,持續疼痛,消化吸收功能障礙等。長時期的蛋白質攝入量不足則導致體內的蛋白質成分如肌肉、心肌、酶、抗體蛋白的耗損,使這種病人更容易發生手術後感染、切口癒合不良、切口裂開等併發症。隨着組織的消耗,體重迅速下降,全身總血容量亦隨之減少,紅細胞容量亦下降。對此則身體產生一系列的適應性反應,如全身血管牀收縮,以適應於降低了的血容量,使血壓維持於一定的水平,而在這種情況下進行麻醉,手術額外失血、失液、循環血量銳減,則血壓迅速下降甚至發生休克。因此,在術前進行積極的改善病人的營養狀態,提高其免疫能力,對降低手術死亡率和手術後的併發症,是極爲重要的。如術前短期的給以靜脈輔助營養或要素飲食(2周左右),可改變病人的全身狀況,扭轉負氮平衡。
3.內分泌的改變:胰腺疾病病人可能患有高血糖或低血糖症。對於外科手術病人,血糖過高、過低均是危險的。而手術前後又常常有使血糖過高或低的因素:如麻醉、創傷、兒茶酚胺分泌增多,輸入高滲葡萄糖、禁食、胰島素應用過量等。通常情況下糖尿病人術後維持尿糖+~++爲宜,這樣即可避免高血糖或低血糖的危險。
因此,術前應予以積極糾正,使其達到正平衡。如水、電解質、維生素K、C、凝血因子、白蛋白的補充。
當前爭論較多的是對深度黃疸的處理:一種是經PTCD引流以改善症狀再行手術,一種是不應行PTCD引流。
Nakayama對膽紅質超過171μmol/L時,對108例患者PTCD(PTBC),死亡率由28.3%降至8.2~6%。Braasch指出當膽紅質高於342μmol/L者死亡率爲22%,低於此值者死亡率爲13%。Denning報道膽紅質低於102.6μmol/L者,無術後併發症死亡,他又報道經術前做PTCD者,手術死亡率由25%降至16%,術後併發症由56%降至28%。Pitt等認爲PTCD組與對照組死亡率相同(分別爲8.1%、5.3%),Pherson等(1984)報道PTCD組死亡率高於對照組(32%、19%)。而PTCD組出血、感染併發症高,住院時間長。
1988年全國胰腺疾病專題討論會紀要:“對於這種惡性梗阻性黃疸在術前是否先期引流(如PTCD)不能一概而論,如病程短、消耗輕、估計能耐受手術,作不作先期引流,後果區別不大,一般不作常規引流”;“因作PTCD發生併發症(出血、感染、脫管、膽漏等)的機會多,一旦發生後常會失去有效切除的機會。若高膽紅質血癥已累及腎功能,則爲保護腎臟,應考慮先行引流術”。
我們所經歷的惡性梗阻性黃疸病例,絕大部分術前不予以先行引流。在積極的術前準備下予以手術。若行PTC檢查時,一般的在手術的前1天或手術當日進行。手術前1天進行時,待造影結束後應儘量將積存的膽汁抽淨,一般不會引起膽漏。
(二) 胰頭十二指腸切除術(Whipple/Child手術)
Whipple於1935年提出的術式治療壺腹周圍癌,後經Child加以完善,迄今半個多世紀一直用此術式治療壺腹周圍癌。遺憾的是Whipple氏術式對胰頭癌手術的切除率及術後效果均不滿意,一方面是胰頭癌的生物學特性所決定,另一方面這種術式亦有其治療的侷限性,從而又應用全胰切除以及區域性胰切除術等術式治療胰腺癌(下面再行討論)。
Whipple術式雖然爲常用的術式,但有幾個問題尚需討論:
胰島細胞大部分分佈在胰尾,其次爲胰體,而胰頭部最少。Whipple艽作的範圍是胰腺頭部以及腸繫膜右側的胰腺組織。胰尾以及胰體的大部均保留,是否會發生糖尿病。有人報道此術後約15%遲早將會發生糖尿病。Yasugi等報道若切除85~90%的胰腺則幾乎100%發生糖尿病,切除75~85%在術後8~12周發生延遲性糖尿病,切除小於70%者不會發生糖尿病。典型的Whipple手術切除範圍<70%是不會出現糖尿病的,我們的病例(45例)尚未見到發生胰腺的內分泌功能障礙。外分泌功能是否不足仍取決於:殘留胰腺的量;殘留胰腺癌的處理。若保留50%的胰腺組織,胰腺管又系與空腸正確的吻合,吻合後又無狹窄,則殘留的胰腺的外分泌功能得以維持。
2.術中診斷易發生的失誤
胰頭癌及壺腹癌在術中診斷的失誤屢有發生,必須予以重視。
胰頭癌:常被誤爲慢性胰腺炎,或將慢性胰腺炎誤爲胰頭癌。這兩者的鑑別常較困難,有時將慢性胰腺炎誤爲胰頭癌,行胰頭十二指腸切除術者,亦有報道。有時胰頭癌與炎性同時存在,特別是腫瘤埋藏於慢性炎症腫大的胰頭之中,則診斷尤爲困難。其鑑別診斷的要點是:慢性胰腺炎,胰腺常呈一致性腫大,周圍常有炎性水腫。胰頭癌的腫塊往往甚爲堅硬。當胰腺管受阻塞時,則常呈擴張狀態,胰腺周圍少有炎性滲出。
爲了明確診斷,可在術中用細針穿刺活檢,儘量避免做組織做活檢術。切下的胰腺組織過淺,往往難以有陽性發現,而過深、過大雖經縫合,仍然會發生胰瘻等併發症。
壺腹癌:一般情況下,經充分遊離十二指腸後進行觸摸檢查,可做出初步判斷。若切開膽總管以手指由膽管內觸診,則爲診斷又進一步提供了依據。
但值得注意的是在切除前要弄清:
(1)腫塊屬於什麼性質?良性抑或惡性?
(2)結石性肉芽腫抑系腫瘤。少數情況下因結石嵌頓於壺腹部,長期的慢性刺激,在結石周圍增生許多肉芽組織,將其誤爲腫瘤。
鑑於胰十二指腸切除,系嚴重的破壞性手術。除經上述的兩種觸摸方法診斷外,尚需切開十二指腸直接觀察十二指腸乳頭的改變,典型的徵象是乳頭呈菜花狀突起,觸之易出血,當取冰凍切片檢查。有時病變不典型,應切開Oddi氏括約肌直視下觀察。當發現結石與纖維肉芽組織同時存在,亦當做冰凍切片檢查,以防長期炎症刺激發生惡變。
3.要全面地進行探查
在行胰十二指腸切除前,未進行腹腔內的全面檢查,及至手術做完,或進行至一定程度時,方發現遠處有轉移竈,結果進退維谷。這種情況時有發生。故在決定行胰十二指腸切除前,必須按下列順序檢查。
全腹部探查:在探查過程中要有條不紊,通常先檢查肝臟、肝十二指腸韌帶、小腸根部、橫結腸系膜、盆腔等順序,若無轉移竈再進一步探查。
胰腺周圍的探查:這一步驟是手術能否完成的重要環節。沿橫結腸切開胃結腸韌帶,將胃體拉開,檢查胰腺表面、腹腔動脈周圍、胰腺上下緣,以及腹主動脈周圍有無轉移病竈。無任何轉移跡象時,再進行下一步檢查。
將十二指腸外側腹膜切開,充分遊離胰頭,主要檢查縣頭與下腔靜脈有無粘連和癌性浸潤。
當上一步驟檢查正常時,再進一步探查胰頸與門靜脈、上腸繫膜動、靜脈有無癌腫浸潤。先將膽總管切斷(圖1)。斷離膽總管時,應儘量靠近十二指腸上緣。隨後切斷結紮胃右動脈及胃十二指腸動脈。將幽門竇向下拉開,在胰腺頸部背側輕柔地鈍性分離,若與門靜脈之間無粘連及腫瘤浸潤時,再於胰腺下緣以同樣方法分離,檢查胰頸與腸繫膜上靜脈之間有無粘連,若上下可以“會師”,說明無任何粘連。

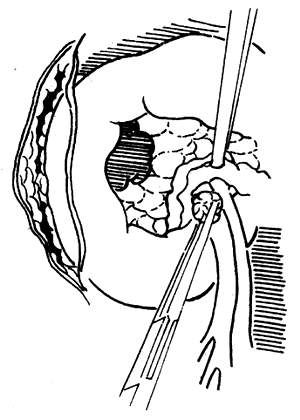
圖1 探查胰腺與周圍的關係
當上述任何一步發現有粘連或者癌腫浸潤時,均不可貿然行根治術,否則將有釀成術中進退維谷,或導致大出血之虞。
4.胰十二指腸切除過程中的幾個問題
切斷胰腺常出現的失誤:用銳器在胰頸一次切斷是錯誤的。這樣往往會將胰管切斷回縮,爲尋找胰管帶來了極大的困難。應採取銳、鈍性交替切割法,邊切邊行間斷縫合,將至胰管部位時,仔細地解剖,切勿盲目地完全切斷胰腺。一般情況下胰管均有擴張,其位置往往在胰腺投影的中上1/3交界處(圖2)。較細的胰管找尋常甚困難,若認真仔細地分離,一般均可以找到,倘若回縮則不易尋找。
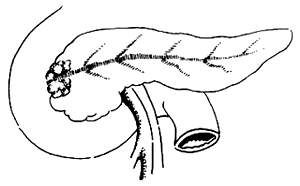
圖2 胰管的位置的胰腺投影的中、上1/3交界
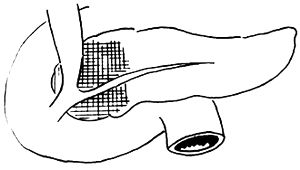
胰腺管遊離的長度以大於3mm爲宜,在切斷之前先切一小孔於其中插入一導管作爲標記,切斷後縫兩針5-0的線以作索引之用(圖3)。胰腺的斷面應做雙層縫合,當靠近胰管的斷面縫合時,鬆緊要適度,以免壓迫胰管。

圖3 將胰管縫兩針牽引並插入導管
胰頭背側遊離時易發生的失誤:胰頭背側遊離中易發生的失誤,主要是血管處理不當。胰頭背側與門靜脈、腸繫膜上血管、腹腔神經叢相連。在遊離過程中稍有不慎則導致出血。特別是在胰頭背側匯入腸繫膜上靜脈的小支,通常有3~6支,由於該靜脈壁薄脆,不可鉗夾,應使用3-0的絲線一一結紮後再切斷(圖4)。將這幾支小靜脈妥善處理後,則腸繫膜上靜脈與胰頭已分離,小心將其拉向左側。其後方即爲腸繫膜上動脈,剪開其結締組織,把進入胰腺鉤狀突的動脈予以結紮,此時在胰頭的背側僅有較厚的一片腹腔神經叢相連,靠近胰頭予以剪斷(圖5)。


圖5 剪斷胰頭背側的神經叢
切除胃、膽總管下端、胰頭、十二指腸以及部分空腸(曲氏韌帶下方5~10cm)。上腹的後腹膜遺有較大的創面,滲出較多,必須徹底止血。易於忽略的是胃十二指腸動脈殘端的保護,在胃腸、胰腸、膽腸重建前,應使用大網膜把該動脈的殘端以及腸繫膜上血管予以遮蓋,以防胰液消失破潰大出血。
例:張××,男,59歲。進行性黃疸已2個月,在黃疸加深的同時,伴有右上腹疼痛。經十二指腸低張造影等檢查,診斷爲壺腹周圍癌。在全麻下行剖腹探查術。肝臟淤膽性腫大,膽管擴張,經仔細檢查及乳頭部冰凍切片檢查,診斷爲壺腹部乳頭狀癌,按常規行胰十二指腸切除術。胃十二指腸動脈殘端結紮並貫穿縫合。胰腺空腸吻合的方式是採取對端套入法併入置引流。術後尚平穩,手術後第7天突然面色蒼白,血壓降至6.67/0kPa隨即於腹腔引流口流出大量鮮血,腹亦相繼膨隆。在加壓輸血下快速進入腹腔,腹腔已被血凝塊積滿。將淤血清除後檢查胰腺空腸吻合周圍,發現出血系來自胃十二指腸動脈的殘端。此殘端及其周圍已被胰酶消化糜爛。隨即將肝總動脈、肝固有動脈均予以結紮,出血即停止。於胰腺後方放置血漿管、薄膜乳膠管引流。術後引流管有少量胰液流出,10天后逐步拔除引流管,恢復良好。
膽囊是否要切除?鑑於膽管腸道吻合手,Oddi氏括約肌失去功能,膽道內的正常壓力難以維持,則膽囊處於排空不暢的狀況,長期膽汁淤積,導致慢性膽囊炎,故應切除膽囊。
要遵循分泌鹼性器官應在上方的原則。爲了中和胃酸、減少吻合口潰瘍的發生,在與腸道重建時,應採取膽管空腸吻合、胰管空腸吻合、胃空腸吻合的順序。
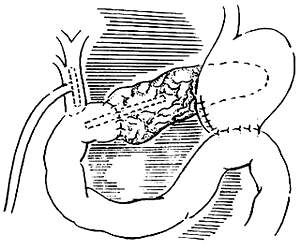
胰管空腸吻合的方式可使用胰管空腸端側吻合和胰腺空腸端端套入法兩種(圖6)。在一般情況下不宜彩胰腺空腸端端套入法,此術式術後發生胰漏的併發症高於前者。因此除非胰管很細,確實難以吻合時方可採用。
(1)

(2)
圖6 兩種吻合術式
膽管空腸端側吻合。膽管管徑一般均較粗吻合多無困難。爲了防止胃液、胰液的返流而影響膽腸吻合的癒合,應在吻合的上方,置T型管外引流。
胰管空腸端側吻合失敗的原因是胰管未能與空腸粘膜做到切實的吻合。吻合時縫合針數的多少,決定於胰管的管徑大小,細者縫線亦不應少於4針,否則易發生胰瘻。爲防止吻合口的狹窄,並能將胰液引至體外腸道內,應在胰管內置入一嬰兒尿管,或相應粗細的硅膠管,由腸管戳孔拉至體外(圖7)。支撐引流管置入胰管的深度,待導管置入胰腺管至不能再進入的深度後,退管1~2cm即可。

圖7 胰管內支撐經內空腸拉出體外
胃空腸吻合按常規施行,需注意的是吻合口距膽、胰管空腸吻合口的距離,一般應在這兩個吻合口下方至少20cm。旨在防止返流性膽、胰管炎。
6.引流管的放置
鑑於十二指腸切除術後的創面大、滲血多,特別是胰液的滲漏,對周圍臟器的腐蝕、消化,將引起大出血、腸瘻等,應正確地選擇並妥當地放置引流管。
(1)引流管選擇的原則:質軟、引流通暢、刺激性小、管孔不易被纖維蛋白所堵塞。
(2)引流管放置的位置:以下列方式爲妥膽管吻合口附近置薄乳膠管及捲菸引流各一根。胰管空腸吻合口後方(背側),置菸捲引流一根。5根引流管分別做好標記,連同T型管一併拉出體外。各引流管引出體外時必須在腹壁另行戳孔(圖8)。戳孔的大小以在麻醉狀態下於引流管旁可容一指爲宜。引流管決不可由腹壁切口拉出,否則胰液滲至腹壁各層,致而進行消化,使切口裂開。

圖8 引流管經腹壁另戳孔拉出
(3)由於胰腺空腸吻合是Whipple術中一個關鍵性步驟,倘若處理不當則將導致一系列的併發症,如胰漏、出血等以至手術完全失敗。特別是胰液未能引出體外則胰酶原波激活,在漏的周圍進行消化,造成大片組織壞死、出血,以至將吻合口完全溶潰。我們曾遇到1列因胰空腸吻合口漏引流不當將胃十二指腸動脈消化潰破,引起嚴重的大量出血。綜合當前對胰腺管的處理:
①胰腺管、空腸粘膜對粘膜吻合:前面已介紹,此方法併發症少。若用支撐管並拉出體外是一最爲安全的方法。
②胰腺管結紮:主張此法者認爲手術簡單方便又省時,發生胰漏少。方法是將胰管用可吸收線結紮,將殘胰套入空腸腔內行雙重的胰空腸吻合,約2周後結紮線吸收,則吻合處已癒合。有限的病例報道無胰漏發生,但胰管是否會狹窄、梗阻則不得而知。
③胰腺斷端套入空腸:此法是將殘留胰腺斷面徹底止血後,直接與空腸行端一端套入(若空腸口徑較小則可取行胰腺空腸端側吻合)。此法較簡單、不易發生胰漏。胰管是否狹窄尚無確切的資料。但有人報道採用此種術式者,不需依賴胰腺外分泌的供給。
④胰腺管栓塞術(Pancreatic duct occlusion,PDO):胰腺管栓塞術是用栓塞劑將胰腺管1~2級支予以栓塞使外分泌液不能流出,從而使其不發生胰漏。栓塞劑有α-氰基丙酸脂(α-cyano-acry-lete glue)、氯丁橡膠(neoprene latex 671)。現國內生產的氰基丙酸脂作用較好。我們曾用其對冠狀靜脈(胃冠狀靜脈曲張)栓塞,效果較爲理想,尚未見毒素副作用。Carlo報道51例胰十二指腸切除術,胰管用氯丁橡膠進行胰腺管栓塞,51例中2例發生胰漏,經超聲和CT檢查殘胰未見明顯的形態學改變。有10例經3年的隨訪未見胰腺內分泌有異常改變,均未發生糖尿病。
胰十二指腸切除術,殘留胰腺的處理是十分重要的,若胰腺管處理不當則將發生胰漏,以至發生不可收拾的後果。我們的有限經驗是:首選胰腺殘端的胰管粘膜-空腸粘膜端側吻合,吻合口縫線4~6針即可。在吻合口內插入一刺激性小的硅膠管,通過空腸拉出體外。此導管一方面起支撐作用,另一方面可以觀察每天胰液、量的變化,10~14天后拔除。空腸漿肌層與胰包膜妥爲縫合,並在胰-空腸吻合口周圍置外引流,有少量的胰液漏出可以充分引出體外,不會帶來併發症。在一般情況下由於胰頭處有不同程度的梗阻,遠端胰管均有一定的擴張,絕大部分可以進行胰管-空腸粘膜吻合。若殘胰胰管十分纖細且又回縮至胰實質內,無法進行粘膜對粘膜的吻合,只好採取胰斷端空腸套疊式吻合。胰管結紮、栓塞術是一治療方法,尚需進一步深入的觀察與探討,並通過大宗的病例進行長期的實踐。
通過幾十年的臨牀實踐對Whipple手術的適應範圍、療效有了進一步的認識。Whipple術式壺腹癌的效果最佳;切除率高達90%,5年生存率40~45%。而胰腺導管癌的切除率僅僅10%左右,5年生存率3.5~5%。Whipple術式對胰腺癌效果不好的原因,除胰腺癌本身的生物特性外,尚有一些因素爲Whipple手術所無法解決的,這些是:胰周圍淋巴結、血管浸潤;6%左右病人胰腺癌是多中心的;約有半數病人的胰腺切緣有腫瘤存在。鑑於此則將胰腺癌的手術療法予以擴大,如全胰切除,區域性胰腺切除等。保留幽門的胰十二指腸切除對胰頭癌的治療,尚有較多爭議。
關於胰頭癌切緣的問題。Wilett報道1978~1991年麻省總醫院72例胰頭癌切除的情況。67例(93%)的標本做了病理檢查,其中37例(51%)切緣有腫瘤侵犯。胰周軟組織27例次、胰橫斷面14例次、膽總橫斷面4例次。而胃或十二指腸切除面無腫瘤侵犯。全組病人,39例術後接受放療及化療。35例切緣陰性者,其5年存活率、局部控制和無遠處轉移分別爲22%、43%和37%。而37例切緣陽性者,其3年生存率、局部控制和無遠處轉移分別爲6%、22%和19%。切緣陽性病人存活不超過41個月。他們又對病人進行了分析,陰性者,其病理特徵和組織分型較好,或無血管侵犯,2年和5年存活率高達83%。病理學檢查發現27例(38%)腫瘤延伸至胰周軟組織邊緣,從而表明腫瘤侵犯手術切緣或胰周軟組織切緣佔較大比例。
(三)全胰切除術
針對Whipple術式對胰頭癌治療存在的問題,許多學者相繼採用全胰切除術。Mossa等報道全胰切除的手術死亡率以及3、5年生存率(表2)。
表2 全胰切除術的死亡率、生存率
| 報道者 | 例數 | 手術死亡率(%) | 生存率% | |
| 3年 | 5年 | |||
| Moossa | 64 | 6 | 57 | 21 |
| Brooks | 34 | 11 | 30 | 17 |
| Van Heerden | 51 | 14 | 9 | 2.3 |
| Avran | 42 | 28 | 5.7 | |
從表中可以看出,全胰切除死亡率較高,3、5年生存率Moossa、Brooks高一些,而Van Heerden、Avran的生存率並無明顯增加。而術後要長期依賴胰島素和胰酶的外源性供應。此外尚存在着一些問題:全胰切除對淋巴結清除仍不完善,Cubilla對Whipple術式、全胰切除、區域性胰切除者的淋巴結數目進行比較,平均爲28、48、73,可以說明淋巴結清除是不夠徹底;當胰癌累及了內臟血管,全胰切除亦是禁忌的;常規的胰腺切除,在胰腺切緣只要無腫瘤存在,可以達到全胰切除的後果;全胰切除後上消化道出血遠遠高於Whipple術式。因此,對全胰切除術要慎重使用。
(四)區域性胰腺切除
區域性胰腺切除又稱之爲“超根治”或“擴大根治術”。其手術範圍:胰腫瘤本身胰腺周圍組織、區域淋巴結和淋巴結組織、胰段門靜脈大塊切除。並將此術式分爲幾個類型。Ⅰ型:胰腺本身的次全或全切除;Ⅱ型:主要受累動脈和腸繫膜上、下動脈、腹腔動脈以至肝動脈切除,用人造血管或大隱靜脈移植;O型:不切除血管,淋巴結廓清範圍較廣,包括雙側腎包膜的上1/2、腎蒂血管、輸尿管,並向內側清掃下腔靜脈和主動脈前半周徑,以及兩者之間的淋巴結和軟組織。這一手術的破壞性較大,5年生存率有所提高。Fortner報道的病例早期死亡率較高(30%),及至1980~1984年的第二階段死亡率爲6%。對晚期腫瘤的療效並未提高。宮崎逸夫主張對Ⅰ、Ⅱ期病例行擴大廓清術,他報道的34例胰頭癌切除術後,5年生存率20.8%,其中能夠耐受擴大廓清術的17例,5年生存率爲40.3%。
胰腺癌的“超根治”手術,此術式從解剖上以及有限病例的隨訪結果來看,是優於Whipple及全胰切除術,但有許多地方要進一步完善,而且推廣起來難度亦較大。
胰腺癌的發病率在增長,而手術切除率並未相應提高,因此,當前對外科姑息療法仍值得探討。
1.Watanapa綜合1971~1990年的9809例胰腺癌手術資料:
(1)1971~1980年共4157例,切除手術436例(10%)、轉流術1854例(28%)、剖腹探查術1162例(28%)、未予以治療705例(17%);在資料完整的3079例中,386例切除手術、1654例轉流手術和1039例僅做探查手術的死亡率分別爲17%、17%和36%,其平均生存期分別爲12.7月、5.4月和2.6月。
(2)1981~1990年共5650例,切除手術859例(15%)、轉流手術2788例(49%)、剖腹探查1215例(22%)、非手術膽道減壓87例、未予以治療701例(12%)。從上述說明1981~1990年比1971~1980年胰腺癌的手術切除率由10%增至15%,姑息性手術也由1071~1980年的49%增至1981~1990年的57%,單純剖腹探查已由28%降至22%。近3年來手術切除率又有一定的提高。這一提高是由於各種診斷手段如B超、CT、MRI、SAG等的廣泛使用,以及與手術操作和圍手術期的正確處理是分不開的。另在2268例中(資料完整),481例切除手術、1144例轉流手術和634例探查手術的死亡率分別爲9%、14%和18%,其平均生存期分別爲17.0月、6.6月和 3.1月。
(3)胰體、尾癌治療仍無多大的變化。1973年Richards報道70例胰體尾癌,50例行探查術,其中僅手術切除4例(8%),轉流手術3例(6%),其餘病例(43例)僅僅探查。至1986年Matsuo報道100例胰體、尾癌,其中能切除者僅7例,轉流術17例,70例僅作剖腹探查。原因是體、尾部的癌腫難以早期發現,及至症狀明顯時多已轉移。
2.姑息性切除術:
對於胰頭癌的治療,一般不主張施行姑息性切除術。因姑息性切除的死亡率仍在5~10%;併發症與標準的胰十二指腸切除相似;術後平均生存僅10個月與轉流術平均生存6.6月相比無明顯優越性。
3.轉流手術:
轉流手術之目的是爲減輕梗阻性黃疸。通過膽管置支撐管以及手術轉流兩種方式。Hyotry等綜合1807例膽道手術轉流、490例經皮膽道內置支撐物、689例經內鏡支撐物置入的治療結果:30天內死亡率分別爲12%、9%、14%。成功率分別爲93%、92%、90%。
手術轉流可行膽囊空腸吻合、膽總管十二指腸吻合等。當視具體情況而定,若用前者則必須驗證膽囊管通暢時方可使用。膽腸內引流後,是否需同時行胃腸綜合,當視胰腺頭部癌腫是否壓迫十二指腸,若有壓迫的現象則應同時加以胃空腸吻合。
胰腺癌的疼痛是十分劇烈的,晚期多因神經壓迫所致。因此,膽道轉流術並不能緩解劇疼,只能解決一些因淤膽而產生的脹痛。化學性內臟神經去除術有一定的療效。Gardner採用5%石炭酸杏仁油40ml注入內臟神經,80%可獲得疼痛緩解。外束放射線照射亦能起到緩解疼痛的作用。
(六)術中放療
胰腺癌療效令人失望,往往是因胰周組織癌性浸潤和胰腺切緣仍有半數以上殘留有癌細胞。雖然自70年代以來已應用體外放射治療,但效果亦欠佳。因而採用術中放射治療(Intra-operative radiotherapy,IORT)。IORT能夠一次大劑量直接照射腫瘤及其周圍組織,其照射範圍較準確,對周圍組織影響較少。IORT是既爲胰腺切除術後的輔助治療,又可對難以切除的癌腫之用。若有遠期轉移則效果難以肯定。
IORT是用高能電子束在術時照射,另一種是在術中將放射能源植入後再通過後裝機予以放射。高能電子放射治療系由直線加速器產生,可根據腫瘤的範圍應用相應探頭。在一個大手術野中可行多區域照射。照射時要避開或予以保護正常組織。IORT後再結合體外照射。IORT後再加外照射及高溫透入(可用超聲透熱器)則可提高療效。
IORT照射後可殺傷局部癌細胞和控制局部復發。Hiraoke對15例行胰十二指腸切除並加網膜淋巴結切除者進行照射。用30Gy對腹腔動脈、門靜脈、腸繫膜上動脈、下腔靜脈等處照射,5年生存率達33%。Ozaki用IORT並加用絲裂黴素行肝動脈、門靜脈灌注,術後繼續應用絲裂黴素,1、3年生存率分別爲88%和53%,而只行根治者1、3年生存率分別爲26%、10%。
IORT後能夠有效的緩解頑固性疼痛,機制尚不清。IORT並對機體的免疫功能,如對NK細胞、LAK細胞以及干擾素活化殺傷細胞等無明顯抑制作用。IORT有時可出現一些併發症,如胃、十二指腸潰瘍、出血、穿孔、吻合口漏等,少數可發生主動脈瘤、血栓、椎體壞死、周圍神經損傷等。若放射治療掌握得當,照射野能做到妥善保護,則併發症可以明顯減少。
三、胰腺癌手術後處理
術後常易發生下列問題:
1.血容量不足
由於胰頭十二指腸切除術後創面大、腹膜後淋巴循環豐富,故滲出量甚多。術前病人已處於長期的營養不良、低血漿蛋白狀態;術中出血量大,手術時間長,水分蒸發量亦很大。因此,術後的水分、晶體、膠體均要相應輸入。若僅按常規量補充則血容量遠遠不夠。
大量輸液時的監護甚爲重要。除觀察血壓、脈搏外,並放置導管觀察尿量。置中心靜脈壓插管,不斷地測中心靜脈壓和血氣。間斷地應用利尿利。
當有深黃疸時,由於高膽紅素血癥等因素,腎臟已有不同程度的損害,尤應觀察腎功能的變化。
急性血容量不足多發生於術後48~72小時,此時要大量補充之,有時在24小時內要輸入7000~8000ml晶、膠體,才能維持足夠的血容量。
2.各引流管的觀察及拔管時間
術後各引流管的觀察如滲液量、滲出物的性狀等十分重要。過多過少的滲出均不正常,應根據手術的方式、各引流管放置的部位等加以綜合分析。
掌握拔管的時間,以及拔管的指徵甚爲重要。過早拔除達不到引流的目的,腹腔內積液得不到引流,則易於發生腹內感染,胰液滲出等將腐蝕周圍的臟器。拔除過晚不但引流管被纖維蛋白堵塞,併成爲感染竈。
(1)胰頭、十二指腸牀引的引流管:在術後72小時滲液逐漸減少,即可拔除。或先退出一部分,觀察12小時,若仍無滲液即可完全拔除。
(2)膽管空腸吻合口的外引流管:若滲液不多,通常在術後48小時即可拔除。
(3)胰管空腸吻合口周圍的引流管:72小時先拔除菸捲引流,繼而拔除乳膠薄膜引流管。血漿引流管留置時間應在10天左右,旨在使其成爲一個纖維竇道,即使有胰漏亦可沿此引流管流出。10天后若無胰液外滲,則可將血漿管逐漸退出。
胰管空腸吻合口支撐着;術後要妥加保護,它不但起着支撐作用,而且把胰液引流到腸內、體外,從而養活了吻合口瘻的發生率。術後48小時內胰液減少,嗣後每日可引流出數百毫升(300~800ml)。拔除時間以術後2周左右爲宜。
(4)T型管:放置T型管不但減少膽管瘻的發生,由於其一臂在空腸內,又可養活胰瘻的發生。通常在術後2~3周拔除。拔管前應先夾管1~2天。
3.對胰瘻的處理
胰瘻及其所致的腹腔內感染、出血,是胰十二指腸切除術的嚴重併發症。胰瘻的來源往往來自胰管空腸吻合處,以及胰腺的斷面,開始爲胰液漏出,繼而形成竇道而成爲瘻。若爲胰腺的斷面瘻則經充分引流,數日即可停止,若爲胰腺空腸吻合處瘻,則應加強引流,以至負壓引流,有時改用雙套管引流。此時應持續全靜脈內營養,一般3~4周大部分病例可以癒合,可適當使用善得定以加速癒合,對瘻口不可隨意搔利,引流期間瘻口周圍予以保護,防止皮膚被胰酶消失。
4.對出血的防治
胰十二指腸切除後,出血可能來自:胰腺斷面及周圍的血管;各個吻合口;胃腸道粘膜。來自胰腺斷面及其周圍的血管,出血量一般均很大,出血常難以控制。
對出血的防治:術後使用止血劑有一定效果,但更主要的是術中止血及各引流管要放置得當,術後觀察各引流管是否真正達到引流目的。若胰管內的支撐引流管,每日可引流出300~800ml胰液,胰空腸吻合口周圍的各引流管,又能引流出胰斷面的滲出液,胰腺周圍無胰液積存,加之胰空腸吻合口的背側有大網膜覆蓋,則不會消化其周圍的大血管,如胃十二指腸動脈的殘端、胰腺上下動脈等。
膽道空腸吻合口、胃空腸吻合口的出血,通過T型管及胃管引流出的液體,可以明確診斷。這些部位的出血量均不甚大,經姑息治療後多可停止。
胃腸道粘膜的應激性潰瘍出血,多系慢性出血,表現爲柏油樣大便,除使用常規的止血劑外,並予以口服或靜脈滴注甲氰咪胍米,不可貿然手術。
胰大部切除術後常致脂肪的消化吸收功能障礙。切除60~85%不致發生嚴重腹瀉,當切除90%左右則常導致胰腺的內、外分泌功能障礙。要不斷地檢測血糖的變化,並觀察大便的性狀,相應地予以補充胰島素及胰酶。
5 病理改變
一、臨牀病理、分期
胰腺癌爲胰腺外分泌組織所發生的惡性腫瘤。大多數來自導管上皮,少數來自腺泡上皮。胰腺癌佔所有癌的1~4%。
1.大體所見:
胰腺癌發生在胰頭者佔70~80%,體、尾部佔20~30%,遍及全胰腺者少數。腫瘤多向胰腺表面隆起,形成硬實結節或粗大結節、灰白色,腫瘤界限往往不清。癌腫大小不等,體積小的腺癌可埋於胰實質內,但其周圍的胰腺組織往往陷於硬化,有時胰腺可變形。胰腺癌有時與慢性胰腺炎很難鑑別,以至將慢性胰腺炎誤爲胰腺癌而行根治術。胰頭癌常侵及十二指腸壁,則與壺腹部的正常關係模糊不清,但十二指腸粘膜一般尚正常。癌腫的切面呈灰白色、質硬,少數呈膠凍狀、乳頭狀或囊狀,較軟,若有出血壞死則亦可變軟。
2.光鏡所見:
按其組織形態可分爲腺癌、腺鱗癌、粘液腺癌、囊腺癌及乳頭狀囊腺癌、巨細胞癌、腺泡細胞癌及未分化癌等。
(1)腺癌(Adenocarcinoma):又稱導管細胞腺癌、柱狀細胞癌等,爲最常見的類型,約佔90%,癌細胞多呈高柱狀或立方形,核圓或橢圓形,多在基底部。胞漿多呈水樣透亮染色,無顆粒,偶見纖毛。癌細胞圍成大小不等、形態不規則的腺腔,腺腔有時擴張,但不成囊狀。有的腺癌,巢小而一致,呈小腺管樣結構,粘液染色多呈陽性。
(2)粘液腺癌(Mucinous adenocarcinoma):又稱膠樣癌,較爲少見。腺癌的腺腔明顯擴大,並含有多量粘液。有時可見大量“印戎細胞”,可漂浮於粘液中,亦可成堆出現。
(3)囊腺癌及乳頭狀囊腺癌(Cystadenocarcinoma and papillary cystadenocarcinoma):佔腺癌中的小部分。腺癌癌巢擴大成多數囊腔,腔壁癌細胞呈乳頭狀生長伸入腔內,甚至充滿囊腔。
(4)未分化癌(Anaplastic carcinoma):細胞較小、胞漿稀少,核小,梭形成圓形,核仁較明顯。癌細胞常瀰漫成片浸潤,部分可排列成巢索狀而呈單純癌樣結構。粘液染色常陰性。
在胰腺癌周圍的正常組織內,均可見有導管上皮的杯狀細胞增生肥大,粘液腺體增生或鱗狀化生;導管上皮乳頭狀增生及異型性增生,甚至形成原位癌及早期浸潤癌,此變化尤以腺癌爲多見,則可說明胰腺癌是由導管上皮發生的。胰腺癌常伴有較廣泛的血栓形成,癌組織不僅僅侵入局部門靜脈、腸繫膜靜脈、脾靜脈等形成血栓,而且在周身其他各處亦可形成血栓。
胰腺導管癌與胰腺導管上皮增生有密切關係,在一些手術切除的標本中也發現了胰腺導管癌與胰腺導管上皮增生的共同現象。因而胰腺導管上皮增生可能爲胰腺癌的癌前病變。Pour等報道胰腺導管上皮增生的發病率爲57%,胰腺癌的發生率爲10%。Furuta將胰腺導管癌分爲:腫塊型和導管擴張型兩類。他們可以發生在主胰管、分支胰管及胰管終末分支與腺泡。腫塊型胰癌主要發生於胰管分支部位,以管狀腺癌爲主。導管擴張型胰腺癌好發於主胰管,以;乳頭狀癌爲主,另伴大量粘液,在導管內彌散生長。腫塊型胰導管癌是從外周向中心主胰管生長,因此,這種癌造成主胰管擴張是增大的癌腫壓迫或阻塞主胰管。導管擴張型胰管癌則在主胰管或鄰近主胰管的分支胰管處發生,早期容易出現主胰管狹窄,而產生狹窄遠段的主胰管擴張,因這種癌分泌粘液較多,則腫瘤細胞易於在導管內播散。導管擴張型胰癌影像檢查較易早期發現,其預後較腫塊型爲好,手術切下標本看,絕大部分的導管擴張型胰癌,侷限在胰腺內。
胰腺癌的另一生物學特點,雖爲小胰腺癌,而癌細胞已通過淋巴管、周圍的神經、疏鬆和結締組織向鄰近浸潤和轉移。往往癌細胞在侵入淋巴結前,已有周圍神經、淋巴管的浸潤。
一種意見認爲胰腺癌早期發生圍膽管浸潤,胰頭癌常早期侵犯總膽管,即使小胰癌(直徑<2cm)而且離膽總管有相當距離,亦可發生明顯的圍膽管浸潤。這並不是鄰近癌組織的直接累及膽管下端,而是胰頭癌的轉移性浸潤,其途徑可能是通過胰頭內淋巴擴散到達總膽管壁。胰體癌向腹膜後擴散是否也可能有同樣性質,認爲有很大的可能性。
另一種觀點認爲胰腺癌的發生在胰腺內一開始即爲多中心性。鑑於此論點,則對胰腺癌不論在何部位,均應行全胰切除術。經Motojima採用PCR方法對K-ras基因突變進行了研究,認爲多中心性發生是存在,但發生率很低,僅爲6%,故無必要對所有胰癌均做全胰腺切除術。
胰導管癌的轉移方式是由胰導管內至周圍神經至淋巴管最後至血管。胰腺癌淋巴結轉移之特點是以胰頭上組及胰十二指腸後組的淋巴結轉移多見;胰體上組和胰頭下組的淋巴結轉移率次之,脾門區、膽總後、胃周圍淋巴結組較少發現淋巴結轉移癌。雖然胰腺癌早期有鄰近淋巴管、周圍神經、疏鬆結締組織的浸潤,但不一定有淋巴結轉移。Nagai報道胰腺癌在0.4×0.3cm時,病理上已有淋巴管、周圍神經、鄰近疏鬆結締組織的浸潤,但未發現胰周淋巴結轉移。胰癌的血路轉移,首先是在癌生長的鄰近血管區,當癌塊較小時即可能對門靜脈及動脈侵犯。Tashiro報道肉眼判斷胰腺癌已侵犯門靜脈,仍有25%未發現有組織學上浸潤,雖然組織學上已侵犯了血管外膜或中膜,仍有51.9%無內膜的浸潤。因而當一個小的胰腺癌即使侵犯了門靜脈,也不應放棄手術切除。但在早期的胰腺癌手術切除時,不能僅僅滿足於腫瘤的局部切除,應將鄰近的結締組織、腹腔周圍神經以及淋巴結一併切除,從理論上說,手術方爲徹底。
5.胰腺癌的臨牀分期:
胰腺癌分期標準很多,各有其代表性,亦能反應其特點,關鍵的問題還是有無淋巴結轉移。當前尚無一個通用的分類法,現將幾個較爲常用的分類法介紹於下:
1.Hermreck的分期法(1974)
2.Kloppol的TNM分期(1979)
M0:無血行轉移
M1:血行轉移

T1
 >
>
T2
 >
>
T3
 >
>
T4
 >
>
N1
 >
>
N2
 >
>
N3
 >
>
N4
T1:<2cm,侷限在胰腺內
T2:2~6cm,侷限在胰腺內
T3:>6cm
T4:侵犯胰外緊鄰組織
N2:已侵犯兩個區域淋巴結
4.錢禮胰頭癌分類法(1989)
Ⅰ期:T1N0M0
Ⅱ期:T2N1M0
T2:癌腫已超出胰腺包膜,一般<5cm,已侵及鄰接組織、膽管或十二指腸,或膽管內有多發病竈
Ⅲ期:T2-3N1-2M0
T3:胰癌已侵及胃、脾或腹膜後組織如PV或SMV,一般>5cm
Ⅳ期:T2-3N1-3M1
6 臨牀表現
胰腺癌的早期往往無特異性症狀。在早期表現爲上腹不適,往往出現隱痛、脹痛、鈍痛等。在餐後症狀加劇,這可能因膽管有不同程度的梗阻,餐後,尤其在高脂飲食後膽、腋液分泌增加,壓力增加所致。當胰腺癌位於胰腺尾部在早期症狀尤爲隱蔽,僅感左上腹不適、脹痛。及至胰腺癌發展至中晚期則症狀即很明確:黃疸逐漸出現,且進行性加重及時深度黃疸,大便亦逐漸變爲陶土色,同時出現高膽紅素血癥所致的一些皮膚瘙癢等。當病情進一步發展則疼痛劇烈,牽扯至腰背部,晝夜難眠,系癌腫侵犯腹腔神經叢所致。胰尾部腫瘤由於壓迫脾靜脈則脾臟增大,左脅部劇痛,有時癌栓侵及脾靜脈、門靜脈而出現區域性門脈高壓,繼而出現低血蛋白症,大量腹水出現。胰腺癌的病程晚期則體徵明顯出現:深黃疸、肝大以至可觸及膽囊、上腹部可觸及包塊有壓痛且包塊固定等。
8 輔助檢查
一. 腫瘤相關抗原測定利用單克隆抗體技術發現有許多新的腫瘤相關抗原,有的對胰腺癌的敏感性較高。
1.CA19-9和CA50:正常胰腺組織能夠表達CA19-9和CA50,組織化學顯示,CA50存在於小的末端導管和中央腺泡組織中,在大導管着色最強,而CA19-9極少在小導管差色,正常的胰島細胞對CA19-9和CA50都不表達。臨牀發現抗原血清濃度與胰腺腫瘤大小兩者高度相關。CA19-9對胰癌檢出率與CT相當。Sakahara以37μ/ml爲閾值,腫瘤直徑<3cm、3~5cm、>5cm的病例中,CA19-9的陽性率分別爲13%、90%和92%。
Alberto用固相放射免疫法檢測CA19-9,他以40μ/ml爲標準,診斷胰腺癌的敏感性爲90%。Farini以17μ/ml和37μ/ml爲CA19-9的閾值,檢查130例胰腺癌和慢性胰腺炎者,診斷的敏感性分別爲86.7%和62.3%,特異性分別爲73.3%和87.0%。Sakahara以CA19-937μ/ml爲標準,檢查55例胰腺癌和22例慢性胰腺炎,其準確性爲83%。一些學者認爲當CA19-9<200μ/ml時則切除的可能性大,腫瘤切除後CA19-9的值能恢復至正常水平者預後較好。當術後CA19-9再次上升則說明腫瘤復發或轉移,但慢性胰腺炎急性發作時,CA19-9再次上升則說明腫瘤復發或轉移,但慢性胰腺炎急性發作時,CA19-9亦可升高。
若能把CA19-9做爲普查的抗原則很有意義,將分界值定爲120μ/ml,高於120μ/ml的高度懷疑爲胰腺癌者,在總人羣中的陽性率爲85%。在有黃疸的人羣中則其陽性預測值爲100%。
2.SPan-1:SPan-1是由Balb/c小鼠與產生粘蛋白的人類胰腺癌的一個細胞系統免疫作用產生的單克隆抗體。Satake報道SPan-1診斷胰腺癌的敏感性、特異性及準確性分別爲81.4%、67.5%。71.1%。亦有的學者報道SPan-1的敏感性最高者可達100%,特異性可高達82.9%。
3.粘液糖蛋白:粘液糖蛋白經常出現於胰腺癌病人血清中。Parker研製了一種酶聯複合物(CAM17.1/WGA),將其加入檢測的血清中,可檢測出糖液糖蛋白的存在,而對胰腺癌作出診斷。單獨使用CAM17.1/WAG診斷胰腺癌,其敏感性爲78%,特異性爲76%。若與CA19-9聯合使用,可將敏感性提高到85%,特異性並未提高。
二. ras基因檢查
K-ras,H-ras、N-ras是人體的腫瘤中常見的致癌基因。ras基因的突變率在不同的腫瘤中是不相同的,在胰腺癌中突變率最高。K-ras基因的突變率約爲90%。K-ras的基因在胰腺癌中的突變主要發生在12密碼子。在胰腺癌發生的過程中K-ras基因12密碼子的突變率不同,在增生期爲26%,乳頭增生期爲46%,原位癌期爲76%,胰癌期爲80%,淋巴轉移期爲43%。K-ras的突變與腫瘤分期無明顯關係,但Ⅰ、Ⅱ期腫瘤K-ras的突變頻度高於Ⅲ、Ⅳ期腫瘤。而此突變爲最初的促發因素,不參加腫瘤後期發展過程。在胰腺腫瘤中,同一腫瘤K-ras的基因有不同突變會增加多發腫瘤病竈起源的可能性。K-ras基因的突變率增高與腫瘤的大小有明顯的相關性,小的腫瘤突變發生率明顯低於大腫瘤的突變率。胰腺癌K-ras基因突變率遠無高於壺腹癌的基因突變。用K-ras基因突變來檢測胰腺癌的前景如何,尚需進一步探索。
1. B型超聲圖像:從胰腺癌的大體病理特徵和結構,在超聲圖像上可有下列表現:
(1)低迴聲型:由於腫瘤回聲水平較正常爲低,則病變區與周圍胰腺組織間的境界較清楚,可見其呈不整齊、不規則或僞足樣伸展徵象。病變區呈散在不均勻分佈的低迴聲,後緣及遠側回聲有輕度增強或無明顯改變。
(2)不均勻回聲型:病變基本上呈低至中等水平回聲,散佈在粗大高回聲光點或密集成小團塊狀。與周圍組織間境界尚清楚,往往不規則,部分區域亦可模糊不清。因超聲衰減較多,則後緣及遠側回聲可輕度減弱。這類聲圖常發生在癌腫有出血壞死、或結締組織較豐富時。
(3)無回聲型:在病變區無回聲或僅有少許散在低迴聲光點。後緣及遠側回聲可有增強現象。這種聲圖少見,發生在癌腫組織呈膠凍樣的改變時。
(4)混合回聲型:病變區部分呈低至中回聲,部分呈高回聲,形成粗細不等,分佈不均勻的光點。並間有形態不一的無回聲區同時存在。癌腫與周圍組織間境界尚清楚。此種聲圖多發生在腫瘤內部出血聚集血液以及腫瘤液化壞死時。
(5)主胰管的改變:由於腫瘤的部位不同,主胰管可被推壓出現擴張、移位、扭曲、中斷以至串珠狀改變。緊靠近主胰管的腫瘤則可壓迫管壁出現弧形壓跡,也可被推移。當主胰管被癌腫侵犯時則管壁不光滑。
(6)膽管、血管的變化:胰頭部腫瘤壓迫膽管下端,則出現被壓迫上方的膽系不同程度的擴張。當腫瘤增大時,在其附近血管出現受壓之徵象。如門靜脈、下腔靜脈出現壓跡、推移、扁平等現象。
(1)胰頭癌的聲像圖:胰頭增大、增厚,形態不規則,若胰頭直徑>4cm則常提示有佔位病變;膽總管內徑增寬、膽囊增大可見膽泥的較均勻的回聲,肝內膽管亦相應擴張;主胰管及門靜脈、下腔靜脈受壓等現象。
(2)胰體癌的聲像圖:胰體部明顯增厚,不規則的突起;腫瘤區回聲呈低迴聲與兩側的胰腺組織間的境界有時模糊、有時清楚;主胰管及腹主動脈、下腔靜脈受壓現象。若脾靜脈受壓則脾臟呈淤血性腫大。當飲水後複查可見胃竇及胃角受壓,胃被推向前上方移位。
(3)胰尾癌的聲像圖:空腹探測胰尾常不易顯示,通過飲水後經“胃透聲窗”或從肋間通過脾臟,或由俯臥位從背部通過腎臟進行探測;飲水後如病變在小彎側,可見胃被推向前左方;病變靠近大彎時,則可見胃體被推向右移位。
Pasanen報道超聲診斷胰腺癌的敏感性、特異性、有效率分別爲61.9%、93.9%和91.6%。敏感性明顯低於CT及ERCP。超聲的假陰性之產生主要是因顯示不滿意所造成的,同時超聲對診斷<2cm的腫瘤較爲困難,敏感性僅爲55%。若將超聲與腫瘤標記物聯合使用,則可明顯提高其各自的敏感性,彌補單獨使用超聲之不足。近年來使用內窺鏡超聲(EUS)診斷胰腺癌,它是內窺鏡與超聲相結合的一項技術,擬由此而提高胰腺癌的檢出率。但其實用價值如何,尚需通過不斷的實踐方能得出結論。
3. CT掃描成像:CT對胰腺癌的診斷價值,在早期的研究中與B超似乎相差不多,近些年來對CT的平掃及增強掃描的配合則對胰腺癌的診斷價值更大。CT掃描的一個很重要的影像是:胰腺增大和胰周圍脂肪間隙的消失;又可顯示腫塊的部位、大小、密度、胰管有無擴張、血管是否受侵等。胰癌CT表現爲:胰頭外形增大、呈分葉狀,正常邊界的光滑曲線被破壞。若腫瘤液化壞死可表現爲腫瘤內低密度陰影。胰頭癌時則胰體、尾部常伴有水腫或萎縮。胰腺鉤突部腫瘤早期較易忽略,若胰腺鉤突部失去其特有的形狀,向前或向後兩片圓形凸起,並伸延至腸繫膜上靜脈的後方,則提示此區域內有腫瘤存在。鉤突部腫瘤的另一圖像是:它將從後面將腸繫膜上靜脈的後方,則提示此區域內有腫瘤存在。鉤突部腫瘤的另一圖像是:它將從後面將腸繫膜上動脈抬起,在橫斷面上表現爲腸繫膜上動脈伸長、變直。由於癌腫的局部浸潤,則胰腺周圍的脂肪間隙可中斷、破壞以致消失。胰腺癌的間接徵象爲胰管和膽總管的不同程度擴張。Zeiss對56例胰腺癌的增強CT進行了回顧性的分析,並與手術及Freeny的研究結果進行比較,認爲CT對判斷腫瘤不可切除的準確性較高,尤其是動態CT的動用,可靠性達100%;但對可切除性的判斷準確性較差。因CT不能顯示出細微的胰腺侵犯和表面轉移性病竈。Pasanen報道CT的敏感性、特異性及有效率分別爲95.2%、92.9%和96.6%。但CT對診斷<2cm的腫瘤,敏感性只有77%。
4.核磁共振成像(MRI):MRI對侷限於胰腺內小癌腫和判斷有無胰周擴散等,優於CT及B超。對胰腺癌診斷的徵象爲:T1加權像胰腺實質內侷限性信號減低,T2加權像上腫物與正常組織間密度比低,在使用上常受限;若T1加權像示腹膜後脂肪呈網狀低、中等信號可診爲早期局部受侵犯;胰周、胰腺後、胃、十二指腸、腎上腺、膽總管、肝門等受侵表示局部侵犯嚴重,無法切除。結合MRI檢查及病理學檢查的研究表明:T1加權像胰腺實質內侷限性信號減低中伴有信號增強區域爲實質部分,信號減弱區則有明顯的出血壞死。
5.內窺鏡逆行膽胰管造影(ERCP):ERCP檢測一方面可直接窺測胰管的病變,另一方面通過它進行活檢和刷洗而取得標本,以做出明確的病理診斷。因而其診斷的準確程度可在90%以上。胰腺癌約80%以上爲管上皮癌,而大部又在胰頭部故表現有胰頭部受累。胰管的表現:有不同程度的狹窄、中斷或移位,狹窄段胰管常有僵硬感。若胰頭部腫瘤巨大時則胰管顯影很短或不通暢。非完全梗阻者可顯示梗阻遠端明顯擴張。當胰管某處有不規則突起或毛刷樣改變時,則爲胰管可能與壞死癌竈溝通或形成瘻道。胰癌主要侵犯胰頭實質時,則胰管常表現爲被推移,受奪,若累及胰頭段膽管時可出現“雙管徵”或該段總膽管僵直、不規則以至扭曲。有人將胰腺癌分爲:狹窄型、閉塞型、胰實質缺損型、管內發育型、排擠壓迫型5種,小胰癌多表現爲狹窄型、閉塞型和胰野缺損型。目前ERCP對未侵及胰管的小癌腫診斷仍有困難。胰腺癌與慢性胰腺炎胰管的改變應予以鑑別、後者主胰管和2級分支呈不規則扭曲、狹窄或擴張交替,即謂之串珠狀改變。有的反覆性發作者,則可見多處囊性擴張,有些可見鈣化等。對胰管進行直接擴大攝影法有助於胰癌與慢性胰腺炎的鑑別。
雖然ERCP對胰腺癌診斷的準確率較高,但經檢出者,大部分已失去手術根治的機會。
6.經皮經肝穿刺膽管造影(PTC):對膽系疾病應用PTC檢查我們自50年代即開始,當時使用的粗針穿刺,無帶有電視的X線機,難度較大,但對一些複雜的膽道疾病診斷提供了積極的作用。70年代以來我們彩細針穿刺並在帶有電視的X線機監視下進行,幾乎無失敗者。爲防止深黃疸病人PTC後出現膽漏、腹膜炎,我們一般均在手術時,在手術檯上進行,隨即進行手術,因而PTC後併發症甚少。筆者等在用細針PTC以來的358例中僅1例出現腹膜炎而行急診手術,PTC對膽系疾病的診斷如膽管癌、良性狹窄等是一很好的方法。PTC的檢查一方面除外了膽系病變,同時亦可以見到胰頭癌對胰腺段膽管壓迫、侵襲的間接徵象;膽管受壓、推移、僵硬等。Bakkevdd總結了472名患者研究的結果,PTC對胰腺癌診斷的敏感性爲85%,對Ⅰ期病變診斷的敏感性爲78%。有人對深黃疸病人在行PTC後,爲減輕黃疸改用PTCD以行引流。我們認爲術前行PTCD增加了進行感染,一般不予以採用。
7.細針穿刺細胞細胞學檢查(FNA):在CT或B超導向下用FNA對胰腺癌進行診斷,大大的提高了診斷的正確性。可在術前經皮穿刺,亦可在術中直接穿刺。經皮穿刺需經過一些臟器,但由於穿刺針細只要掌握要領,一般少有併發症,是否會有穿刺針道腫瘤種植問題,亦很少見。1981年Beazlcy報告穿刺檢查之陽性率高達87~100%,1988年Warshaw總結性認爲細針穿刺細胞學檢查的準確率爲87%而無假陽性。
8.胰液的細胞學檢測:通過纖維十二指腸鏡獲取胰液,做細胞學檢查,但假陰性率較高。將內窺鏡直接插至胰管,直接吸取標本行細胞學診斷,尤其對胰體、尾癌診斷的準確性較高。若在術中置管收集胰液則可對隱匿性胰癌作出精確的定位診斷,有人應用此法可以發現原位胰癌。
9.選擇性血管造影(SAG):SAG在胰腺癌中的早期徵象與特徵是腫瘤對血管的浸潤。胰頭癌最早浸潤的血管是十二指腸動脈及其分支;胰體或胰尾部癌則可浸潤胰背動脈、胰大動脈、胰尾動脈及胰橫動脈。SAG則能顯示上述動脈,並使包繞胰腺上部的腹腔動脈顯影;導管插至腸繫膜上動脈,可顯示包繞胰腺下部的血管。導管插至胃十二指腸動脈和肝總動脈,可顯示胰頭的動脈;插入脾動脈則顯示胰體、尾部。通過這些血管的改變以診斷胰腺癌。受癌腫浸潤的血管則呈僵硬、狹窄或阻塞、管壁外形不規則等。若大的血管受侵如肝動脈、腹腔動脈、腸繫膜上動脈主幹等,則說明病變已至晚期無法切除。胰腺癌自身血管的變化,要通過超洗動脈造影,方可看到腫瘤內血管;細而捲曲和不規則的血管。
SAG對診斷<2cm的腫瘤有較高的準確性,其毛細血管期可以顯示小腫瘤引起的胰腺內血管受侵、阻塞以至與腫瘤部位相應的少血管區。若腫瘤侷限於導管上皮,且不伴有胰實質受侵時,則SAG不能發現。